YY 0053-1991
标准分类号
关联标准
出版信息
相关单位信息
标准简介
YY 0053-1991.
5.2 血室容量检验
在常压下将藏注满透析器中的蒸馏水注入100 mL量简中计量,应符合3. 2.2条中的规定。
5.3化学 性能试验方法
5.3.1试液制 备
取灭菌后的产品按公称纤维面积没责,以1m2*约用80ml.生理盐水的比例潍往满透析器血室,在37士1C放置24 h,然后稀郛至1000 mL备用。
5.3.2取5.3.1中的浸渍液,按《中华人民共和国药典》一九九O年版二部附录重金属检验法或分光光度法中原子吸收分光光度法进行。推荐使用原子吸收分光光度法测定微址金属含址.
5.4生物性能试验
5.4.1取5. 3.1中的投溃液,按《中华人民共和国药典》一九九O年版附录异常毒性检验法进行异常毒性检验,应符合4.4.1条的规定。
5.4.2透析器浴血试验方法见附录A.
5.4.3取5.3. 1中的浸演液,按(中华人民共和国药典》-九九O年版附录无菌检验法进行无菌检验,应符合4. 4. 3条的规定。
5.4.4取5.3.1中的浸渍液,按《中华人民共和国药典》一九九O年版附录热原检验法进行热原检验,应符合4. 4.4条的规定。
5.5物理机械性能试验
5.5.1原理
将水注入器件后,使器件承受正压,观察是否有泄漏或共他故陈。如合适,使器件承受负压,观察是否有泄漏或其他故障。
5.5.2以样品最大路膜压 力梯度(6.5 kPa),向器件滥注37士1C牛或猪血7 h,器具安装见图3.
5.2 血室容量检验
在常压下将藏注满透析器中的蒸馏水注入100 mL量简中计量,应符合3. 2.2条中的规定。
5.3化学 性能试验方法
5.3.1试液制 备
取灭菌后的产品按公称纤维面积没责,以1m2*约用80ml.生理盐水的比例潍往满透析器血室,在37士1C放置24 h,然后稀郛至1000 mL备用。
5.3.2取5.3.1中的浸渍液,按《中华人民共和国药典》一九九O年版二部附录重金属检验法或分光光度法中原子吸收分光光度法进行。推荐使用原子吸收分光光度法测定微址金属含址.
5.4生物性能试验
5.4.1取5. 3.1中的投溃液,按《中华人民共和国药典》一九九O年版附录异常毒性检验法进行异常毒性检验,应符合4.4.1条的规定。
5.4.2透析器浴血试验方法见附录A.
5.4.3取5.3. 1中的浸演液,按(中华人民共和国药典》-九九O年版附录无菌检验法进行无菌检验,应符合4. 4. 3条的规定。
5.4.4取5.3.1中的浸渍液,按《中华人民共和国药典》一九九O年版附录热原检验法进行热原检验,应符合4. 4.4条的规定。
5.5物理机械性能试验
5.5.1原理
将水注入器件后,使器件承受正压,观察是否有泄漏或共他故陈。如合适,使器件承受负压,观察是否有泄漏或其他故障。
5.5.2以样品最大路膜压 力梯度(6.5 kPa),向器件滥注37士1C牛或猪血7 h,器具安装见图3.
标准图片预览



标准内容
中华人民共和国医药行业标准
YY0053--91
空心纤维透析器
1991-10-12发布
国家医药管理局发布
1992-07-01实施
中华人民共和国医药行业标准
空心纤维透析器
主题内容与适用范围
YY0053--91
本标准规定了一次性使用无菌空心纤维血液透析器(以下简称透析器)的产品分类、技术要求、试验方法、检验规则、标志、包装、运输、贮存的要求。本标准适用于一次性使用无菌空心纤维血液透析器,本产品配合血液透析装置供急慢性肾功能衰竭等者进行血液透析用。
2引用标准
包装储运图示标志
GB2828
逐批检查计数抽样程序及抽样表(适用于连续批的检查)GB2829周期检查计数抽样程序及抽样表(适用于生产过程稳定性的检查)3产品分类
3.1型式为空心纤维型。
3.2透析器的基本参数应符合下列规定。3.2.1透析器有效透析面积不低于公称面积90%。3.2.2透析器血容应符合表1的规定:表1
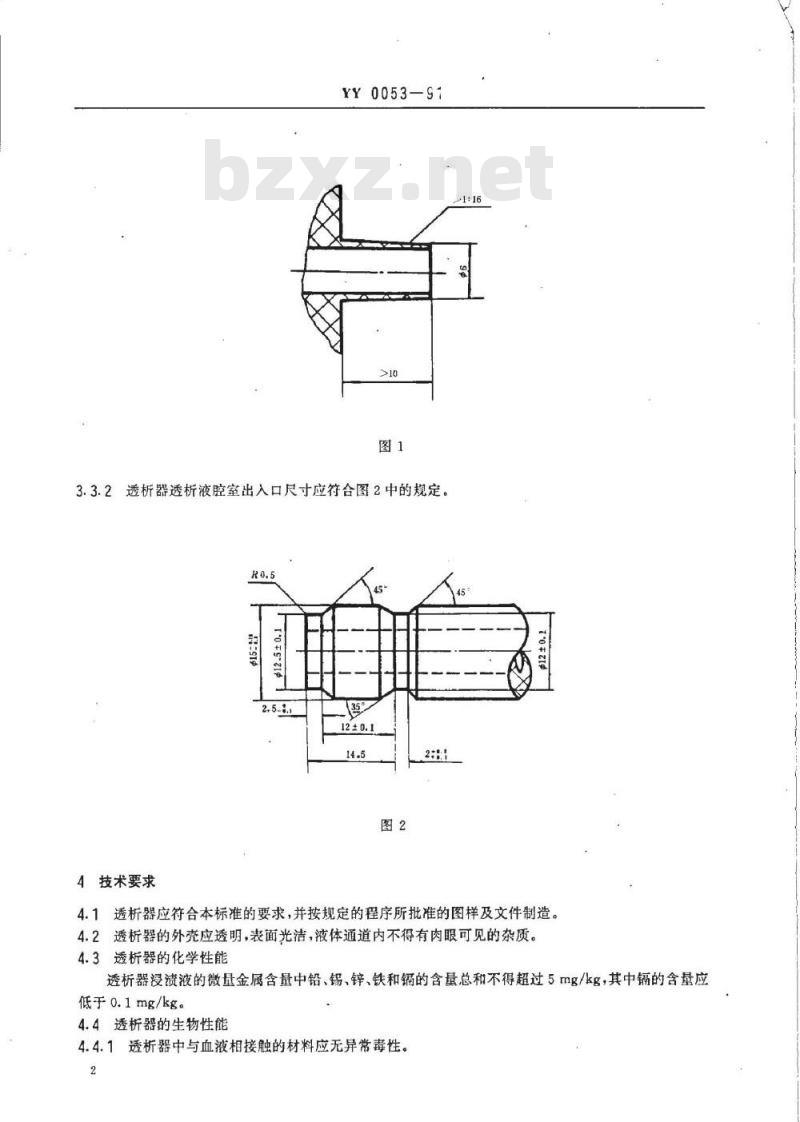
3.2.3透析器血液流率应大于200mL/min。3.2.4透析器透析液流率应大于500mL/min。3.3透析器的基本尺寸应符合下列图样规定。3.3.1透析器血室出入口尺寸应符合图1中的规定。国家医药管理局1991-10-12批准TTTKAONIKAca
血室容量
不大于80mL
不大于60mL
1992-07-01实施
YY0053-91
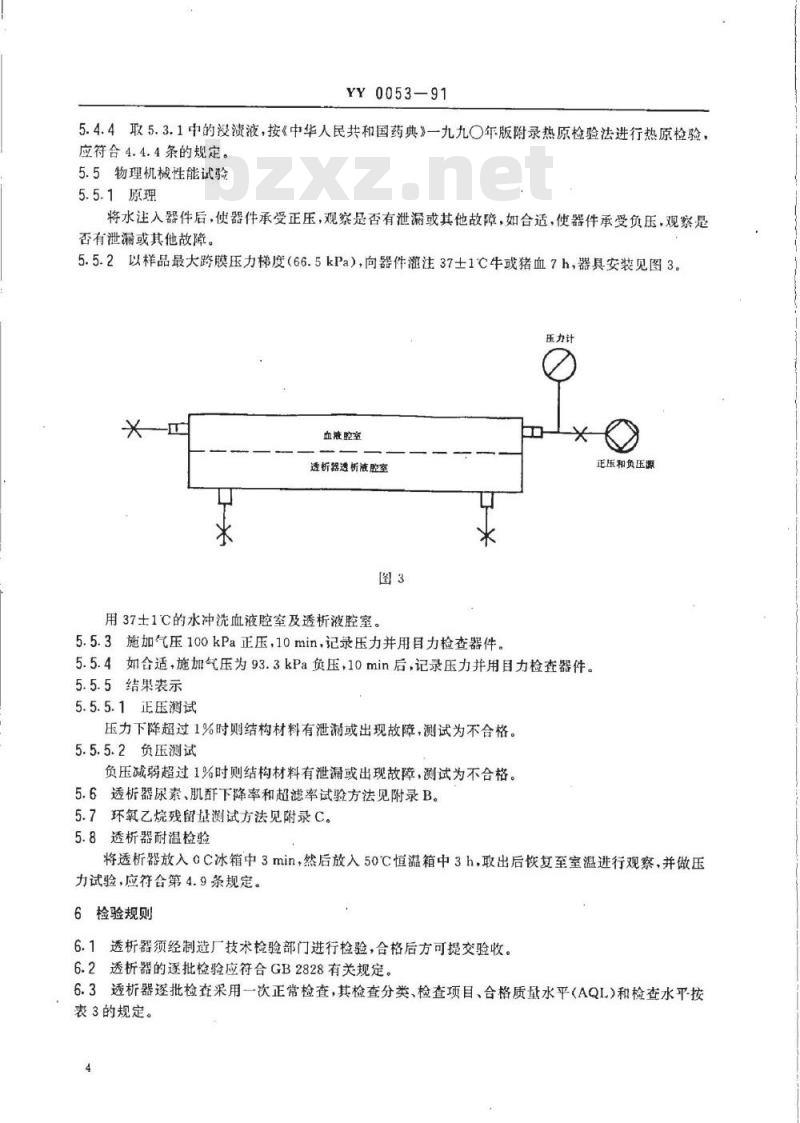
3.3.2透析器透析液腔室出入口尺寸应符合图2中的规定,Ro.
4技术要求
4.1透析器应符合本标准的要求,并按规定的程序所批准的图样及文件制造。4.2透析器的外壳应透明,表面光洁,液体通道内不得有肉眼可见的杂质。4.3透析器的化学性能
透析器浸渍液的微量金属含量中铅、锡、锌、铁和锅的含量总和不得超过5mg/kg,其中镐的含量应低于0.1mg/kg。
4.4透析器的生物性能
4.4.1透析器中与血液相接触的材料应无异常毒性。2
YY0053—91
4.4.2透析器中与血液相接触的材料应无溶血反应。4.4.3透析器应无菌。
4.4.4透析器应无致热源。
4.5透析器的物理机械性能
4.5.1透析器血室应能承受100kPa的压力。4.5.2透析器透析液腔室应承受的压力为:正压:100kPa
负压:低于大气压93.3kPa。
4.5.3透析器密封性能良好,应无泄瀚现象。4.6透析器的透析性能
4.6.1透析器的尿素、肌酐模拟血液透析四小时下降率应不小于90%。4.6.2透析器的超滤率应符合表2的规定:表2
超德率,ml/kPa·h
4.7透析器用环氧乙烷气体灭菌,灭菌后14d环氧乙烷残留基应不大于10ppm。4.8透析器经灭菌后,在遵守贮存规定条件下,从灭菌之日起有效期为二年。4.9透析器在0~50C温度范围内不应有变形和破裂。5试验方法
5.1透析面积按下式计算;
S=元DI.n× 10-6
式中:S-
一有效膜面积,m2;
空心纤维内径,mm:
一空心纤维有效长度,mm;
n—空心纤维根数。
5.2血室容量检验
在常压下将滋注满透析器中的蒸水注入100mL量筒简中计量,应符合3.2.2条中的规定。5.3化学性能试验方法
5.3.1试液制备
取灭菌后的产品按公称纤维面积没渍,以1m2约用80ml,生理盐水的比例灌注满透析器血室,在37±1℃放置24h,然后稀释至1000mL备用。5.3.2取.5.3.1中的浸渍液,按《中华人民共和国药典》一九九O年版二部附录重金检验法或分光光度法中原子吸收分光光度法进行。推荐使用原子吸收分光光度法测定微量金属含量。5.4生物性能试验
5.4.1取5.3.1中的浸渍液,按《中华人民共和国药典》一九九O年版附录异常声性检验法进行异常毒性检验,应符合4.4.1条的规定。5.4.2透析器溶血试验方法见附录A。5.4.3取5.3.1中的没渍液,按《中华人民共和国药典》一九九O年版附录无菌检验法进行无菌检验,应符合4.4.3条的规定。
TYIKANiKAca
YY0053-—91
5.4.4取5.3.1中的没渍液,按《中华人民共和国药典》一九九年版附录热原检验法进行热原检验,应符合4.4.4条的规定。
5.5物理机械性能试验
5.5.1原理
将水注入器件后,使器件承受正压,观察是否有泄漏或其他故障,如合适,使器件承受负压,观察是否有泄漏或其他故障。
5.5.2以样品最大跨膜压力梯度(66.5kPa),向器件注37士1℃牛或猪血7h,器具安装见图3压力计
血液腔室
透析器透析液腔室
用37士1℃的水冲洗血液腔室及透析液腔室。*
5.5.3施加气压100kPa正压,10min,记录压力并用目力检查器件。5.5.4如合适,施加气压为93.3kPa负压,10min后,记录压力并用目力检查器件。5.5.5结果表示
5.5.5.1正压测试
压力下降超过1%时则结构材料有泄漏或出现故障,测试为不合格。5.5.5.2负压测试
负压减弱超过1%时则结构材料有泄漏或出现故障,测试为不合格。5.6透析器尿素、肌酐下降率和超滤率试验方法见附录B。5.7环氧乙烷残留量测试方法见附录C。5.8透析器耐温检验
正压和负压源
将透析器放入αC冰箱中3min,然后放入50℃恒温箱中3h,取出后恢复至室温进行观察,并做压力试验,应符合第4.9条规定。
6检验规则
6.1透析器须经制造厂技术检验部门进行检验,合格后方可提交验收。6.2透析器的逐批检验应符合GB2828有关规定。6.3透析器逐批检在采用一次正常检查,其检查分类、检查项目、合格质量水平(AQL)和检查水平按表3的规定。
检查分类
试验组
检查项目
检查水平
全部合格
YY0053-91
注:①A、B两类由生产厂分别提供测试报告和检验记录。②每一消毒批应提供灭菌测试报告。B
3.2.13.2.2
3.3.13.3.2
③每生产批应提供毒性、热源测试报告。6.4对初次检验不合格的再提交检查时,一般只检查导致拒收的试验组,并采用加严检查。在修正缺陷时,若影响到其他试验组,需再检查哪些项目,由质部门和接受方决定。6.5周期检查
6.5.1透析器的周期检查应符合GB2829的规定。6.5.2在下列情况下应进行周期检查。6.5.2.1连续生产中做定期检查。6.5.2.2在工艺、配方或材料有重大变动时。6.5.2.3上级质量监督部门规定抽查时。6.5.2.4新产品投产或老产品转产时。6.5.3透析器的周期检查采用一次抽样方案,其检查分类、不合格质量水平(RQL)和判别水平按表4规定。
检查分类
检查组
检查项目
判别水平
检查周期
30(A=0R1)
每年一次
65(A=1R-2)
每半年一次
每半年一次
注;4.4.1.4.4.2项,每一进料批为一周期。6.5.4周期检查应在逐批检查合格后进行,周期检查不合格的处理按GB2829规定执行。7标志、包装、运输、贮存
7.1标志、包装
7.1.1每只透析器在外壳明显位暨应有下列标志:TiiKAoNiKAca
制造厂名称;
产品名称;
生产批号:
灭菌方法;
血液和透析液流动的方向;
透析面积;
最高使用压力;
有效期二年;
一次性使用。
YY0053—91
每只透析器应装入复合薄膜袋包装封口,密封后再装入有型槽的纸箱或盒,箱内应有使用说明书和检验合格证各一份。
7. 1. 2. 1
使用说明书应有下列内容:
制造厂名称;
产品名称、规格、血室容量;
灭菌方法和无致热源说明;
一次性使用说明;
注意事项和警告;
推荐的抗凝血措施;
膜的材料名称、规格:
清除率、超滤率曲线图;
推荐使用步骤;www.bzxz.net
最高使用压力、最大流量。
检验合格证上应有下列标志,
制造厂名称;
产品名称、型号:
检验员代号:
检验日期。
每20只透析器装一瓦楞纸箱,箱上应有下列标志:制造厂名称或地址;
产品名称和型号:
数量,
毛重:
体积(长×宽×高);
生产批号:
灭菌日期:
“小心轻放”、“切勿重压”“怕湿”“怕热”、“易碎”字样或标志,按GB191执行。箱上的字样和标记应保证不因历时较久而模糊不清。7.2运输要求按订货合同规定
包装后的透析器应贮存在室温、相对湿度不超过80%,无腐蚀气体并通风良好的室内。7.3
A1目的
YY0053-91
附录A
溶血试验方法
(补充件)
通过材料与血液直接接触,测定红细胞释放的血红蛋白量以了解材料的溶血程度。A2范围
本试验适用于检测医用材料的体外溶血作用。A3试剂
A3.12%草酸钾。
A3.20.9%氟化钠溶液。
A3.3蒸馏水。
A3.4新鲜稀释抗凝兔血
A3.4.1由新采的兔血20mL加2%草酸钾1mL制备成新鲜抗凝免血。A3.4.2将新鲜抗凝免血8mL加0.9%氮化钠溶液10mL进行稀释。A4仪器
A4.1离心机。
A4.2水浴箱(37:上0.5℃)。
A4.3试管。
A4.4移液管。
A4.5分光光度计。
A5操作步骤
A5.1称取试样每份5g·共三份
自来水冲洗,适量蒸馏水摇洗两次,每次约1min。将试样切成5×25~30mm小条,放入试管A5.2
加0.9%氯化钠溶液10mL,置37℃水浴中30min。A5.3
A5.4加稀释免血0.2mL,轻轻混匀,37C水浴继续保温60minA5.5离心5min(750g)。
A5.6阳性对照用蒸馏水10mL加稀释免血0.2mL.阴性用0.9%氯化钠溶液10mL加稀释免血0.2mL,保温条件与试验管相同。A5.7吸取上清液移入比色皿内,于分光光度计545nm测定各管吸光度。A5.8若阴性对照管的吸光度大于0.03,此次试验应放弃。阳性对照管的吸光度值应为0.8士C.3.A6结果表示
溶血程度用%表示,按下式计算:X(%)
TiiKANiKAca
试验样品吸光度;
D。—阴性对照吸光度;
D阳性对照吸光度。
A7试验报告
A7.1试样的溶血程度以%表示。
YY0053—91
A7.2试验材料的名称、商品名、生产厂家,以及每个试管所用试验材料的量。A7.3各试验管和对照管的吸光度均取三管的乎均值。A7.4若材料的溶血率<5%,则材料符合医用材料的溶血试验要求;若溶血率>5%,则示试验材料有溶血作用。
附录B
透析器尿素、肌酐下降率和超滤率检验方法(补充件)
B1尿素、肌酐下降率测定
B1.1标准模拟液配制
分别精确称取尿素150mg,肌酐10mg,尿素以蒸馏水约20mL溶解,肌酐以少量0.1N盐酸加蒸馏水微热溶解,然后将各溶解后的溶液并人同一的100mL容量瓶中.稀释至刻度摇匀备用。B1.2显色剂的配制
B1.2.1尿素显色剂
对二甲氨基苯甲醛的配制
精确称取2.5g分析纯对二甲氨基苯甲醛,溶解在无水乙醇中,稀释至50mL左右,加入5mL95%~98%硫酸,以无水乙醇稀释至100mL容量瓶刻度线,摇匀,溶液星黄色,贮存冰箱中。B1.2.2肌酐显色剂
精确称取苦味酸(三硝基苯酚)1.5g,以100mL水加热溶解,冷却后瓶底有结晶析出(已饱和),取上层黄色清液存于暗处备用。
显色剂配制:将上述苦味酸饱和溶液5份与10%氢氧化钠溶液1份,配制成体积比为5:1的溶液应在使用时现配,否则会有结晶析出。注:标定方法:在10mL苦味酸清液滴加1%酚酰指示剂一滴。用0.1N氢氧化钠滴定至呈粉红色,若用去5.2~5.4mL氢氧化钠,证明苦味酸清液已达饱和,10%氢氧化钠溶液应存于料瓶中保存,B1.3标准曲线的绘制
B1.3.1尿素标准曲线的绘制
各吸取4mL标准模拟液,分别加水稀释成各种浓度的应用液,然后各取2mL应用液并加入2mL尿素显色剂,空白液则以2mL水加2mL尿素显色剂配成。在37℃恒温水槽中加热15.min,冷却后,注入光径为1cm比色皿中,进行比色,用430um波长,测定其光密度E,然后以浓度为横坐标,光密度为纵坐标,绘制标准曲线。B1.3.2肌酐标准曲线的绘制
各吸取不同量的标准模拟液,分别加水,稀释成各种浓度的应用液,然后各取4mL应用液加2mL显色剂,空白液则以4mL水加2mL显色剂配成。上述各试液在37℃水槽中加热15min,冷却后加入光径为1cm比色m中,用510μm波长测定光密度E。然后以浓度为横坐标,光密度为纵坐标作图绘制标准曲线。8
YY0053-—91
B1.4计算公式
B1.4.1尿素总的下降率(%)-透析前尿素浓度e一透析后尿素浓度c透析前尿素浓度co
B1.4.2肌酐总的下降率(%)=透析前肌酐浓度c一透析后肌酐浓度c××100%
透析前肌酐浓度co
B1.5模拟透析
采用近似临床治疗条件,用6000mL模拟液进行透析,所用负压为13.3kPa,模拟液流率应为200mL/min,透析液流率应为500mL/min,在此条件下工作,每隔1h补充水液至刻度线,4h后进行取样测试(模拟透析系统见图B1)。
压力控制器
补充液
模拟减
B2超滤率测定
B2.1模拟液按B1.1配制。
B2.2测定方法
整液送折器
透析液出口压力
透析液入口压力
透析液
供给装置
用模拟液6000mL于玻璃容量瓶中,并标有刻度线,在近似于临床条件下(模拟液流率为200mL/min,透析液流率为500mL/min,负压为13.3kPa)进行测定,每隔半小时用量简补充溶液至刻度线,并记录补充溶液量,连续4h取得总超滤量,计算出每小时超滤量(超滤系统见图B1)。B2.3计算公式
超滤率=
补充溶液总量
超滤总时间(h)
TKAoNKAca
C1试液制备
YY0053—91
附录C
透析器灭菌后环氧乙烷残留量测试方法(补充件)
C1.1取灭菌后14天的透析器一只和1000mL注射用水备用。C1.2按临床条件以400mL注射用水冲洗血室,同时用注射用水充满透析液室,然后把100mL注射用水灌满透析器血空,余液溢出,用塞子封住四个出入口,在37C土1℃条件下放置6h。C1.3对血室溶液加压,使之全部注入玻璃盛器,以10cm2:1mL的比例稀释至透析器公称面积所需的溶液量,作待测液备用。
例:透析面积1m,则测试液应稀释至1000mL,待测液在室温下保存时间段长不超过24h。C2环氧乙烷测试方法
C2.1技术要求
仪器,气相色谱议;
方法:顶端空间法;
条件:主温70℃,进样口及检测器温度100℃,灵敏度:10*×2(或视具体仪器而定);d.
进样量:1mL(气体),反应瓶容积约为60mL。e.
C2.2标准储备液的制备
C2.2.1用10mL玻璃注射器直接从一环氧乙烷钢瓶中抽取10mL左右的环氧乙烷纯气体(注意密封),另用1mL注射器从上述10mL纯环氧乙烷气体中抽取1mL,直接注入100mL容量瓶中(该容基瓶中已预先用注射用水标到刻度,用翻口橡皮塞封口),摇匀。C2.2.2标准溶液的配制:从上述储备液中分别取1.1mL、2.2mL、3.3mL,分别注入三个反应瓶中再分别加水至10mL,用翻口橡皮塞封口。C2.2.3取C1.1~C1.3制备好的待测试液(样品液)10mL于另一反应瓶中,用翻口橡皮塞封口。C2.3测定
C2.3.1将上述已制好的三个标准溶液,在60C水浴中恒温30min,从反应瓶上端空间中抽取气体1mL进样,各重复3~5次(每一个标液),取其平均值。C2.3.2从上述标准溶液结果中,绘制标准曲线。C2.3.3用同样方法测定样品液,并将测定结果从对应的标准曲线上查得环氧乙烷的含量(或用计节法也可)。
C2.3.4含量单位mg/mL。
附加说明:
本标准由国家医药管理局提出。YY0053-91
本标准由国家医药管理局广州医疗器械标准化技术分归口单位归口。本标准由上海医疗器械研究所负责起草。本标准起草人竺锡明。
TTKAONYKAca
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
YY0053--91
空心纤维透析器
1991-10-12发布
国家医药管理局发布
1992-07-01实施
中华人民共和国医药行业标准
空心纤维透析器
主题内容与适用范围
YY0053--91
本标准规定了一次性使用无菌空心纤维血液透析器(以下简称透析器)的产品分类、技术要求、试验方法、检验规则、标志、包装、运输、贮存的要求。本标准适用于一次性使用无菌空心纤维血液透析器,本产品配合血液透析装置供急慢性肾功能衰竭等者进行血液透析用。
2引用标准
包装储运图示标志
GB2828
逐批检查计数抽样程序及抽样表(适用于连续批的检查)GB2829周期检查计数抽样程序及抽样表(适用于生产过程稳定性的检查)3产品分类
3.1型式为空心纤维型。
3.2透析器的基本参数应符合下列规定。3.2.1透析器有效透析面积不低于公称面积90%。3.2.2透析器血容应符合表1的规定:表1
3.2.3透析器血液流率应大于200mL/min。3.2.4透析器透析液流率应大于500mL/min。3.3透析器的基本尺寸应符合下列图样规定。3.3.1透析器血室出入口尺寸应符合图1中的规定。国家医药管理局1991-10-12批准TTTKAONIKAca
血室容量
不大于80mL
不大于60mL
1992-07-01实施
YY0053-91
3.3.2透析器透析液腔室出入口尺寸应符合图2中的规定,Ro.
4技术要求
4.1透析器应符合本标准的要求,并按规定的程序所批准的图样及文件制造。4.2透析器的外壳应透明,表面光洁,液体通道内不得有肉眼可见的杂质。4.3透析器的化学性能
透析器浸渍液的微量金属含量中铅、锡、锌、铁和锅的含量总和不得超过5mg/kg,其中镐的含量应低于0.1mg/kg。
4.4透析器的生物性能
4.4.1透析器中与血液相接触的材料应无异常毒性。2
YY0053—91
4.4.2透析器中与血液相接触的材料应无溶血反应。4.4.3透析器应无菌。
4.4.4透析器应无致热源。
4.5透析器的物理机械性能
4.5.1透析器血室应能承受100kPa的压力。4.5.2透析器透析液腔室应承受的压力为:正压:100kPa
负压:低于大气压93.3kPa。
4.5.3透析器密封性能良好,应无泄瀚现象。4.6透析器的透析性能
4.6.1透析器的尿素、肌酐模拟血液透析四小时下降率应不小于90%。4.6.2透析器的超滤率应符合表2的规定:表2
超德率,ml/kPa·h
4.7透析器用环氧乙烷气体灭菌,灭菌后14d环氧乙烷残留基应不大于10ppm。4.8透析器经灭菌后,在遵守贮存规定条件下,从灭菌之日起有效期为二年。4.9透析器在0~50C温度范围内不应有变形和破裂。5试验方法
5.1透析面积按下式计算;
S=元DI.n× 10-6
式中:S-
一有效膜面积,m2;
空心纤维内径,mm:
一空心纤维有效长度,mm;
n—空心纤维根数。
5.2血室容量检验
在常压下将滋注满透析器中的蒸水注入100mL量筒简中计量,应符合3.2.2条中的规定。5.3化学性能试验方法
5.3.1试液制备
取灭菌后的产品按公称纤维面积没渍,以1m2约用80ml,生理盐水的比例灌注满透析器血室,在37±1℃放置24h,然后稀释至1000mL备用。5.3.2取.5.3.1中的浸渍液,按《中华人民共和国药典》一九九O年版二部附录重金检验法或分光光度法中原子吸收分光光度法进行。推荐使用原子吸收分光光度法测定微量金属含量。5.4生物性能试验
5.4.1取5.3.1中的浸渍液,按《中华人民共和国药典》一九九O年版附录异常声性检验法进行异常毒性检验,应符合4.4.1条的规定。5.4.2透析器溶血试验方法见附录A。5.4.3取5.3.1中的没渍液,按《中华人民共和国药典》一九九O年版附录无菌检验法进行无菌检验,应符合4.4.3条的规定。
TYIKANiKAca
YY0053-—91
5.4.4取5.3.1中的没渍液,按《中华人民共和国药典》一九九年版附录热原检验法进行热原检验,应符合4.4.4条的规定。
5.5物理机械性能试验
5.5.1原理
将水注入器件后,使器件承受正压,观察是否有泄漏或其他故障,如合适,使器件承受负压,观察是否有泄漏或其他故障。
5.5.2以样品最大跨膜压力梯度(66.5kPa),向器件注37士1℃牛或猪血7h,器具安装见图3压力计
血液腔室
透析器透析液腔室
用37士1℃的水冲洗血液腔室及透析液腔室。*
5.5.3施加气压100kPa正压,10min,记录压力并用目力检查器件。5.5.4如合适,施加气压为93.3kPa负压,10min后,记录压力并用目力检查器件。5.5.5结果表示
5.5.5.1正压测试
压力下降超过1%时则结构材料有泄漏或出现故障,测试为不合格。5.5.5.2负压测试
负压减弱超过1%时则结构材料有泄漏或出现故障,测试为不合格。5.6透析器尿素、肌酐下降率和超滤率试验方法见附录B。5.7环氧乙烷残留量测试方法见附录C。5.8透析器耐温检验
正压和负压源
将透析器放入αC冰箱中3min,然后放入50℃恒温箱中3h,取出后恢复至室温进行观察,并做压力试验,应符合第4.9条规定。
6检验规则
6.1透析器须经制造厂技术检验部门进行检验,合格后方可提交验收。6.2透析器的逐批检验应符合GB2828有关规定。6.3透析器逐批检在采用一次正常检查,其检查分类、检查项目、合格质量水平(AQL)和检查水平按表3的规定。
检查分类
试验组
检查项目
检查水平
全部合格
YY0053-91
注:①A、B两类由生产厂分别提供测试报告和检验记录。②每一消毒批应提供灭菌测试报告。B
3.2.13.2.2
3.3.13.3.2
③每生产批应提供毒性、热源测试报告。6.4对初次检验不合格的再提交检查时,一般只检查导致拒收的试验组,并采用加严检查。在修正缺陷时,若影响到其他试验组,需再检查哪些项目,由质部门和接受方决定。6.5周期检查
6.5.1透析器的周期检查应符合GB2829的规定。6.5.2在下列情况下应进行周期检查。6.5.2.1连续生产中做定期检查。6.5.2.2在工艺、配方或材料有重大变动时。6.5.2.3上级质量监督部门规定抽查时。6.5.2.4新产品投产或老产品转产时。6.5.3透析器的周期检查采用一次抽样方案,其检查分类、不合格质量水平(RQL)和判别水平按表4规定。
检查分类
检查组
检查项目
判别水平
检查周期
30(A=0R1)
每年一次
65(A=1R-2)
每半年一次
每半年一次
注;4.4.1.4.4.2项,每一进料批为一周期。6.5.4周期检查应在逐批检查合格后进行,周期检查不合格的处理按GB2829规定执行。7标志、包装、运输、贮存
7.1标志、包装
7.1.1每只透析器在外壳明显位暨应有下列标志:TiiKAoNiKAca
制造厂名称;
产品名称;
生产批号:
灭菌方法;
血液和透析液流动的方向;
透析面积;
最高使用压力;
有效期二年;
一次性使用。
YY0053—91
每只透析器应装入复合薄膜袋包装封口,密封后再装入有型槽的纸箱或盒,箱内应有使用说明书和检验合格证各一份。
7. 1. 2. 1
使用说明书应有下列内容:
制造厂名称;
产品名称、规格、血室容量;
灭菌方法和无致热源说明;
一次性使用说明;
注意事项和警告;
推荐的抗凝血措施;
膜的材料名称、规格:
清除率、超滤率曲线图;
推荐使用步骤;www.bzxz.net
最高使用压力、最大流量。
检验合格证上应有下列标志,
制造厂名称;
产品名称、型号:
检验员代号:
检验日期。
每20只透析器装一瓦楞纸箱,箱上应有下列标志:制造厂名称或地址;
产品名称和型号:
数量,
毛重:
体积(长×宽×高);
生产批号:
灭菌日期:
“小心轻放”、“切勿重压”“怕湿”“怕热”、“易碎”字样或标志,按GB191执行。箱上的字样和标记应保证不因历时较久而模糊不清。7.2运输要求按订货合同规定
包装后的透析器应贮存在室温、相对湿度不超过80%,无腐蚀气体并通风良好的室内。7.3
A1目的
YY0053-91
附录A
溶血试验方法
(补充件)
通过材料与血液直接接触,测定红细胞释放的血红蛋白量以了解材料的溶血程度。A2范围
本试验适用于检测医用材料的体外溶血作用。A3试剂
A3.12%草酸钾。
A3.20.9%氟化钠溶液。
A3.3蒸馏水。
A3.4新鲜稀释抗凝兔血
A3.4.1由新采的兔血20mL加2%草酸钾1mL制备成新鲜抗凝免血。A3.4.2将新鲜抗凝免血8mL加0.9%氮化钠溶液10mL进行稀释。A4仪器
A4.1离心机。
A4.2水浴箱(37:上0.5℃)。
A4.3试管。
A4.4移液管。
A4.5分光光度计。
A5操作步骤
A5.1称取试样每份5g·共三份
自来水冲洗,适量蒸馏水摇洗两次,每次约1min。将试样切成5×25~30mm小条,放入试管A5.2
加0.9%氯化钠溶液10mL,置37℃水浴中30min。A5.3
A5.4加稀释免血0.2mL,轻轻混匀,37C水浴继续保温60minA5.5离心5min(750g)。
A5.6阳性对照用蒸馏水10mL加稀释免血0.2mL.阴性用0.9%氯化钠溶液10mL加稀释免血0.2mL,保温条件与试验管相同。A5.7吸取上清液移入比色皿内,于分光光度计545nm测定各管吸光度。A5.8若阴性对照管的吸光度大于0.03,此次试验应放弃。阳性对照管的吸光度值应为0.8士C.3.A6结果表示
溶血程度用%表示,按下式计算:X(%)
TiiKANiKAca
试验样品吸光度;
D。—阴性对照吸光度;
D阳性对照吸光度。
A7试验报告
A7.1试样的溶血程度以%表示。
YY0053—91
A7.2试验材料的名称、商品名、生产厂家,以及每个试管所用试验材料的量。A7.3各试验管和对照管的吸光度均取三管的乎均值。A7.4若材料的溶血率<5%,则材料符合医用材料的溶血试验要求;若溶血率>5%,则示试验材料有溶血作用。
附录B
透析器尿素、肌酐下降率和超滤率检验方法(补充件)
B1尿素、肌酐下降率测定
B1.1标准模拟液配制
分别精确称取尿素150mg,肌酐10mg,尿素以蒸馏水约20mL溶解,肌酐以少量0.1N盐酸加蒸馏水微热溶解,然后将各溶解后的溶液并人同一的100mL容量瓶中.稀释至刻度摇匀备用。B1.2显色剂的配制
B1.2.1尿素显色剂
对二甲氨基苯甲醛的配制
精确称取2.5g分析纯对二甲氨基苯甲醛,溶解在无水乙醇中,稀释至50mL左右,加入5mL95%~98%硫酸,以无水乙醇稀释至100mL容量瓶刻度线,摇匀,溶液星黄色,贮存冰箱中。B1.2.2肌酐显色剂
精确称取苦味酸(三硝基苯酚)1.5g,以100mL水加热溶解,冷却后瓶底有结晶析出(已饱和),取上层黄色清液存于暗处备用。
显色剂配制:将上述苦味酸饱和溶液5份与10%氢氧化钠溶液1份,配制成体积比为5:1的溶液应在使用时现配,否则会有结晶析出。注:标定方法:在10mL苦味酸清液滴加1%酚酰指示剂一滴。用0.1N氢氧化钠滴定至呈粉红色,若用去5.2~5.4mL氢氧化钠,证明苦味酸清液已达饱和,10%氢氧化钠溶液应存于料瓶中保存,B1.3标准曲线的绘制
B1.3.1尿素标准曲线的绘制
各吸取4mL标准模拟液,分别加水稀释成各种浓度的应用液,然后各取2mL应用液并加入2mL尿素显色剂,空白液则以2mL水加2mL尿素显色剂配成。在37℃恒温水槽中加热15.min,冷却后,注入光径为1cm比色皿中,进行比色,用430um波长,测定其光密度E,然后以浓度为横坐标,光密度为纵坐标,绘制标准曲线。B1.3.2肌酐标准曲线的绘制
各吸取不同量的标准模拟液,分别加水,稀释成各种浓度的应用液,然后各取4mL应用液加2mL显色剂,空白液则以4mL水加2mL显色剂配成。上述各试液在37℃水槽中加热15min,冷却后加入光径为1cm比色m中,用510μm波长测定光密度E。然后以浓度为横坐标,光密度为纵坐标作图绘制标准曲线。8
YY0053-—91
B1.4计算公式
B1.4.1尿素总的下降率(%)-透析前尿素浓度e一透析后尿素浓度c透析前尿素浓度co
B1.4.2肌酐总的下降率(%)=透析前肌酐浓度c一透析后肌酐浓度c××100%
透析前肌酐浓度co
B1.5模拟透析
采用近似临床治疗条件,用6000mL模拟液进行透析,所用负压为13.3kPa,模拟液流率应为200mL/min,透析液流率应为500mL/min,在此条件下工作,每隔1h补充水液至刻度线,4h后进行取样测试(模拟透析系统见图B1)。
压力控制器
补充液
模拟减
B2超滤率测定
B2.1模拟液按B1.1配制。
B2.2测定方法
整液送折器
透析液出口压力
透析液入口压力
透析液
供给装置
用模拟液6000mL于玻璃容量瓶中,并标有刻度线,在近似于临床条件下(模拟液流率为200mL/min,透析液流率为500mL/min,负压为13.3kPa)进行测定,每隔半小时用量简补充溶液至刻度线,并记录补充溶液量,连续4h取得总超滤量,计算出每小时超滤量(超滤系统见图B1)。B2.3计算公式
超滤率=
补充溶液总量
超滤总时间(h)
TKAoNKAca
C1试液制备
YY0053—91
附录C
透析器灭菌后环氧乙烷残留量测试方法(补充件)
C1.1取灭菌后14天的透析器一只和1000mL注射用水备用。C1.2按临床条件以400mL注射用水冲洗血室,同时用注射用水充满透析液室,然后把100mL注射用水灌满透析器血空,余液溢出,用塞子封住四个出入口,在37C土1℃条件下放置6h。C1.3对血室溶液加压,使之全部注入玻璃盛器,以10cm2:1mL的比例稀释至透析器公称面积所需的溶液量,作待测液备用。
例:透析面积1m,则测试液应稀释至1000mL,待测液在室温下保存时间段长不超过24h。C2环氧乙烷测试方法
C2.1技术要求
仪器,气相色谱议;
方法:顶端空间法;
条件:主温70℃,进样口及检测器温度100℃,灵敏度:10*×2(或视具体仪器而定);d.
进样量:1mL(气体),反应瓶容积约为60mL。e.
C2.2标准储备液的制备
C2.2.1用10mL玻璃注射器直接从一环氧乙烷钢瓶中抽取10mL左右的环氧乙烷纯气体(注意密封),另用1mL注射器从上述10mL纯环氧乙烷气体中抽取1mL,直接注入100mL容量瓶中(该容基瓶中已预先用注射用水标到刻度,用翻口橡皮塞封口),摇匀。C2.2.2标准溶液的配制:从上述储备液中分别取1.1mL、2.2mL、3.3mL,分别注入三个反应瓶中再分别加水至10mL,用翻口橡皮塞封口。C2.2.3取C1.1~C1.3制备好的待测试液(样品液)10mL于另一反应瓶中,用翻口橡皮塞封口。C2.3测定
C2.3.1将上述已制好的三个标准溶液,在60C水浴中恒温30min,从反应瓶上端空间中抽取气体1mL进样,各重复3~5次(每一个标液),取其平均值。C2.3.2从上述标准溶液结果中,绘制标准曲线。C2.3.3用同样方法测定样品液,并将测定结果从对应的标准曲线上查得环氧乙烷的含量(或用计节法也可)。
C2.3.4含量单位mg/mL。
附加说明:
本标准由国家医药管理局提出。YY0053-91
本标准由国家医药管理局广州医疗器械标准化技术分归口单位归口。本标准由上海医疗器械研究所负责起草。本标准起草人竺锡明。
TTKAONYKAca
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
