YY 0336-2002
基本信息
标准号: YY 0336-2002
中文名称:一次性使用无菌阴道扩张器
标准类别:医药行业标准(YY)
标准状态:现行
出版语种:简体中文
下载格式:.zip .pdf
下载大小:189837

标准分类号
关联标准
出版信息
相关单位信息
标准简介
YY 0336-2002.Sterile vagina dilator for single use.
5.1.5扩张器的头端闭合时,用通用址具洲量上、下叶的头端编差.应符合4. 1.6的要求。
5.1.6将扩张器置于任何工作位置,视线中的视野口底部与下叶底部重合,用日力观察,结果应符合4.1.8的规定。
5.2物理性能
5.2.1挠度:将扩张器调至最大档,以下叶为支承点,在距上叶前蠟20mm处皑加垂直向下作用的额定载荷20 N,扩张器所产生的挠度值应符合4.21的规定。
5.2.2强度;将扩张器调至最大档,以下叶为支承点,在距上叶前端20 mm处施加垂直向下作用的额定载荷30N ,持续1 min,应符合4.2. 2的规定。
5.3生物性能
5.3.1无菌: 按GB/T 14233.2- 1993 中的无菌试验进行。其中供试液按GB/T 14233.2 -1993中2.7.3.4条的方法制备。
5.3.2环氧乙烷残留 量:按GB/T 14233. 1-- 1908中的方法进行,应符合4. 3.2的规定。
5.3.3生物学评价
5.3.3.1细胞毒 性:按GB/T 16175- -1996 中第4章的方法进行,应符合4. 3.3.1的规定。
5.3.3.2致敏:按 GB/T 16175-1996 中第5章的方法进行,应符合4. 3.3.2的规定。
5.3.3.3剌微:按 GB/T 16175-1996 中第7章的方法进行,应符合4.3.3.3的规定。.
6检验规则
6.1 扩张器经制造厂质悬部门进行检验,合格后方可出厂.
6.2扩 张器应成批提交检查,检查分为逐批检查(出厂检验)和周期检查(型式检验)
6.3组批规则
生产批量由基本相同的材料、工艺、设备和生产时间条件下制造的产品组成。
6.4逐批检查
6.4.1逐批检查应按 GB/T 2828有关规定进行。
6.4.2抽样方案采用一次抽样,抽样方案的严格性从正常检查抽样方案开始,其不合格分类、不合格分类组、检查项目、检查水平和合格质量水平(AQL,)按丧3的规定。
5.1.5扩张器的头端闭合时,用通用址具洲量上、下叶的头端编差.应符合4. 1.6的要求。
5.1.6将扩张器置于任何工作位置,视线中的视野口底部与下叶底部重合,用日力观察,结果应符合4.1.8的规定。
5.2物理性能
5.2.1挠度:将扩张器调至最大档,以下叶为支承点,在距上叶前蠟20mm处皑加垂直向下作用的额定载荷20 N,扩张器所产生的挠度值应符合4.21的规定。
5.2.2强度;将扩张器调至最大档,以下叶为支承点,在距上叶前端20 mm处施加垂直向下作用的额定载荷30N ,持续1 min,应符合4.2. 2的规定。
5.3生物性能
5.3.1无菌: 按GB/T 14233.2- 1993 中的无菌试验进行。其中供试液按GB/T 14233.2 -1993中2.7.3.4条的方法制备。
5.3.2环氧乙烷残留 量:按GB/T 14233. 1-- 1908中的方法进行,应符合4. 3.2的规定。
5.3.3生物学评价
5.3.3.1细胞毒 性:按GB/T 16175- -1996 中第4章的方法进行,应符合4. 3.3.1的规定。
5.3.3.2致敏:按 GB/T 16175-1996 中第5章的方法进行,应符合4. 3.3.2的规定。
5.3.3.3剌微:按 GB/T 16175-1996 中第7章的方法进行,应符合4.3.3.3的规定。.
6检验规则
6.1 扩张器经制造厂质悬部门进行检验,合格后方可出厂.
6.2扩 张器应成批提交检查,检查分为逐批检查(出厂检验)和周期检查(型式检验)
6.3组批规则
生产批量由基本相同的材料、工艺、设备和生产时间条件下制造的产品组成。
6.4逐批检查
6.4.1逐批检查应按 GB/T 2828有关规定进行。
6.4.2抽样方案采用一次抽样,抽样方案的严格性从正常检查抽样方案开始,其不合格分类、不合格分类组、检查项目、检查水平和合格质量水平(AQL,)按丧3的规定。
标准图片预览



标准内容
中华人民共和国医药行业标准
YY0336-2002
一次性使用无菌阴道扩张器
Sterile vagina dilator for single use2002-04-24发布
国家药品监督管理局发布
2002~10-01实施
YY0336—2002
为了提高一次性使用无菌阴道扩张器的产品质量,保证临床使用安全可靠,保护受检对象身心健康,根据《中华人民共和国产品质量法》和国家药品监督管理局的要求,特制定《一次性使用无菌阴道扩张器》行业标准。
一次性使用无菌阴道扩张器是供妇产科检查用的医疗器械,其质量的好坏直接影响人身安全健康。为此,该标准作为强制性标准发布实施。本标准由国家药品监督管理局提出。本标准由全国计划生育器械标准化技术委员会归口。本标准起草单位:玉环县恒康医药器械研究所。本标准主要起草人:林静。
本标准由全国计划生育器械标准化技术委员会负责解释。1范围
中华人民共和国医药行业标准
一次性使用无菌阴道扩张器
Sterile vagina dilator for single useYY 0336-2002
本标准规定了一次性使用无菌阴道扩张器(以下简称扩张器)的产品分类与命名、要求、试验方法、检验规则、标志、使用说明书及包装、运输、贮存的要求。本标准适用于扩张器,该产品供妇产科检查用。2引用标准
下列标准所包含的条文,通过在本标准中引用而构成为本标准的条文。本标准出版时,所示版本均为有效。所有标准都会被修订,使用本标准的各方应探讨使用下列标准最新版本的可能性。GB191-2000包装储运图示标志
GB/T2828一1987逐批检查计数抽样程序及抽样表(适用于连续批的检查)GB/T2829—1987周期检查计数抽样程序及抽样表(适用于生产过程稳定性的检查)GB9969.1-1998工业产品使用说明书总则GB/T14233.11998医用输液、输血、注射器具检验方法第1部分:化学分析方法GB/T14233.2—1993医用输血、输液、注射器具检验方法第二部分:生物试验方法GB/T14436—1993工业产品保证文件总则GB/T16175—1996医用有机硅材料生物学评价试验方法GB/T16886.1一2001医疗器械生物学评价第1部分:评价与试验YY/T0313--1998医用高分子产品包装、标志、运输和贮存3分类与命名
3.1扩张器的规格和基本尺寸
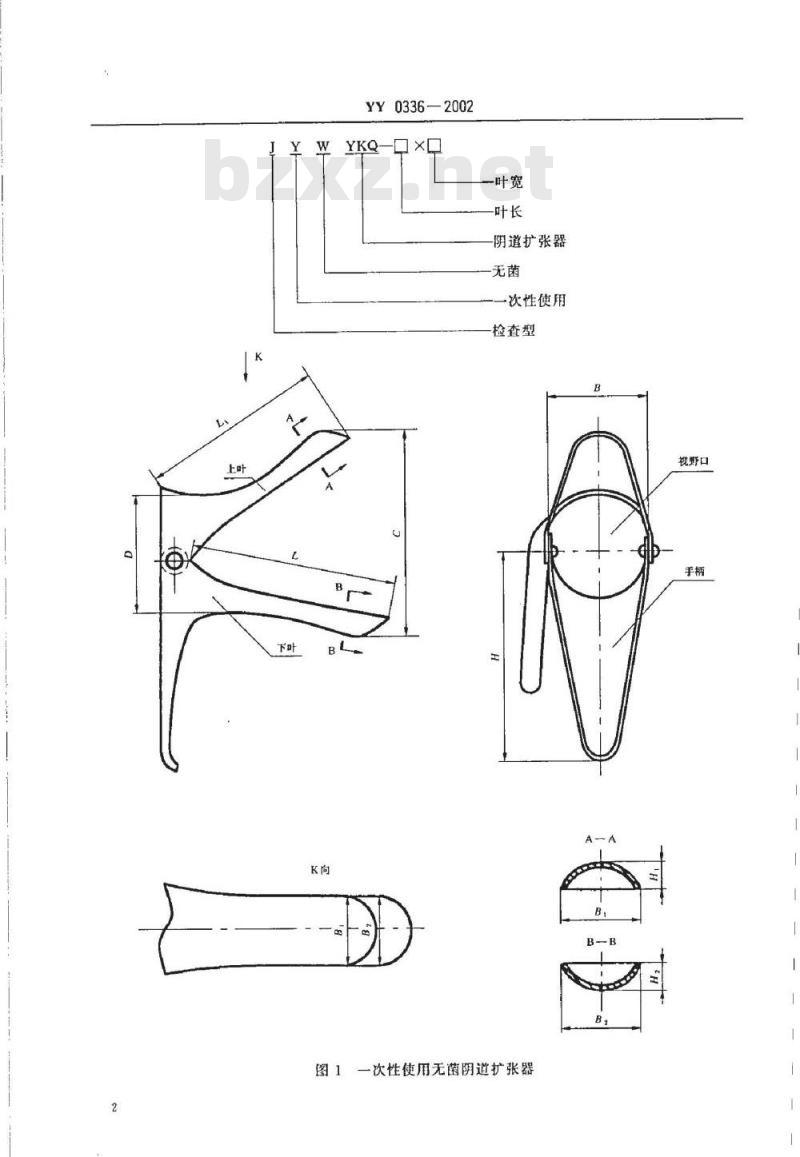
本扩张器主要由上叶、下叶和手柄组成;其结构、规格和基本尺寸见图1和表1。注:图1列举了扩张器的结构,如能符合本标准规定的使用要求,也可采用其他结构。表1规格和基本尺寸
3.2代号和示例
118±2
100±2
国家药品监督管理局2002-04-24批准基
2002-10-01实施
YY0336—2002
一叶宽
阴道扩张器
-次性使用
检查型
图1一次性使用无菌阴道扩张器
视野口
YY03362002
示例:检查型-一次性使用无菌阴道扩张器,中号叶长为100mm,叶宽为28mm:标记为:JYWYKQ-100X28YY0336—20023.3扩张器应采用无毒塑料制成。4要求
4.1使用性能
4.1.1扩张器的基本尺寸1.1、B,或B2,应符合3.1中表1的规定。4.1.2扩张器张开时前端外口高度和后端外口高度见表2。表2前端外口高度和后端外口高度规格
最小档
前端外口高度C
最大档
最小档
后端外口商度D
扩张器表面应光滑,周边圆孤应光滑无锋棱、无毛刺,不应有粉末或水印痕迹。4.1.4扩张器应单手操作,每档调节、闭合应灵活,不应有卡阻现象。4.1.5扩张器轴销与轴孔的转动应灵活,使用时不应脱落、卡阻。4.1.6扩张器上下两叶头端偏差应不大于2mm。4.1.7各档调节、扩张应灵活,不应卡阻。4.1.8在任何工作状态下,扩张器的任何部件都不应阻挡视野口。4.2物理性能
最大档
挠度:扩张器扩张至最大档时,在额定载荷20N作用下,允许产生的挠度值应不大于30mm。4.2.1
4.2.2强度:扩张器扩张至最大档时,在距上叶前端20mm处,施加30N的静态载荷后,任何部件不得断裂。
4.3生物性能
4.3.1扩张器应无菌。
4.3.2扩张器若采用环氧乙烷灭菌,经15d后,其环氧乙烷残留量应不大于5pg/g。4.3.3扩张器的生物学评价应符合GB/T16886.1-2001中第6章表1内表面器械粘膜A类的指南的规定。
细胞毒性,反应不大于1级。
4.3.3.2致敏,皮肤反应不大于1级。4.3.3.3刺激,皮肤无反应,PII为0.0~0.4。5试验方法
5.1使用性能
5.1.1用通用或专用量具测量,应符合4.1.1的规定,B,和B为扩张器上叶和下叶头部最宽处的宽度。
5.1.2用通用或专用量具测量扩张器的前端外口最高点高度(C)和后端外口最低点高度(D),应符合4.1.2的规定。
5.1.3用力观察和手摸进行检查,应符合4.1.3和4.1.7的规定。5.1.4在距上叶前端20mm处施加20N载荷,扩张器从闭合打开至各档应符合4.1.4和4.1.5的规定。
YY0336—2002
5.1.5扩张器的头端闭合时,用通用量具测量上、下叶的头端偏差,应符合4.1.6的要求。5.1.6将扩张器置于任何工作位置,视线中的视野口底部与下叶底部重合,用日力观察,结果应符合4.1.8的规定。
5.2物理性能
5.2.1挠度:将扩张器调至最大档,以下叶为支承点,在距上叶前端20mm处施加垂直向下作用的额定载荷20N,扩张器所产生的挠度值应符合4.2.1的规定。5.2.2强度:将扩张器调至最大档,以下叶为支承点,在距上叶前端20mm处施加垂直向下作用的额定载荷30N,持续1min,应符合4.2.2的规定。5.3生物性能
5.3.1无菌:按GB/T14233.2—1993中的无菌试验进行。其中供试液按GB/T14233.2—1993中2.7.3.4条的方法制备。
5.3.2环氧乙烷残留量:按GB/T14233.1--1998中的方法进行,应符合43.2的规定。5.3.3生物学评价
5.3.3.1细胞毒性:按GB/T16175—1996中第4章的方法进行,应符合4.3.3.1的规定。5.3.3.2致敏:按GB/T16175—1996中第5章的方法进行,应符合4.3.3.2的规定。5.3.3.3刺激:按GB/T16175—1996中第7章的方法进行,应符合4.3.3.3的规定。6检验规则
6.1扩张器经制造厂质量部门进行检验,合格后方可出厂。6.2扩张器应成批提交检查,检查分为逐批检查(出厂检验)和周期检查(型式检验)6.3组批规则
生产批量由基本相同的材料、工艺、设备和生产时问条件下制造的产品组成。6.4逐批检查
6.4.1逐批检查应按GB/T2828有关规定进行。6.4.2抽样方案采用一次抽样,抽样方案的严格性从正常检查抽样方案开始,其不合格分类、不合格分类组、检查项目、检查水平和合格质量水平(AQL)按表3的规定。表3逐批检查
不合格分类(不合格品数计)
不合格分类组
检查项目
检查水平
合格质量水平
全部合格
4.1.2、4.1.3、
4.1.4、4.1.5、
4.1.7、4.1. 8、
4.2.1,4.2.2
注,用环氧乙烷灭菌的产品,灭荫后环氧乙烷残留纸控制在低于规定值(4.3.2)后方可出厂。6.5周期检查
6.5.1周期检查前应进行逐批检套,从逐批检查合格批中抽取样本进行周期检查。6.5.2在下列情况下应进行周期检查:a)新产品投产前(包括在产品转产生产);b)连续生产中的产品,每年不少于一次;c)间隔半年再进行生产时;
d)在设计、工艺或材料有重大改动时;YY0336-2002
e)质量监督检验机构对产品质量进行监督抽查时。6.5.3周期检查应按GB/T2829的规定进行;6.5.4周期检查采用一次抽样方案,其不合格分类、试验组、检查项目、判别水平、不合格质量水平(RQL)和抽样方案表4的规定。
6.5.5在下列任一情况下,应按GB/T16886.1-2001中3.7的规定,考虑对最终产品重新进行生物学评价(无下列情况4.3.3可以豁免):a)制造产品所有材料来源或技术条件改变时;b)产品配方、工艺,单包装或灭菌改变时;c)贮存期内最终产品中的任何变化;d)产品用途改变时;
e)有迹象表明产品用于人体时会产生副作用。表4周期检查
不合格分类(不合格品数计)
试验组
检查项目
判别水平
抽样方案
7标志,使用说明书
7.1标志
7.1.1单包装标志
4.3.1,4.3.2.
全部合格
4.1.2、4.1.3、
4.1.4、4.1.5、
4.1.7、4.1.8、
4.2.1、4.2.2
扩张器的单包装上的标志应清晰,并应包括下列内容:a)产品名称、规格:
b)产品标准号、产品注册号;
c)制造单位名称、地址和商标;d)生产批号或日期;
n=10[1,2]
e)应有“无菌”字样和/或无荫图形符号、“用后销毁”、“包装破损禁止使用”字样;f)失效年月。
7.1.2中包装标志
扩张器的中包装上的标志应清晰,并应包括下列内容:a)产品名称、规格;Www.bzxZ.net
b)产品标准号、产品注册号;
c)产品合格证;
d)制造单位名称、地址和商标:e)生产批号或日期;
7.1.3外包装标志
7.1.3.1外包装的标志应清断,并包括以下内容;5
a)产品名称、规格;
b)制造单位名称、地址;
c)生产批号或日期;
d)产品执行的标准号;
e)“一次性使用”的字样或图形符号;f)灭菌标记;
g)产品数量:
h)失效年月;
YY0336-—2002
i)毛重、体积(长×宽×高)。7.1.3.2包装箱外部应标明GB.191中规定的储运图示标志,包括:“小心轻放”“怕湿”、“防火”“怕压”等注意字样及符号。
7.2使用说明书
扩张器使用说明书的内容应符合GB9969.1一1998的有关规定。8包装、运输、贮存
8.1包装
8.1.1小包装,单个扩张器用一包装袋密封。8.1.2中包装:每十个单包装装人一个塑料袋(或纸盒)。8.1.3大包装:扩张器的外包装应牢固,并采取必要的防潮措施。大包装内应有使用说明书和产品合格证。
8.1.4产品合格证的编写和其他内容应符合GB/T14436--1993的有关规定。8.2运输、贮存应符合YY/T0313—1998中第7章的规定。8.3扩张器在符合贮存规定的条件下,灭菌有效期应为2年。YY0336-2002
中华人民共和国医药
行业标准
一次性使用无菌阴道扩张器
YY0336—2002
中国标准出版社出版
北京复兴门外三里河北街16号
邮政编码:100045
电话:6852394668517548
中国标准出版社秦皇岛印刷厂印刷新华书店北京发行所发行各地新华书店经售*
开本880×12301/16印张3/4字数14千字2002年8月第一版2002年8月第一次印刷印数1-1000
书号:155066·2-14516
网址bzcbs.com
科目612-376
版权专有
侵权必究
举报电话:(010)68533533
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
YY0336-2002
一次性使用无菌阴道扩张器
Sterile vagina dilator for single use2002-04-24发布
国家药品监督管理局发布
2002~10-01实施
YY0336—2002
为了提高一次性使用无菌阴道扩张器的产品质量,保证临床使用安全可靠,保护受检对象身心健康,根据《中华人民共和国产品质量法》和国家药品监督管理局的要求,特制定《一次性使用无菌阴道扩张器》行业标准。
一次性使用无菌阴道扩张器是供妇产科检查用的医疗器械,其质量的好坏直接影响人身安全健康。为此,该标准作为强制性标准发布实施。本标准由国家药品监督管理局提出。本标准由全国计划生育器械标准化技术委员会归口。本标准起草单位:玉环县恒康医药器械研究所。本标准主要起草人:林静。
本标准由全国计划生育器械标准化技术委员会负责解释。1范围
中华人民共和国医药行业标准
一次性使用无菌阴道扩张器
Sterile vagina dilator for single useYY 0336-2002
本标准规定了一次性使用无菌阴道扩张器(以下简称扩张器)的产品分类与命名、要求、试验方法、检验规则、标志、使用说明书及包装、运输、贮存的要求。本标准适用于扩张器,该产品供妇产科检查用。2引用标准
下列标准所包含的条文,通过在本标准中引用而构成为本标准的条文。本标准出版时,所示版本均为有效。所有标准都会被修订,使用本标准的各方应探讨使用下列标准最新版本的可能性。GB191-2000包装储运图示标志
GB/T2828一1987逐批检查计数抽样程序及抽样表(适用于连续批的检查)GB/T2829—1987周期检查计数抽样程序及抽样表(适用于生产过程稳定性的检查)GB9969.1-1998工业产品使用说明书总则GB/T14233.11998医用输液、输血、注射器具检验方法第1部分:化学分析方法GB/T14233.2—1993医用输血、输液、注射器具检验方法第二部分:生物试验方法GB/T14436—1993工业产品保证文件总则GB/T16175—1996医用有机硅材料生物学评价试验方法GB/T16886.1一2001医疗器械生物学评价第1部分:评价与试验YY/T0313--1998医用高分子产品包装、标志、运输和贮存3分类与命名
3.1扩张器的规格和基本尺寸
本扩张器主要由上叶、下叶和手柄组成;其结构、规格和基本尺寸见图1和表1。注:图1列举了扩张器的结构,如能符合本标准规定的使用要求,也可采用其他结构。表1规格和基本尺寸
3.2代号和示例
118±2
100±2
国家药品监督管理局2002-04-24批准基
2002-10-01实施
YY0336—2002
一叶宽
阴道扩张器
-次性使用
检查型
图1一次性使用无菌阴道扩张器
视野口
YY03362002
示例:检查型-一次性使用无菌阴道扩张器,中号叶长为100mm,叶宽为28mm:标记为:JYWYKQ-100X28YY0336—20023.3扩张器应采用无毒塑料制成。4要求
4.1使用性能
4.1.1扩张器的基本尺寸1.1、B,或B2,应符合3.1中表1的规定。4.1.2扩张器张开时前端外口高度和后端外口高度见表2。表2前端外口高度和后端外口高度规格
最小档
前端外口高度C
最大档
最小档
后端外口商度D
扩张器表面应光滑,周边圆孤应光滑无锋棱、无毛刺,不应有粉末或水印痕迹。4.1.4扩张器应单手操作,每档调节、闭合应灵活,不应有卡阻现象。4.1.5扩张器轴销与轴孔的转动应灵活,使用时不应脱落、卡阻。4.1.6扩张器上下两叶头端偏差应不大于2mm。4.1.7各档调节、扩张应灵活,不应卡阻。4.1.8在任何工作状态下,扩张器的任何部件都不应阻挡视野口。4.2物理性能
最大档
挠度:扩张器扩张至最大档时,在额定载荷20N作用下,允许产生的挠度值应不大于30mm。4.2.1
4.2.2强度:扩张器扩张至最大档时,在距上叶前端20mm处,施加30N的静态载荷后,任何部件不得断裂。
4.3生物性能
4.3.1扩张器应无菌。
4.3.2扩张器若采用环氧乙烷灭菌,经15d后,其环氧乙烷残留量应不大于5pg/g。4.3.3扩张器的生物学评价应符合GB/T16886.1-2001中第6章表1内表面器械粘膜A类的指南的规定。
细胞毒性,反应不大于1级。
4.3.3.2致敏,皮肤反应不大于1级。4.3.3.3刺激,皮肤无反应,PII为0.0~0.4。5试验方法
5.1使用性能
5.1.1用通用或专用量具测量,应符合4.1.1的规定,B,和B为扩张器上叶和下叶头部最宽处的宽度。
5.1.2用通用或专用量具测量扩张器的前端外口最高点高度(C)和后端外口最低点高度(D),应符合4.1.2的规定。
5.1.3用力观察和手摸进行检查,应符合4.1.3和4.1.7的规定。5.1.4在距上叶前端20mm处施加20N载荷,扩张器从闭合打开至各档应符合4.1.4和4.1.5的规定。
YY0336—2002
5.1.5扩张器的头端闭合时,用通用量具测量上、下叶的头端偏差,应符合4.1.6的要求。5.1.6将扩张器置于任何工作位置,视线中的视野口底部与下叶底部重合,用日力观察,结果应符合4.1.8的规定。
5.2物理性能
5.2.1挠度:将扩张器调至最大档,以下叶为支承点,在距上叶前端20mm处施加垂直向下作用的额定载荷20N,扩张器所产生的挠度值应符合4.2.1的规定。5.2.2强度:将扩张器调至最大档,以下叶为支承点,在距上叶前端20mm处施加垂直向下作用的额定载荷30N,持续1min,应符合4.2.2的规定。5.3生物性能
5.3.1无菌:按GB/T14233.2—1993中的无菌试验进行。其中供试液按GB/T14233.2—1993中2.7.3.4条的方法制备。
5.3.2环氧乙烷残留量:按GB/T14233.1--1998中的方法进行,应符合43.2的规定。5.3.3生物学评价
5.3.3.1细胞毒性:按GB/T16175—1996中第4章的方法进行,应符合4.3.3.1的规定。5.3.3.2致敏:按GB/T16175—1996中第5章的方法进行,应符合4.3.3.2的规定。5.3.3.3刺激:按GB/T16175—1996中第7章的方法进行,应符合4.3.3.3的规定。6检验规则
6.1扩张器经制造厂质量部门进行检验,合格后方可出厂。6.2扩张器应成批提交检查,检查分为逐批检查(出厂检验)和周期检查(型式检验)6.3组批规则
生产批量由基本相同的材料、工艺、设备和生产时问条件下制造的产品组成。6.4逐批检查
6.4.1逐批检查应按GB/T2828有关规定进行。6.4.2抽样方案采用一次抽样,抽样方案的严格性从正常检查抽样方案开始,其不合格分类、不合格分类组、检查项目、检查水平和合格质量水平(AQL)按表3的规定。表3逐批检查
不合格分类(不合格品数计)
不合格分类组
检查项目
检查水平
合格质量水平
全部合格
4.1.2、4.1.3、
4.1.4、4.1.5、
4.1.7、4.1. 8、
4.2.1,4.2.2
注,用环氧乙烷灭菌的产品,灭荫后环氧乙烷残留纸控制在低于规定值(4.3.2)后方可出厂。6.5周期检查
6.5.1周期检查前应进行逐批检套,从逐批检查合格批中抽取样本进行周期检查。6.5.2在下列情况下应进行周期检查:a)新产品投产前(包括在产品转产生产);b)连续生产中的产品,每年不少于一次;c)间隔半年再进行生产时;
d)在设计、工艺或材料有重大改动时;YY0336-2002
e)质量监督检验机构对产品质量进行监督抽查时。6.5.3周期检查应按GB/T2829的规定进行;6.5.4周期检查采用一次抽样方案,其不合格分类、试验组、检查项目、判别水平、不合格质量水平(RQL)和抽样方案表4的规定。
6.5.5在下列任一情况下,应按GB/T16886.1-2001中3.7的规定,考虑对最终产品重新进行生物学评价(无下列情况4.3.3可以豁免):a)制造产品所有材料来源或技术条件改变时;b)产品配方、工艺,单包装或灭菌改变时;c)贮存期内最终产品中的任何变化;d)产品用途改变时;
e)有迹象表明产品用于人体时会产生副作用。表4周期检查
不合格分类(不合格品数计)
试验组
检查项目
判别水平
抽样方案
7标志,使用说明书
7.1标志
7.1.1单包装标志
4.3.1,4.3.2.
全部合格
4.1.2、4.1.3、
4.1.4、4.1.5、
4.1.7、4.1.8、
4.2.1、4.2.2
扩张器的单包装上的标志应清晰,并应包括下列内容:a)产品名称、规格:
b)产品标准号、产品注册号;
c)制造单位名称、地址和商标;d)生产批号或日期;
n=10[1,2]
e)应有“无菌”字样和/或无荫图形符号、“用后销毁”、“包装破损禁止使用”字样;f)失效年月。
7.1.2中包装标志
扩张器的中包装上的标志应清晰,并应包括下列内容:a)产品名称、规格;Www.bzxZ.net
b)产品标准号、产品注册号;
c)产品合格证;
d)制造单位名称、地址和商标:e)生产批号或日期;
7.1.3外包装标志
7.1.3.1外包装的标志应清断,并包括以下内容;5
a)产品名称、规格;
b)制造单位名称、地址;
c)生产批号或日期;
d)产品执行的标准号;
e)“一次性使用”的字样或图形符号;f)灭菌标记;
g)产品数量:
h)失效年月;
YY0336-—2002
i)毛重、体积(长×宽×高)。7.1.3.2包装箱外部应标明GB.191中规定的储运图示标志,包括:“小心轻放”“怕湿”、“防火”“怕压”等注意字样及符号。
7.2使用说明书
扩张器使用说明书的内容应符合GB9969.1一1998的有关规定。8包装、运输、贮存
8.1包装
8.1.1小包装,单个扩张器用一包装袋密封。8.1.2中包装:每十个单包装装人一个塑料袋(或纸盒)。8.1.3大包装:扩张器的外包装应牢固,并采取必要的防潮措施。大包装内应有使用说明书和产品合格证。
8.1.4产品合格证的编写和其他内容应符合GB/T14436--1993的有关规定。8.2运输、贮存应符合YY/T0313—1998中第7章的规定。8.3扩张器在符合贮存规定的条件下,灭菌有效期应为2年。YY0336-2002
中华人民共和国医药
行业标准
一次性使用无菌阴道扩张器
YY0336—2002
中国标准出版社出版
北京复兴门外三里河北街16号
邮政编码:100045
电话:6852394668517548
中国标准出版社秦皇岛印刷厂印刷新华书店北京发行所发行各地新华书店经售*
开本880×12301/16印张3/4字数14千字2002年8月第一版2002年8月第一次印刷印数1-1000
书号:155066·2-14516
网址bzcbs.com
科目612-376
版权专有
侵权必究
举报电话:(010)68533533
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。