YY 1116-2002
标准分类号
关联标准
出版信息
相关单位信息
标准简介
YY 1116一2002.Absorbable surgical suture.
1范围
YY 1116规定了可吸收性外科缝线的分类与命名.娶求、试验方法、检验规则及标志、使用说明书、包装.运输与贮存的要求。
YY 1116适用于可吸收性外科继线(以下简称缝线)。该缝线供医疗机构做外科手术时对人体组织缝合、结扎用。
2引用标准
下列标准所包含的条文.通过在本标准中引用而构成为本标准的条文。本标准出版时.所示版本均为有效。所有标准都会被修订,使用本标准的各方应探讨使用下列标准最新版本的可能性。
GB 191- -2000包装贮运图示标志
GB/T 9737- -1988化学试剂易 碳化物质测定通则
GB 9969. 1-1998工业产 品使用说明书总则 .
GB/T 14233.1-1998医用输血、输液注射器具检验方法第1 部分:化学分析方法
GB/T 14233.2-1993医用输 血、输液注射器具检验方法第2 部分:生物试验方法
GB/T 14436-1993工业产 品保证文件总则
GB/T 16175- -1996医用有 机硅材料生物学评价试验方法
GB/T 16886.1- -2001医疗器械生物学评价 第1部分:评价与试验
GB/T 16886.3- -1997医疗器械生物学评价 第3部分:遗传毒性、致癌性和生殖毒性试验
GB/T 16886. 5一1997医疗器 械生物学评价第5部分:细胞毒性试验
GB/T 16886. 6--1997医疗 器械生物学评价第6部分:植人后局部反应试验
GB/T16886.9--2001医疗器械生物学评价第9部分:潜在降解产物的定性和定量框架
GB/T 16886.11- -1997医疗器械生物学评价第11部分:全身毒性试验
YY/T0313-1998医用商分子制品包装.标志、运输和贮存中华人民共和国药典2000年版(二部)
3分类与命名
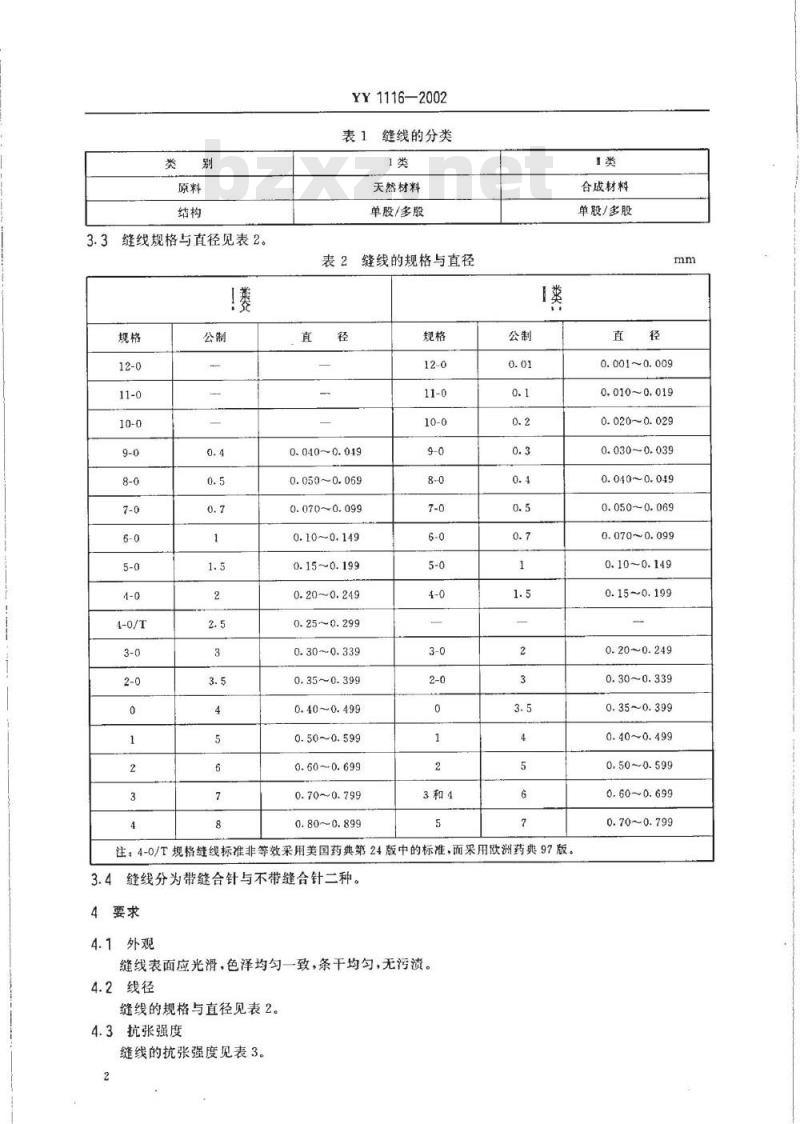
3.1缝线应以胶原蛋白.壳聚糖等天然材料和聚乳酸、聚乙交酯、聚丙交酯、聚乙烯醇等合成材料经加工制成。
3.2缝线的分类见表 1.
1范围
YY 1116规定了可吸收性外科缝线的分类与命名.娶求、试验方法、检验规则及标志、使用说明书、包装.运输与贮存的要求。
YY 1116适用于可吸收性外科继线(以下简称缝线)。该缝线供医疗机构做外科手术时对人体组织缝合、结扎用。
2引用标准
下列标准所包含的条文.通过在本标准中引用而构成为本标准的条文。本标准出版时.所示版本均为有效。所有标准都会被修订,使用本标准的各方应探讨使用下列标准最新版本的可能性。
GB 191- -2000包装贮运图示标志
GB/T 9737- -1988化学试剂易 碳化物质测定通则
GB 9969. 1-1998工业产 品使用说明书总则 .
GB/T 14233.1-1998医用输血、输液注射器具检验方法第1 部分:化学分析方法
GB/T 14233.2-1993医用输 血、输液注射器具检验方法第2 部分:生物试验方法
GB/T 14436-1993工业产 品保证文件总则
GB/T 16175- -1996医用有 机硅材料生物学评价试验方法
GB/T 16886.1- -2001医疗器械生物学评价 第1部分:评价与试验
GB/T 16886.3- -1997医疗器械生物学评价 第3部分:遗传毒性、致癌性和生殖毒性试验
GB/T 16886. 5一1997医疗器 械生物学评价第5部分:细胞毒性试验
GB/T 16886. 6--1997医疗 器械生物学评价第6部分:植人后局部反应试验
GB/T16886.9--2001医疗器械生物学评价第9部分:潜在降解产物的定性和定量框架
GB/T 16886.11- -1997医疗器械生物学评价第11部分:全身毒性试验
YY/T0313-1998医用商分子制品包装.标志、运输和贮存中华人民共和国药典2000年版(二部)
3分类与命名
3.1缝线应以胶原蛋白.壳聚糖等天然材料和聚乳酸、聚乙交酯、聚丙交酯、聚乙烯醇等合成材料经加工制成。
3.2缝线的分类见表 1.
标准图片预览



标准内容
备案号:9940—2002
中华人民共和国医药行业标准
YY 1116--2002
可吸收性外科缝线
Absorbablesurgical suture
2002-01-08发布
国家药品监督管理局发布
2002-05-01实施
YY1116-2002
本标准按照美国药典第24版的相关内容,对可吸收性外科缝线进行了分类,其线径、抗张强度、褪色试验、针线连接强度等同于美国药典第24版。与美国药典第24版相比,增加了缝线外观、生物学评价、无菌检查以及对I类合成缝合线含水量的规定。本标准与YY91116一1999《医用羊肠线》相比,增加了可吸收性外科缝线的分类和生化指标,并对检验规则作了修订,规定了出厂检验和型式检验的要求。本标准从实施之日起,同时代替YY91116—1999《医用羊肠线》。本标准由全国外科器械标准化技术委员会归口。本标准起草单位:中国医学科学院生物医学工程研究所、广东省中山市邦达医用制品有限公司。本标准主要起草人:张其清、林焕新、杨兆禄、袁双林。YYKAoNYKAca
1范围
中华人民共和国医药行业标准
可吸收性外科缝线
Absorbable surgical suture
YY1116—2002
代替YY91116—1999
本标准规定了可吸收性外科缝线的分类与命名、要求、试验方法、检验规则及标志、使用说明书、包装、运输与贮存的要求。
本标准适用于可吸收性外科缝线(以下简称缝线)。该缝线供医疗机构做外科手术时对人体组织缝合、结扎用。
2引用标准
下列标准所包含的条文,通过在本标准中引用而构成为本标准的条文。本标准出版时,所示版本均为有效。所有标准都会被修订,使用本标准的各方应探讨使用下列标准最新版本的可能性。GB191-2000包装贮运图示标志
GB/T9737-1988化学试剂易碳化物质测定通则GB9969.1-1998工业产品使用说明书总则GB/T14233.1一1998医用输血、输液注射器其检验方法第1部分:化学分析方法GB/T14233.2—1993医用输血、输液注射器具检验方法第2部分:生物试验方法3工业产品保证文件总则
GB/T14436-1993
GB/T16175—1996医用有机硅材料生物学评价试验方法GB/T16886.1—2001
GB/T16886.3—1997
GB/T16886.5-1997
GB/T16886.6-1997
GB/T16886.9—2001
医疗器械生物学评价第1部分:评价与试验医疗器械生物学评价第3部分:遗传毒性、致癌性和生殖毒性试验医疗器械生物学评价第5部分:细胞毒性试验医疗器械生物学评价第6部分:植人后局部反应试验医疗器械生物学评价第9部分:潜在降解产物的定性和定量框架GB/T16886.11—1997
医疗器械生物学评价第11部分:全身毒性试验YY/T0313-1998医用商分子制品包装、标志、运输和贮存中华人民共和国药典2000年版(二部)3分类与命名
3.1缝线应以胶原蛋白、壳聚糖等天然材料和聚乳酸、聚乙交酯、聚丙交酯、聚乙烯醇等合成材料经加工制成。
3.2缝线的分类见表1。
国家药品监督管理局2002-01-08批准2002-05-01实施
缝线规格与直径见表2。
YY1116—2002
表1缝线的分类
天然材料
单股/多股
表2缝线的规格与直径
0.040~0.019
0.050~0.069
0.070~0.099
0.100.149
0.150.199
0.200.249
0.25~0.299
0.30~0.339
0.35~0.399
0.40~0.499
0.50~0.599
0.60~0.699
0.70~0.799
0.80~0.899
注:4-0/T规格缝线标准非等效采用美国药典第24版中的标准,而采用欧洲药典97版。3.4缝线分为带缝合针与不带缝合针二种。4要求
4.1外观
缝线表面应光滑,色泽均匀一致,条干均勾,无污渍。4.2线径
缝线的规格与直径见表2。
4.3抗张强度
缝线的抗张强度见表3。
TTTKAONTKAca
合成材料
单股/多股
0.001~0.009
0.010~0.019
0.020~0.029
0.0300.039
0.040~0.049
0.050~0.069
0.070~0.099
0.10~0.149
0.15~0.199
0.20~0.249
0.30~0.339
0.35~0.399
0.40~0.499
0.50~0.599
0.60~0.699
0.70~0.799
采用说明:
平均值
YY1116—2002
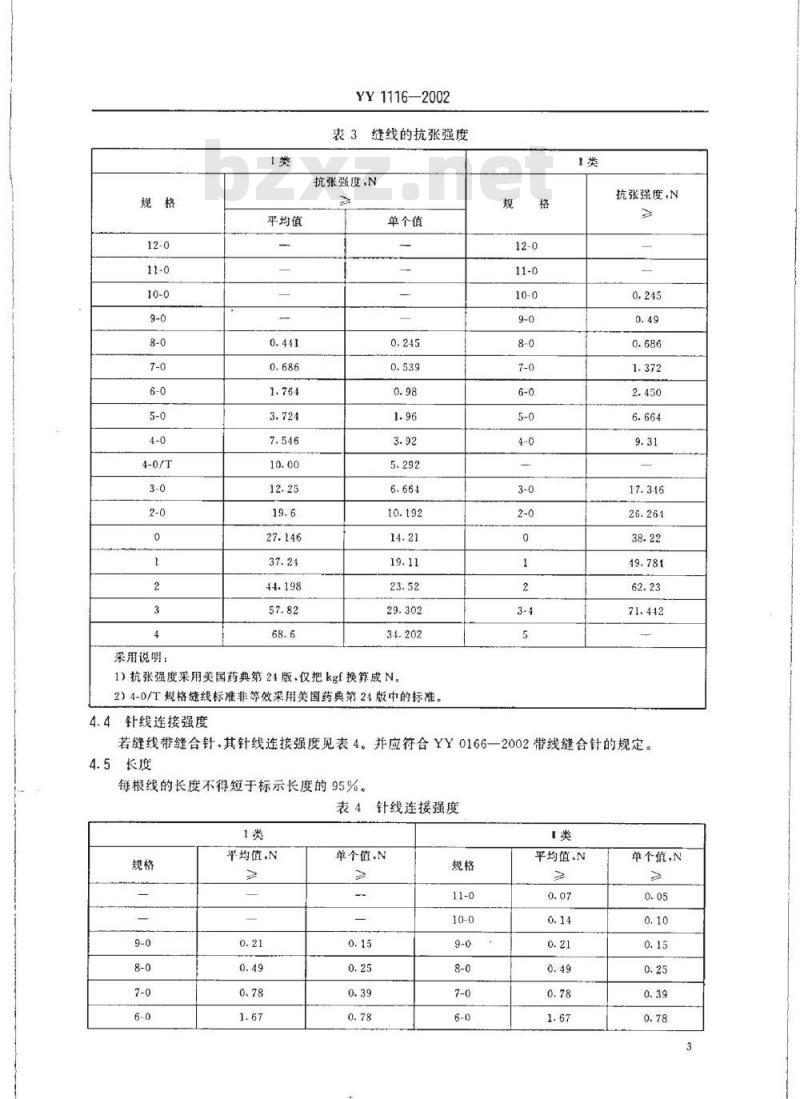
表3缝线的抗张强度
抗张强度,N
单个值
1)抗张强度采用美国药典第24版,仅把kgf换算成N2)4-0/T规格缝线标准非等效采用美国药典第24版中的标准。4.4针线连接强度
抗张强度,N
若缝线带缝合针,其针线连接强度见表4。并应符合YY0166一2002带线缝合针的规定。4.5长度
每根线的长度不得短于标示长度的95%。表4针线连接强度
平均值.N
单个值.N
平均值.N
单个值,N
平均值,N
YY1116—2002
表4(完)
单个值,N
注:4-0/T等效采用欧洲药典97版,其余等效采用美国药典第24版。4.6缝线的化学性能
4.6.1酸碱度
缝线的浸出液与同批空白对照液作对照,pH值之差不得超过1.5。4.6.2重金属
平均值,N
单个值,N
缝线的浸出液所呈现的颜色应不超过质量浓度p(Pb2+)=1μg/mL的标准对照液的颜色。4.6.3脱铬试验
I类铬制缝线不得脱铬。
4.6.4含水量试验
1类缝线含水量应不大于0.05%。4.6.5褪色试验
若缝线染色,褪色试验应合格。4.6.6环氧乙烷残留量试验
若缝线用环氧乙烷灭菌,缝线环氧乙烷残留量应不大于10ug/g。4.7缝线的生物性能
材料应符合GB/T16886.1的规定,应不产生任何毒副作用。4.7.1
细胞藓性试验反应不大于1级。
皮内刺激试验应为无刺激性。
应无溶血作用(溶血率不大于5%)。急性全身毒性试验应无毒性。
过敏试验应无致敏反应。
应无致热原反应。
植入试验植入周期为3个月,观察取样时间为1,4,12周:若生物学反应仍不稳定,继续观察到26周。炎症细胞反应程度和纤维囊腔形成程度应符合规定。4.7.8Ames试验应为阴性。
生物降解试验应符合GB/T16886.9—2001的规定。4.7.9
4.8缝线应无菌。
4.9包装标志应清晰。
trkaNnKe
5试验方法
5.1外观
YY1116—2002
取10根缝线,在正常光照下目测,应符合4.1的规定。5.2线径
5.2.1试验装置
线径测量仪,最小分度值0.002mm,压脚与基准面的平整度在0.005mm之内,且互相平行,压脚直径为10~15mm,基准面的直径应不小于压脚的直径,压脚加在缝线上的负载在90~210g之间。5.2.2试验程序
a)从包装中取出缝线后不经拉伸,应马上进行线径的测量。若缝线用液体包装,试验必须在缝线从液体中取出后2min内完成。
b)把缝线的一端固定在线径测量仪上,同时,缝线的另一端应施加一定的张力。张力的大小应根据缝线的规格取表3抗张强度平均值的二分之一。c)使线径测量仪的压脚,轻轻地落在缝线上,测量每根缝线约1/4,1/2,3/4处三个点的线径。d)取10根缝线,按a),b),c)的程序测定。5.2.3试验结果说明
比较缝线每一点线径,应不小于上一个较小规格线径范围的中间值,不大于下一个较大规格线径的中间值。线径的平均值应符合4.2的规定。5.3抗张强度
5.3.1试验设备
材料试验机。
5.3.2试验条件
拉伸速度为300mm/min,试验标距为100~150mm。5.3.3试验程序
取长约200mm的样品,共取10根缝线,进行试验。把缝线打一个自由结,样品夹在材料试验机上,结应位于两夹头的中间,并使夹具间的缝线绷紧;对于Ⅱ类规格小于8-0的缝线应不打结,直接进行试验。
5.3.4试验结果说明
比较单根缝合线的抗张强度,1类缝线应不小于表3中单个值,1类缝线应不小于表3中规定值的二分之一。抗张强度的平均值应符合4.3规定。5.4针线连接强度
把带有缝合针的缝线的针端和线端分别夹于材料试验机的两个夹具上,以300mm/min的拉伸速度,100mm的试验标距,进行试验,共取5根缝线进行连接强度试验.其平均值、单个值应符合4.4的规定。
5.5长度
取5根缝线以通用长度量具测量,在测量过程中不带张力牵直测量,应符合4.5的规定。5.6化学性能
5.6.1酸碱度
5.6.1.1浸提液制备:在洁净化学情性的封闭容器中,容器内顶部空间尽量小并保证安全性。在无污染的条件下,于电热恒温培养箱,37C浸提72h士2h。5.6.1.2酸碱度:按GB/T14233.1—1998中5.4方法进行,应符合4.6.1的规定。5.6.2重金属
5.6.2.1水浸液制备
YY1116—2002
在同批缝线中随机抽取缝线1m,截成约1cm长的线段,加蒸馏水20mL,使其外表面完全浸湿,加盖置于37℃环境浸泡24h,取其水没液。5.6.2.2试验方法按GB/T14233.1--1998规定进行,应符合4.6.2的规定。5.6.3脱铬试验
试样2.5g,浸人125mL的蒸馅水中3h以上,过滤,待滤液在水浴装置上蒸于,残清中加入等量的碳酸钾与硝酸钾粉末125mg混合后在炉内熔融,冷却后在12.5ml.蒸馏水内溶解,滴入稀硫酸使溶液成酸性,加入1%浓度的二萘借偕耕乙醇溶液1~2滴,显色不得为微红色,应符合4.6.3的规定。5.6.4含水量试验
按重量分析法(干燥失重),将2g1类缝线试样未拆封称重,然后取出缝线,减去包装材料重量,即为缝线实重,然后按重量分析法将缝线在60℃干煤至恒重,减失重量应符合4.6.4的规定。5.6.5褪色试验
5.6.5.1标准比色液的配制
按照GB/T9737一1988中4.2、4.3、4.4的规定,配制氯化钴、硫酸铜、氯化铁三种溶液。然后按照表5的规定配制各种颜色的标准比色液。5.6.5.2称取0.25g缝线,置于100mL锥形瓶,加25mL蒸馅水,并使其37C±0.5C恒温24h。冷却后.倒出溶液于比色管中。
5.6.5.3取10mL溶液,倒入比色管中,根据溶液颜色选取对应的标准比色液,在相同条件下比较。试验溶液颜色应不深于相应标准比色液的颜色,则符合4.6.5的规定。表5标准比色液
每10mL标准比色液中含有
黄棕色
粉红色
蓝绿色
紫红色
硫酸铜(CuSO,)溶液
5.6.6环氧乙烷残留量试验
氯化钻(CoCl)溶液
氯化铁(FeCls)溶液
按GB/T14233.1--1998中的试验方法,试验结果应符合4.6.6的规定。5.7缝线的生物性能
浸提液的制备
没提条件为:
37C±1C:
a)浸提温度
b)浸提时间
24h±2h
c)浸提介质
生理盐水;
d)供试品按长度与没提介质体积比例1m/20mL。5.7.1细胞毒性试验
按GB/T16886.5—1997中8.3的规定进行试验,应符合4.7.1的规定。5.7.2皮内刺激试验
取浸提液,按GB/T14233.2—1993中的规定进行,应符合4.7.2的规定。5.7.3溶血试验
取浸提液,按GB/T16175--1996中第11章的规定进行,应符合4.7.3的规定。5.7.4急性全身毒性试验
TKAoNKAca
蒸馏水
YY1116—2002
取没提液,按GB/T16886.11中第6.5.4的规定进行,应符合4.7.4的规定。5.7.5过敏试验
取浸提液,按GB/161751996中第5章的规定进行,应符合4.7.5的规定。5.7.6热原试验
取浸提液,按GB/T16175—1996第12章的规定进行,应符合4.7.6的规定。5.7.7植人试验
按GB/T16886.6的规定进行,应符合4.7.7的规定。5.7.8Ames试验
按GB/T16886.3—1997中第5章的规定进行,应符合4.7.8的规定。5.7.9生物降解试验
按GB/T16886.9—2001的规定进行,应符合4.7.9的规定。5.8无菌试验
按《中华人民共和国药典》2000年版(二部)中附录无菌检查法的规定进行,应符合4.8的规定。5.9包装标志
日力观察小包装的标志,应符合4.9的规定。6检验规则
6.1缝线应由制造厂技术检验部门进行检查,并保证产品质量符合本标准的要求。6.2组批
个检验批可由一个生产批构成:这些生产批是在基本相同的材料、工艺设备等条件下制造出来的。若干个生产批次构成一个检验批时,必须是在同一次灭菌条作下生产的产品。6.3出厂检验
6.3.1缝线出厂时的检验项目及抽样方法见表6表6检验项目及抽样量
抽样量
1在检查其他项目时同时检查4.9和7.1.1。2共应抽取30根,3.00g及7个小包装。6.3.2判定规则
小包装
检验中,每一个检验项目均应合格。除无菌外若出现其他项目不合格,则抽取不合格项目的双倍样品,进行重复检验,应全部合格,若发现一项检验不合格,则判为该批产品不合格。6.4型式检验
6.4.1在下列情况下应进行型式检验:a)新产品投产前;
b)连续生产中每年不少于一次;c)间隔半年以上再投产时;
d)在设计、工艺或材料有重大改变时e)国家质量监督检验机构对产品质量进行监督检查时。6.4.2型式检验的检验项目及抽样方法同出厂检验。在下列任一情况下应增加4.6.4和4.7的规定,YY1116-2002
进行含水量和生物学评价(无下列情况可以豁免)。a)制造产品所用材料来源或技术条件改变时;b)产品配方、工艺、初级包装或灭菌改变时;c)贮存期内最终产品中的任何变化;d)产品用途改变时;
e)有迹象表明产品用于人体时产生副作用。6.4.3型式检验的判定规则同6.3.2。7标志、使用说明书
7.1标志
7.1.1缝线的小包装上应有下列标志:a)制造厂名称或商标;
b)产品注册号、产品标准号:
c)产品名称、材质(例:铬制医用羊肠线、可吸收性合成外科缝线)、结构、规格;d)灭菌失效日期及生产批号:生产日期;e)灭菌方法及醒目的“无菌”字样。7.1.2中包装应有下列标志:
a)制造厂名称或商标及地址;
b)产品注册号、产品标准号;
c)产品名称、材质(例:铬制医用羊肠线、可吸收性合成外科缝线)、规格、数量;d)生产日期、灭菌失效期及生产批号;e)灭菌方法;
f)使用说明。
7.1.3每个中包装内应附有产品合格证,合格证上应有下列标志:a)制造厂名称或商标及地址;
b)检验日期和结论;
c)执行标准;
d)检验员代号。
7.1.4大包装上应有下列标志:
a)制造厂名称或商标及地址:
b)产品名称、材质、型号、规格、数量;c)产品注册号:
d)灭菌失效期和生产批号;
e)灭菌方法和已灭菌标志;
f)体积和重量;
g)“防热”、“防湿”、“防钩\等字样或标志。7.1.5包装贮运图示标志应符合GB191的有关规定。7.2使用说明书
7.2.1使用说明书中应包含下列内容:a)制造厂名称及地址、有关产品批准文号;b)缝线的使用范围及有关注意事项、特殊操作说明和特殊贮存管理要求;c)应注明“一次性使用”“最小包装破损时,不得使用”、灭菌方法和失效期;d)缝线的性能、制造材料和构造,可能带来的副作用;8
JUKAONLKAcA下载标准就来标准下载网
YY1116—2002
e)保证缝线正确、安全使用的要求、丢弃缝线的处理要求;f)缝线与其他器械配套使用的注意事项;g)用液体包装的缝线应注明液体成分;h)缝线在使用过程中出现意外,如断裂时,应采取的措施及注意事项;i)产品标准中规定的应具有的内容说明。7.2.2使用说明书的编写应符合GB9969.1的规定。8包装、运输、贮存
8.1包装
8.1.1产品的小包装应是供一次性使用的最小包装。经过灭菌处理的产品可以用干法贮存,也可用液体包装,所用的包装容器、盒子应当设计合理,能够保持产品的无菌性,直至包装开封。8.1.2产品的中包装中,应有下列文件:a)使用说明书;
b)产品合格证或质量保证书,产品合格证的编写应符合GB/T14436的规定。8.1.3包装其他要求应符合YY/T0313中的有关规定。8.2运输
产品在运输时应防止重压、阳光直射和雨水淋湿,或应按照订货合同规定。8.3存
包装后的产品应贮存在相对湿度不大于80%,清洁、通风良好、无腐蚀性气体的环境中。8.4有效期
在正常贮存条件下,灭菌缝线有效期应不少于三年,不多于五年。o
YY1116-2002
YKANKAca
中华人民共和国医药
行业标准
可吸收性外科缝线
YY1116—2002
中国标准出版社出版
北京复兴门外三里河北街16号
邮政编码:100045
电话:6852394668517548
中国标准出版社秦皇岛印刷厂印刷新华书店北京发行所发行各地新华书店经售开本880×12301/16印张1字数20千字2002年4月第一版2002年4月第一次印刷印数1-1000
网址bzcbs.com
版权专有侵权必究
举报电话:(010)68533533
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国医药行业标准
YY 1116--2002
可吸收性外科缝线
Absorbablesurgical suture
2002-01-08发布
国家药品监督管理局发布
2002-05-01实施
YY1116-2002
本标准按照美国药典第24版的相关内容,对可吸收性外科缝线进行了分类,其线径、抗张强度、褪色试验、针线连接强度等同于美国药典第24版。与美国药典第24版相比,增加了缝线外观、生物学评价、无菌检查以及对I类合成缝合线含水量的规定。本标准与YY91116一1999《医用羊肠线》相比,增加了可吸收性外科缝线的分类和生化指标,并对检验规则作了修订,规定了出厂检验和型式检验的要求。本标准从实施之日起,同时代替YY91116—1999《医用羊肠线》。本标准由全国外科器械标准化技术委员会归口。本标准起草单位:中国医学科学院生物医学工程研究所、广东省中山市邦达医用制品有限公司。本标准主要起草人:张其清、林焕新、杨兆禄、袁双林。YYKAoNYKAca
1范围
中华人民共和国医药行业标准
可吸收性外科缝线
Absorbable surgical suture
YY1116—2002
代替YY91116—1999
本标准规定了可吸收性外科缝线的分类与命名、要求、试验方法、检验规则及标志、使用说明书、包装、运输与贮存的要求。
本标准适用于可吸收性外科缝线(以下简称缝线)。该缝线供医疗机构做外科手术时对人体组织缝合、结扎用。
2引用标准
下列标准所包含的条文,通过在本标准中引用而构成为本标准的条文。本标准出版时,所示版本均为有效。所有标准都会被修订,使用本标准的各方应探讨使用下列标准最新版本的可能性。GB191-2000包装贮运图示标志
GB/T9737-1988化学试剂易碳化物质测定通则GB9969.1-1998工业产品使用说明书总则GB/T14233.1一1998医用输血、输液注射器其检验方法第1部分:化学分析方法GB/T14233.2—1993医用输血、输液注射器具检验方法第2部分:生物试验方法3工业产品保证文件总则
GB/T14436-1993
GB/T16175—1996医用有机硅材料生物学评价试验方法GB/T16886.1—2001
GB/T16886.3—1997
GB/T16886.5-1997
GB/T16886.6-1997
GB/T16886.9—2001
医疗器械生物学评价第1部分:评价与试验医疗器械生物学评价第3部分:遗传毒性、致癌性和生殖毒性试验医疗器械生物学评价第5部分:细胞毒性试验医疗器械生物学评价第6部分:植人后局部反应试验医疗器械生物学评价第9部分:潜在降解产物的定性和定量框架GB/T16886.11—1997
医疗器械生物学评价第11部分:全身毒性试验YY/T0313-1998医用商分子制品包装、标志、运输和贮存中华人民共和国药典2000年版(二部)3分类与命名
3.1缝线应以胶原蛋白、壳聚糖等天然材料和聚乳酸、聚乙交酯、聚丙交酯、聚乙烯醇等合成材料经加工制成。
3.2缝线的分类见表1。
国家药品监督管理局2002-01-08批准2002-05-01实施
缝线规格与直径见表2。
YY1116—2002
表1缝线的分类
天然材料
单股/多股
表2缝线的规格与直径
0.040~0.019
0.050~0.069
0.070~0.099
0.100.149
0.150.199
0.200.249
0.25~0.299
0.30~0.339
0.35~0.399
0.40~0.499
0.50~0.599
0.60~0.699
0.70~0.799
0.80~0.899
注:4-0/T规格缝线标准非等效采用美国药典第24版中的标准,而采用欧洲药典97版。3.4缝线分为带缝合针与不带缝合针二种。4要求
4.1外观
缝线表面应光滑,色泽均匀一致,条干均勾,无污渍。4.2线径
缝线的规格与直径见表2。
4.3抗张强度
缝线的抗张强度见表3。
TTTKAONTKAca
合成材料
单股/多股
0.001~0.009
0.010~0.019
0.020~0.029
0.0300.039
0.040~0.049
0.050~0.069
0.070~0.099
0.10~0.149
0.15~0.199
0.20~0.249
0.30~0.339
0.35~0.399
0.40~0.499
0.50~0.599
0.60~0.699
0.70~0.799
采用说明:
平均值
YY1116—2002
表3缝线的抗张强度
抗张强度,N
单个值
1)抗张强度采用美国药典第24版,仅把kgf换算成N2)4-0/T规格缝线标准非等效采用美国药典第24版中的标准。4.4针线连接强度
抗张强度,N
若缝线带缝合针,其针线连接强度见表4。并应符合YY0166一2002带线缝合针的规定。4.5长度
每根线的长度不得短于标示长度的95%。表4针线连接强度
平均值.N
单个值.N
平均值.N
单个值,N
平均值,N
YY1116—2002
表4(完)
单个值,N
注:4-0/T等效采用欧洲药典97版,其余等效采用美国药典第24版。4.6缝线的化学性能
4.6.1酸碱度
缝线的浸出液与同批空白对照液作对照,pH值之差不得超过1.5。4.6.2重金属
平均值,N
单个值,N
缝线的浸出液所呈现的颜色应不超过质量浓度p(Pb2+)=1μg/mL的标准对照液的颜色。4.6.3脱铬试验
I类铬制缝线不得脱铬。
4.6.4含水量试验
1类缝线含水量应不大于0.05%。4.6.5褪色试验
若缝线染色,褪色试验应合格。4.6.6环氧乙烷残留量试验
若缝线用环氧乙烷灭菌,缝线环氧乙烷残留量应不大于10ug/g。4.7缝线的生物性能
材料应符合GB/T16886.1的规定,应不产生任何毒副作用。4.7.1
细胞藓性试验反应不大于1级。
皮内刺激试验应为无刺激性。
应无溶血作用(溶血率不大于5%)。急性全身毒性试验应无毒性。
过敏试验应无致敏反应。
应无致热原反应。
植入试验植入周期为3个月,观察取样时间为1,4,12周:若生物学反应仍不稳定,继续观察到26周。炎症细胞反应程度和纤维囊腔形成程度应符合规定。4.7.8Ames试验应为阴性。
生物降解试验应符合GB/T16886.9—2001的规定。4.7.9
4.8缝线应无菌。
4.9包装标志应清晰。
trkaNnKe
5试验方法
5.1外观
YY1116—2002
取10根缝线,在正常光照下目测,应符合4.1的规定。5.2线径
5.2.1试验装置
线径测量仪,最小分度值0.002mm,压脚与基准面的平整度在0.005mm之内,且互相平行,压脚直径为10~15mm,基准面的直径应不小于压脚的直径,压脚加在缝线上的负载在90~210g之间。5.2.2试验程序
a)从包装中取出缝线后不经拉伸,应马上进行线径的测量。若缝线用液体包装,试验必须在缝线从液体中取出后2min内完成。
b)把缝线的一端固定在线径测量仪上,同时,缝线的另一端应施加一定的张力。张力的大小应根据缝线的规格取表3抗张强度平均值的二分之一。c)使线径测量仪的压脚,轻轻地落在缝线上,测量每根缝线约1/4,1/2,3/4处三个点的线径。d)取10根缝线,按a),b),c)的程序测定。5.2.3试验结果说明
比较缝线每一点线径,应不小于上一个较小规格线径范围的中间值,不大于下一个较大规格线径的中间值。线径的平均值应符合4.2的规定。5.3抗张强度
5.3.1试验设备
材料试验机。
5.3.2试验条件
拉伸速度为300mm/min,试验标距为100~150mm。5.3.3试验程序
取长约200mm的样品,共取10根缝线,进行试验。把缝线打一个自由结,样品夹在材料试验机上,结应位于两夹头的中间,并使夹具间的缝线绷紧;对于Ⅱ类规格小于8-0的缝线应不打结,直接进行试验。
5.3.4试验结果说明
比较单根缝合线的抗张强度,1类缝线应不小于表3中单个值,1类缝线应不小于表3中规定值的二分之一。抗张强度的平均值应符合4.3规定。5.4针线连接强度
把带有缝合针的缝线的针端和线端分别夹于材料试验机的两个夹具上,以300mm/min的拉伸速度,100mm的试验标距,进行试验,共取5根缝线进行连接强度试验.其平均值、单个值应符合4.4的规定。
5.5长度
取5根缝线以通用长度量具测量,在测量过程中不带张力牵直测量,应符合4.5的规定。5.6化学性能
5.6.1酸碱度
5.6.1.1浸提液制备:在洁净化学情性的封闭容器中,容器内顶部空间尽量小并保证安全性。在无污染的条件下,于电热恒温培养箱,37C浸提72h士2h。5.6.1.2酸碱度:按GB/T14233.1—1998中5.4方法进行,应符合4.6.1的规定。5.6.2重金属
5.6.2.1水浸液制备
YY1116—2002
在同批缝线中随机抽取缝线1m,截成约1cm长的线段,加蒸馏水20mL,使其外表面完全浸湿,加盖置于37℃环境浸泡24h,取其水没液。5.6.2.2试验方法按GB/T14233.1--1998规定进行,应符合4.6.2的规定。5.6.3脱铬试验
试样2.5g,浸人125mL的蒸馅水中3h以上,过滤,待滤液在水浴装置上蒸于,残清中加入等量的碳酸钾与硝酸钾粉末125mg混合后在炉内熔融,冷却后在12.5ml.蒸馏水内溶解,滴入稀硫酸使溶液成酸性,加入1%浓度的二萘借偕耕乙醇溶液1~2滴,显色不得为微红色,应符合4.6.3的规定。5.6.4含水量试验
按重量分析法(干燥失重),将2g1类缝线试样未拆封称重,然后取出缝线,减去包装材料重量,即为缝线实重,然后按重量分析法将缝线在60℃干煤至恒重,减失重量应符合4.6.4的规定。5.6.5褪色试验
5.6.5.1标准比色液的配制
按照GB/T9737一1988中4.2、4.3、4.4的规定,配制氯化钴、硫酸铜、氯化铁三种溶液。然后按照表5的规定配制各种颜色的标准比色液。5.6.5.2称取0.25g缝线,置于100mL锥形瓶,加25mL蒸馅水,并使其37C±0.5C恒温24h。冷却后.倒出溶液于比色管中。
5.6.5.3取10mL溶液,倒入比色管中,根据溶液颜色选取对应的标准比色液,在相同条件下比较。试验溶液颜色应不深于相应标准比色液的颜色,则符合4.6.5的规定。表5标准比色液
每10mL标准比色液中含有
黄棕色
粉红色
蓝绿色
紫红色
硫酸铜(CuSO,)溶液
5.6.6环氧乙烷残留量试验
氯化钻(CoCl)溶液
氯化铁(FeCls)溶液
按GB/T14233.1--1998中的试验方法,试验结果应符合4.6.6的规定。5.7缝线的生物性能
浸提液的制备
没提条件为:
37C±1C:
a)浸提温度
b)浸提时间
24h±2h
c)浸提介质
生理盐水;
d)供试品按长度与没提介质体积比例1m/20mL。5.7.1细胞毒性试验
按GB/T16886.5—1997中8.3的规定进行试验,应符合4.7.1的规定。5.7.2皮内刺激试验
取浸提液,按GB/T14233.2—1993中的规定进行,应符合4.7.2的规定。5.7.3溶血试验
取浸提液,按GB/T16175--1996中第11章的规定进行,应符合4.7.3的规定。5.7.4急性全身毒性试验
TKAoNKAca
蒸馏水
YY1116—2002
取没提液,按GB/T16886.11中第6.5.4的规定进行,应符合4.7.4的规定。5.7.5过敏试验
取浸提液,按GB/161751996中第5章的规定进行,应符合4.7.5的规定。5.7.6热原试验
取浸提液,按GB/T16175—1996第12章的规定进行,应符合4.7.6的规定。5.7.7植人试验
按GB/T16886.6的规定进行,应符合4.7.7的规定。5.7.8Ames试验
按GB/T16886.3—1997中第5章的规定进行,应符合4.7.8的规定。5.7.9生物降解试验
按GB/T16886.9—2001的规定进行,应符合4.7.9的规定。5.8无菌试验
按《中华人民共和国药典》2000年版(二部)中附录无菌检查法的规定进行,应符合4.8的规定。5.9包装标志
日力观察小包装的标志,应符合4.9的规定。6检验规则
6.1缝线应由制造厂技术检验部门进行检查,并保证产品质量符合本标准的要求。6.2组批
个检验批可由一个生产批构成:这些生产批是在基本相同的材料、工艺设备等条件下制造出来的。若干个生产批次构成一个检验批时,必须是在同一次灭菌条作下生产的产品。6.3出厂检验
6.3.1缝线出厂时的检验项目及抽样方法见表6表6检验项目及抽样量
抽样量
1在检查其他项目时同时检查4.9和7.1.1。2共应抽取30根,3.00g及7个小包装。6.3.2判定规则
小包装
检验中,每一个检验项目均应合格。除无菌外若出现其他项目不合格,则抽取不合格项目的双倍样品,进行重复检验,应全部合格,若发现一项检验不合格,则判为该批产品不合格。6.4型式检验
6.4.1在下列情况下应进行型式检验:a)新产品投产前;
b)连续生产中每年不少于一次;c)间隔半年以上再投产时;
d)在设计、工艺或材料有重大改变时e)国家质量监督检验机构对产品质量进行监督检查时。6.4.2型式检验的检验项目及抽样方法同出厂检验。在下列任一情况下应增加4.6.4和4.7的规定,YY1116-2002
进行含水量和生物学评价(无下列情况可以豁免)。a)制造产品所用材料来源或技术条件改变时;b)产品配方、工艺、初级包装或灭菌改变时;c)贮存期内最终产品中的任何变化;d)产品用途改变时;
e)有迹象表明产品用于人体时产生副作用。6.4.3型式检验的判定规则同6.3.2。7标志、使用说明书
7.1标志
7.1.1缝线的小包装上应有下列标志:a)制造厂名称或商标;
b)产品注册号、产品标准号:
c)产品名称、材质(例:铬制医用羊肠线、可吸收性合成外科缝线)、结构、规格;d)灭菌失效日期及生产批号:生产日期;e)灭菌方法及醒目的“无菌”字样。7.1.2中包装应有下列标志:
a)制造厂名称或商标及地址;
b)产品注册号、产品标准号;
c)产品名称、材质(例:铬制医用羊肠线、可吸收性合成外科缝线)、规格、数量;d)生产日期、灭菌失效期及生产批号;e)灭菌方法;
f)使用说明。
7.1.3每个中包装内应附有产品合格证,合格证上应有下列标志:a)制造厂名称或商标及地址;
b)检验日期和结论;
c)执行标准;
d)检验员代号。
7.1.4大包装上应有下列标志:
a)制造厂名称或商标及地址:
b)产品名称、材质、型号、规格、数量;c)产品注册号:
d)灭菌失效期和生产批号;
e)灭菌方法和已灭菌标志;
f)体积和重量;
g)“防热”、“防湿”、“防钩\等字样或标志。7.1.5包装贮运图示标志应符合GB191的有关规定。7.2使用说明书
7.2.1使用说明书中应包含下列内容:a)制造厂名称及地址、有关产品批准文号;b)缝线的使用范围及有关注意事项、特殊操作说明和特殊贮存管理要求;c)应注明“一次性使用”“最小包装破损时,不得使用”、灭菌方法和失效期;d)缝线的性能、制造材料和构造,可能带来的副作用;8
JUKAONLKAcA下载标准就来标准下载网
YY1116—2002
e)保证缝线正确、安全使用的要求、丢弃缝线的处理要求;f)缝线与其他器械配套使用的注意事项;g)用液体包装的缝线应注明液体成分;h)缝线在使用过程中出现意外,如断裂时,应采取的措施及注意事项;i)产品标准中规定的应具有的内容说明。7.2.2使用说明书的编写应符合GB9969.1的规定。8包装、运输、贮存
8.1包装
8.1.1产品的小包装应是供一次性使用的最小包装。经过灭菌处理的产品可以用干法贮存,也可用液体包装,所用的包装容器、盒子应当设计合理,能够保持产品的无菌性,直至包装开封。8.1.2产品的中包装中,应有下列文件:a)使用说明书;
b)产品合格证或质量保证书,产品合格证的编写应符合GB/T14436的规定。8.1.3包装其他要求应符合YY/T0313中的有关规定。8.2运输
产品在运输时应防止重压、阳光直射和雨水淋湿,或应按照订货合同规定。8.3存
包装后的产品应贮存在相对湿度不大于80%,清洁、通风良好、无腐蚀性气体的环境中。8.4有效期
在正常贮存条件下,灭菌缝线有效期应不少于三年,不多于五年。o
YY1116-2002
YKANKAca
中华人民共和国医药
行业标准
可吸收性外科缝线
YY1116—2002
中国标准出版社出版
北京复兴门外三里河北街16号
邮政编码:100045
电话:6852394668517548
中国标准出版社秦皇岛印刷厂印刷新华书店北京发行所发行各地新华书店经售开本880×12301/16印张1字数20千字2002年4月第一版2002年4月第一次印刷印数1-1000
网址bzcbs.com
版权专有侵权必究
举报电话:(010)68533533
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
