YY 0236-1996
基本信息
标准号: YY 0236-1996
中文名称:药品包装用复合膜(通则)
标准类别:医药行业标准(YY)
标准状态:现行
出版语种:简体中文
下载格式:.zip .pdf
下载大小:518535

标准分类号
关联标准
出版信息
相关单位信息
标准简介
YY 0236-1996.
5.6化学性能的检 验
二氨基甲苯的测定按GB/T14937的规定进行,其他项目按GB5009.60的规定进行,以三次试验的算术平均值计。
5.7微生物数的检验
5.7.1供试液的制 备
用开孔面积为20cm2的消毒过的金属模板压在试样的内层面上,将无菌棉签用无菌生理盐水稍沾湿,在板孔范围内擦抹5次,换1支棉签再擦抹5次,每个位置用2支棉签共擦抹10次。共擦抹5个位置100cm'。每支棉签擦抹完后立即剪断(或烧断),投入盛有30mL无菌生理水的三角烧瓶(或大试管)中。全部擦抹棉签均投入瓶中后,将瓶迅速摇晃1 min,静置10 min即得1: 1供试液。
5.7.2试验方法 .
按卫生部《药品卫生检验方法》(1990年版)的规定。
5.8异常毒性的检验
5.8.1供试液的制备
取表面积为500cm2的试样,用蒸馏水洗2次,剪成约3cmx3cm的小块,放于干净的容器中,加入除去热原的生理盐水50mL,在60C温度下浸泡2h,然后取出试样,将浸泡液置于高压灭菌器内,121C温度下灭菌30min,取出放冷即得供试液。
5.8.2试验
选取17~ 20g健康无伤小鼠5只,每只小鼠分别在尾静脉注射上述供试液0.5 mL64~5s注完)。全部小鼠在注射后48h内不得有死亡。如有死亡时,应另取10只小鼠复试,全部小鼠在48h内不得有死亡。
6检验规则
6.1产品应由生产厂 质检部门按本标准检验合格后方可出厂。
6.2产品 以相同的原辅料、规格、工艺、配方为- -批(批量大时可二天为一批)。
6.3外观、尺寸及偏差逐卷检验;内层与次内层间剥离强度、溶剂残留量及微生物数按批检验;物理性能、化学性能、热封强度、异常毒性在首批投产及原料或工艺改变时检验;正常生产每半年进行全项检验。
6.4除逐卷检验项目外,其余项目检验的抽样数为待检批中的任一卷。
6.5逐卷检验的取样量为每卷2m,其余项目检验的取样量为抽样卷中去掉最外三层后取至少三层。
6.6大肠杆菌 、金色葡萄球菌、绿脓杆菌数及化学性能、异常毒性如有-项不合格则该批产品为不合格;其余项目如不合格,则应重新抽样(逐卷检验不合格则对该卷重新取样)对不合格项复检,如仍不合格则该批产品为不合格。
5.6化学性能的检 验
二氨基甲苯的测定按GB/T14937的规定进行,其他项目按GB5009.60的规定进行,以三次试验的算术平均值计。
5.7微生物数的检验
5.7.1供试液的制 备
用开孔面积为20cm2的消毒过的金属模板压在试样的内层面上,将无菌棉签用无菌生理盐水稍沾湿,在板孔范围内擦抹5次,换1支棉签再擦抹5次,每个位置用2支棉签共擦抹10次。共擦抹5个位置100cm'。每支棉签擦抹完后立即剪断(或烧断),投入盛有30mL无菌生理水的三角烧瓶(或大试管)中。全部擦抹棉签均投入瓶中后,将瓶迅速摇晃1 min,静置10 min即得1: 1供试液。
5.7.2试验方法 .
按卫生部《药品卫生检验方法》(1990年版)的规定。
5.8异常毒性的检验
5.8.1供试液的制备
取表面积为500cm2的试样,用蒸馏水洗2次,剪成约3cmx3cm的小块,放于干净的容器中,加入除去热原的生理盐水50mL,在60C温度下浸泡2h,然后取出试样,将浸泡液置于高压灭菌器内,121C温度下灭菌30min,取出放冷即得供试液。
5.8.2试验
选取17~ 20g健康无伤小鼠5只,每只小鼠分别在尾静脉注射上述供试液0.5 mL64~5s注完)。全部小鼠在注射后48h内不得有死亡。如有死亡时,应另取10只小鼠复试,全部小鼠在48h内不得有死亡。
6检验规则
6.1产品应由生产厂 质检部门按本标准检验合格后方可出厂。
6.2产品 以相同的原辅料、规格、工艺、配方为- -批(批量大时可二天为一批)。
6.3外观、尺寸及偏差逐卷检验;内层与次内层间剥离强度、溶剂残留量及微生物数按批检验;物理性能、化学性能、热封强度、异常毒性在首批投产及原料或工艺改变时检验;正常生产每半年进行全项检验。
6.4除逐卷检验项目外,其余项目检验的抽样数为待检批中的任一卷。
6.5逐卷检验的取样量为每卷2m,其余项目检验的取样量为抽样卷中去掉最外三层后取至少三层。
6.6大肠杆菌 、金色葡萄球菌、绿脓杆菌数及化学性能、异常毒性如有-项不合格则该批产品为不合格;其余项目如不合格,则应重新抽样(逐卷检验不合格则对该卷重新取样)对不合格项复检,如仍不合格则该批产品为不合格。
标准图片预览



标准内容
中华人民共和国医药行业标准
YY02361996
药品包装用复合膜(通则)
1996-02-06发布
国家医药管理局发布
1996-06-01实施
YY0236—1996
药品包装用复合膜因结构及材料组成术同而具有较多的种类,虽然相互之间有些性能差异较大,但亦有许多共同之处,且药品包装对包装材料也有特殊的要求。为此,有必要制订本标准,作为药品包装用复合膜生产和检验的依据。本标准悬对药品包装用复合膜的基本要求,生产企业应根据本标准制订企业柜应的产品标雅,
本标准由国家医药管理局提出。本标准由国家医药管理局包装材料科研检测中心归口。本标准负责起草单位广州药用包装材料厂。本标准主要起草人,郭云峰、梁江、陈继东。TTKAONYKACa
中华人民共和国医药行业标准
药品包装用复合膜(通则)
YY0236-1996
本标准规定了药品包装用复合膜的产品分类、技术要求、试验方法、检验规则及标志、包装、运输、贮存要求。
本标准适用于固体药品或液体药品包装用的复合膜。引用标准
下列标准所包含的条文,通过在本标准中引用而构成为本标准条文。本标准出版时,所示版本均为有效。所有标准都会被修订,使用本标准的各方应探讨便用下列标准最新版本的可能性。GB191—90包装储运图示标志
GB 1037—88
塑料薄膜和片材透水蒸气性试验方法杯式法塑料薄膜透气性试验方法
GB 103870
GB5009.60一85食品包装用聚乙烯、聚苯乙烯、案丙烯成型品卫生标准的分析方法GB6672—86塑料薄膜和薄片厚度的测定机械测量法GB 6673-86
塑料薄膜与片材长度和宽度的测定GB 8808—88
软质复合塑料材料剥离试验方法GB/T14937—94复合食品包装袋中一氨基甲苯测定方法卫生部《药品卫生检验方法》(1990年版)3产品分类
3.1分类
复合膜按材质组合分类,如表1所示。表1
纸.塑料
料、镀铬膜
(纸)、铝箱、塑料
塑料(非单层)、铝箱
注:PT 归\纸\类。
3.2规格尺小
纸/PE
PET/EVA,PET/PE,KPT/PE,OPP/PEOPP/镀铝 CPP,PFT/镀铅 PET/PE例
纸/AI/PE,徐层/A1/PE,PT/PE/AI/PE,纸/PE/AI/离子型聚合物PET/AI/PE,PA/AI/PE
3.2.1长度和宽度根据用户要求而定,厚度根据用户要求及结构而定。国家医药管理局1996-02-06批准1996-06-01实施
YY0236—1996
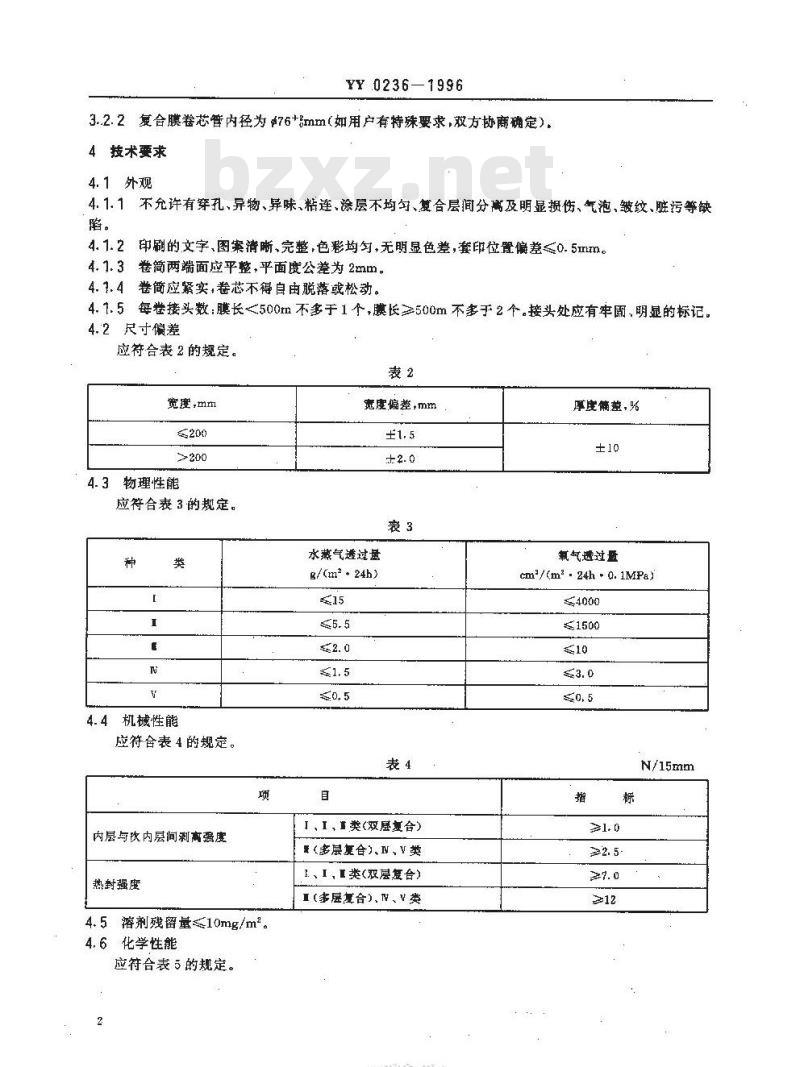
3.2.2复合膜卷芯管内径为?76+mm(如用户有特殊要求,双方协商确定)4按术要求
4.1外观
4.1.1不允许有穿孔、异物、异味、精连、涂层不均、复合层间分高及明显损伤、气泡、皱纹、脏污等缺陷。
4.1.2印刷的文字、图案清晰、完整,色彩均匀,无明显色差,套印位置偏差≤0.5mm。4.1.3卷简两端面应平整,平面度公差为2mm。4.3.4卷简应紧实,卷芯不得自由脱落或松动。4.1.5每举接头数:膜长<500m不多于1个,膜长≥500m不多于2个。接头处应有牢固,明显的标记。4.2尺寸偏差
应符合表2的规定。
宽度,mm
4.3物理性能
应符合表3的规定。
机械性能
应符合表4的规定。
内层与次内层间刹离强度
热封强度
4.5溶剂残留量10mg/m。
4.6化学性能
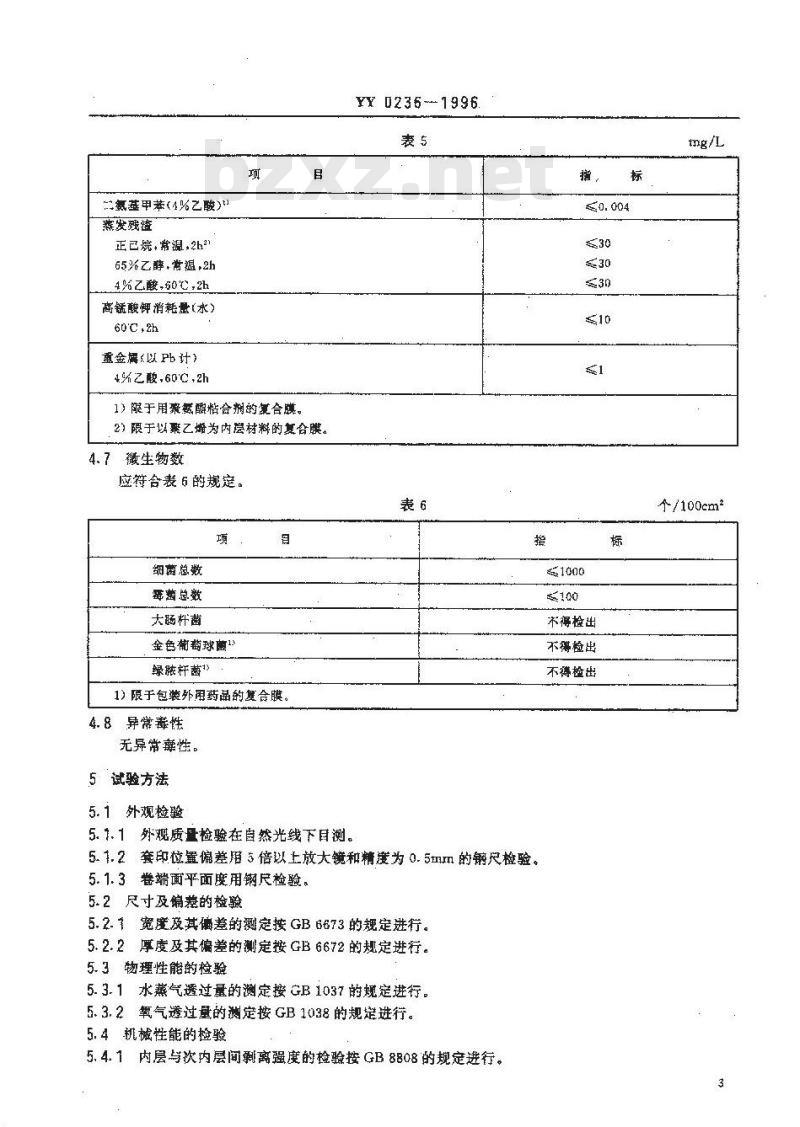
应符合表5的规定。
宽度偏差,mm
水燕气透过量
g/(m2 24h)
「,I,I类(双层复合)
(多层复合)、N、V类
1、I,I类(双层复合)
I(多层复合)、N、V类
FKAONTKACa
厚度篇差,%
氧气遗过量
cm/(m2 24h * 0. 1MPa)
N/15mm免费标准下载网bzxz
三氨基甲苯(4%乙酸)
蒸发残渣
正已烷,常温,2h31
65%乙醇,常温,2h
.4%乙酸,60℃.2h
高锰酸钾消耗量(水)
60C,2h
重金爆(以Pb计)
4%乙酸,60℃,2h
1) 限于用案氨酸粘合剂的复合膜。2)限于以桑乙烯为内层材料的复合膜。4.7微生物数
应符合表6的规定。
细菌总数
霉菌总数
大肠杆菌
金色葡莓球菌1
绿脓杆菌》
1)限于包装外用药品的复合膜。4.8异常毒性
无异常囊性。
5试验方法
5.1外观检验
5.1.1外观质检验在自然光线下月测。YX 0236---1996
术得检出
不得检出
不检出
5.1.2套印位置偏差用5倍以上放大镜和精度为0.5mm的钢尺检验。5.1.3卷端面平面度用钢尺检验。5. 2 尺寸及编差的检验
5.2.1宽度及其体差的测定按GB6673的规定进行。5.2.2厚度及其偏差的测定按GB6672的规定进行。5.3物理性能的检验
5.3.1水蒸气透过量的测定按GB1037的规定进行。5.3.2氧气透过量的测定按GB 1038的规进行。5.4机械性能的捡验
5.4.1内层与次内层间剩离强度的检验按GB8808的规定进行。mg/L
个/100cm2
5.4.2热封强度的检验
5.4.2.1设备
拉力试验机、热封仪。
YY 0236-1996
5.4.2.2试样制备
在成品中切取100mm×100mm试片四个,将任意两个试片的内层叠合,放在热封仪中热封。用标准试样裁切器在两块热封后的试片中间部位按图1所示各切出三条15mm宽的试样。热封区
裁划线
5.4.2.3操作
a)·调整好拉力试验机并便记录器指针对准零点。b)设定拉伸速虚300mm/min。
c)将试样未热封较长侧分开成180°,两端分别夹在试验机的上、下夹头上。d)开动试验机进行剥离。
5.4.2.4数据处理
以记录器描绘的曲线指示的最大值为该试样的热封强度值,取6个试样热封强度值的算术平均值为受检产品的热封强度值。
5.5溶剂残留量的检验
5.5.1仪器
通用气相色谱仪,氢火焰离子化检测器5.5.2试验条件
色谱柱:10%聚乙二醇20M,有机担体401.2m不锈钢柱;载气·氨气;
一燃气:氢气;
助燃气:空气;
柱箱温度,70℃~90℃
-检测室温度:约120℃;
气化率温度,约150℃。
5.5.3标准曲线的绘制
按生产实际使用溶剂的种类配制标准溶剂样品,分别取1zL和2uL、3uL样品.精密称定后,置于硅4
YIKAONYKACa
:YY 0236--1996
橡胶塞密封好的500mL一角瓶中,和进样器一起送入80℃士2℃烘箱中,加热30min后,迅速地用预热好的进样器取1mL瓶中气体注入色谱仪中进行测定。以其出峰总面积值和对应的样品童量为坐标绘制出标推曲线。
5.5.4试验步骤
裁取0.2m2样品,将其迅速裁成10mm×30mm碎片,放入500mL三角瓶中,用硅橡胶塞密封好后,和进样器一起送入80e土2℃烘箱中,加热30min后,迅速地用预热好的进样器取1mL·瓶中气体注入色谱仪中进行测定,以其出峰总面积值在标准曲线上查出对应的溶剂残留量。试验结果以mg/m表示。
5.6化学性能的检验
二基甲苯的测定按GB/T14937的规定进行,其他项自按GB5009.60的规定进行,以三次试验的算术平均值计。
5.7微生物数的检验
5.7.1供试液的制备
用开孔面积为20cm的消毒过的金属模板压在试样的内层面上,将无菌棉签用无菌生理盐水稍沾湿,在板孔范围内擦抹5次,换1支棉签再擦抹5次,每个位置用2支棉签共擦抹10次。共擦抹5个位置100cm。每支棉签擦抹完后立即剪断(或烧断),投入盛有30㎡L无菌生理水的三角烧瓶(或大试管)中。全部擦抹棉签均投人瓶中后,将瓶迅速摇觅1min,静置10min即得1:1供试液。5.7.2试验方法
按卫生部《药品卫生检验方法(1990年版)的规定。5.8异常毒性的检验
5.8.1供试液的制备
取表面积为500cm的试样,用蒸馏水洗2次,剪成约3cm×3cm的小块,放于干净的容器中,加入除去热原的生理盐水50mL,在60℃温度下漫泡2h,然后取出试样,将浸泡液置于高压灭菌器内,121℃温度下灭菌30min,取出放冷即得供试液。5.8.2试验
选取17~20g健康无伤小鼠5只,每只小鼠分别在尾静脉注射.上述供试液0.5mL《4~5s注完)。全部小鼠在注射后48h内不得有死亡。如有死亡时,应另取10只小鼠复试,全部小鼠在48h内不得有苑亡。
6检验规则
6.1产品应由生产厂质检部门按本标准检验合格后方可出厂。6.2产品以相同的原辅料,规格、工艺,配方为一批(批量大时可二天为一批)。6.3外观、尺了及偏差逐卷检验:内层与次内层间剥离强度,溶剂残留量及微生物数按批检验,物理性能、化学性能,热封强度,异常性在首批投产及原料或工艺改变时检验,正常生产每半年进行全项检验。
6. 4除逐卷检验项目外,其余项目检验的抽样数为待检批中的任一卷。6.5逐卷检验的取样量为每卷2m,其余项检验的取样量为抽样卷市去掉最外三层后取至少三层。6.6大肠杆菌、金色郁球菌、绿脓杆菌数及化学性能、异带毒性如有一项不合格则该批产品为不合格;其余项目如不合格,则应重新抽样(逐卷检验不合格则对该卷重新取样)对不台格项复检,如仍不台格则该批产品为不合格。
7标志、包装、运输、贮存
7.1产品内包装材料应清洁、无薄,防潮。内包装应在洁净区内进行,内包装应封孔,外包装可用瓦楞5
纸箱。
YY 0236-1996
7.2包装箱上应注明,生产厂名称、地址,商标产品名称、规格,许可证号,产品批号、数最、净量、生产日期。
7.3每箱产品应附有合格证,其上注明:生产厂名称、商标、产品名称、规格、数量、净重、生产日期及批号、检验员代号。
7.4包装箱上应有“防潮”“小心轻放”及“向上”标志,其图形应符合GB191的规定。7.5运输时应防止撞击、日晒丽淋及污染。7.6产品应贮存在清洁、阴凉,干燥的库房内。产品周围1m以内不得有热源。在上述存条件下,产品保质期为一年(从生产目期起计)。TTKAONHTKAa
中华人民共和国医药
行业标准
药品包装用复合膜(通则)
YY0236—1996
中国标准出版杜出版
北京复兴门外三粤河北衡16号
邮政编码:100045
电话:8522112
中国标准出版社兼皇岛印刷厂印刷新华书店北京发行所发行各地新华书店经售版权专有不得翻印
开本880×12301/16
印张 3/4 字敷 12 千字
反1996年7月第一次印剩
1996年7月筛一版
印数 1—2 000
书号:155066 + 2-10688
定价 6. 00 元
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
YY02361996
药品包装用复合膜(通则)
1996-02-06发布
国家医药管理局发布
1996-06-01实施
YY0236—1996
药品包装用复合膜因结构及材料组成术同而具有较多的种类,虽然相互之间有些性能差异较大,但亦有许多共同之处,且药品包装对包装材料也有特殊的要求。为此,有必要制订本标准,作为药品包装用复合膜生产和检验的依据。本标准悬对药品包装用复合膜的基本要求,生产企业应根据本标准制订企业柜应的产品标雅,
本标准由国家医药管理局提出。本标准由国家医药管理局包装材料科研检测中心归口。本标准负责起草单位广州药用包装材料厂。本标准主要起草人,郭云峰、梁江、陈继东。TTKAONYKACa
中华人民共和国医药行业标准
药品包装用复合膜(通则)
YY0236-1996
本标准规定了药品包装用复合膜的产品分类、技术要求、试验方法、检验规则及标志、包装、运输、贮存要求。
本标准适用于固体药品或液体药品包装用的复合膜。引用标准
下列标准所包含的条文,通过在本标准中引用而构成为本标准条文。本标准出版时,所示版本均为有效。所有标准都会被修订,使用本标准的各方应探讨便用下列标准最新版本的可能性。GB191—90包装储运图示标志
GB 1037—88
塑料薄膜和片材透水蒸气性试验方法杯式法塑料薄膜透气性试验方法
GB 103870
GB5009.60一85食品包装用聚乙烯、聚苯乙烯、案丙烯成型品卫生标准的分析方法GB6672—86塑料薄膜和薄片厚度的测定机械测量法GB 6673-86
塑料薄膜与片材长度和宽度的测定GB 8808—88
软质复合塑料材料剥离试验方法GB/T14937—94复合食品包装袋中一氨基甲苯测定方法卫生部《药品卫生检验方法》(1990年版)3产品分类
3.1分类
复合膜按材质组合分类,如表1所示。表1
纸.塑料
料、镀铬膜
(纸)、铝箱、塑料
塑料(非单层)、铝箱
注:PT 归\纸\类。
3.2规格尺小
纸/PE
PET/EVA,PET/PE,KPT/PE,OPP/PEOPP/镀铝 CPP,PFT/镀铅 PET/PE例
纸/AI/PE,徐层/A1/PE,PT/PE/AI/PE,纸/PE/AI/离子型聚合物PET/AI/PE,PA/AI/PE
3.2.1长度和宽度根据用户要求而定,厚度根据用户要求及结构而定。国家医药管理局1996-02-06批准1996-06-01实施
YY0236—1996
3.2.2复合膜卷芯管内径为?76+mm(如用户有特殊要求,双方协商确定)4按术要求
4.1外观
4.1.1不允许有穿孔、异物、异味、精连、涂层不均、复合层间分高及明显损伤、气泡、皱纹、脏污等缺陷。
4.1.2印刷的文字、图案清晰、完整,色彩均匀,无明显色差,套印位置偏差≤0.5mm。4.1.3卷简两端面应平整,平面度公差为2mm。4.3.4卷简应紧实,卷芯不得自由脱落或松动。4.1.5每举接头数:膜长<500m不多于1个,膜长≥500m不多于2个。接头处应有牢固,明显的标记。4.2尺寸偏差
应符合表2的规定。
宽度,mm
4.3物理性能
应符合表3的规定。
机械性能
应符合表4的规定。
内层与次内层间刹离强度
热封强度
4.5溶剂残留量10mg/m。
4.6化学性能
应符合表5的规定。
宽度偏差,mm
水燕气透过量
g/(m2 24h)
「,I,I类(双层复合)
(多层复合)、N、V类
1、I,I类(双层复合)
I(多层复合)、N、V类
FKAONTKACa
厚度篇差,%
氧气遗过量
cm/(m2 24h * 0. 1MPa)
N/15mm免费标准下载网bzxz
三氨基甲苯(4%乙酸)
蒸发残渣
正已烷,常温,2h31
65%乙醇,常温,2h
.4%乙酸,60℃.2h
高锰酸钾消耗量(水)
60C,2h
重金爆(以Pb计)
4%乙酸,60℃,2h
1) 限于用案氨酸粘合剂的复合膜。2)限于以桑乙烯为内层材料的复合膜。4.7微生物数
应符合表6的规定。
细菌总数
霉菌总数
大肠杆菌
金色葡莓球菌1
绿脓杆菌》
1)限于包装外用药品的复合膜。4.8异常毒性
无异常囊性。
5试验方法
5.1外观检验
5.1.1外观质检验在自然光线下月测。YX 0236---1996
术得检出
不得检出
不检出
5.1.2套印位置偏差用5倍以上放大镜和精度为0.5mm的钢尺检验。5.1.3卷端面平面度用钢尺检验。5. 2 尺寸及编差的检验
5.2.1宽度及其体差的测定按GB6673的规定进行。5.2.2厚度及其偏差的测定按GB6672的规定进行。5.3物理性能的检验
5.3.1水蒸气透过量的测定按GB1037的规定进行。5.3.2氧气透过量的测定按GB 1038的规进行。5.4机械性能的捡验
5.4.1内层与次内层间剩离强度的检验按GB8808的规定进行。mg/L
个/100cm2
5.4.2热封强度的检验
5.4.2.1设备
拉力试验机、热封仪。
YY 0236-1996
5.4.2.2试样制备
在成品中切取100mm×100mm试片四个,将任意两个试片的内层叠合,放在热封仪中热封。用标准试样裁切器在两块热封后的试片中间部位按图1所示各切出三条15mm宽的试样。热封区
裁划线
5.4.2.3操作
a)·调整好拉力试验机并便记录器指针对准零点。b)设定拉伸速虚300mm/min。
c)将试样未热封较长侧分开成180°,两端分别夹在试验机的上、下夹头上。d)开动试验机进行剥离。
5.4.2.4数据处理
以记录器描绘的曲线指示的最大值为该试样的热封强度值,取6个试样热封强度值的算术平均值为受检产品的热封强度值。
5.5溶剂残留量的检验
5.5.1仪器
通用气相色谱仪,氢火焰离子化检测器5.5.2试验条件
色谱柱:10%聚乙二醇20M,有机担体401.2m不锈钢柱;载气·氨气;
一燃气:氢气;
助燃气:空气;
柱箱温度,70℃~90℃
-检测室温度:约120℃;
气化率温度,约150℃。
5.5.3标准曲线的绘制
按生产实际使用溶剂的种类配制标准溶剂样品,分别取1zL和2uL、3uL样品.精密称定后,置于硅4
YIKAONYKACa
:YY 0236--1996
橡胶塞密封好的500mL一角瓶中,和进样器一起送入80℃士2℃烘箱中,加热30min后,迅速地用预热好的进样器取1mL瓶中气体注入色谱仪中进行测定。以其出峰总面积值和对应的样品童量为坐标绘制出标推曲线。
5.5.4试验步骤
裁取0.2m2样品,将其迅速裁成10mm×30mm碎片,放入500mL三角瓶中,用硅橡胶塞密封好后,和进样器一起送入80e土2℃烘箱中,加热30min后,迅速地用预热好的进样器取1mL·瓶中气体注入色谱仪中进行测定,以其出峰总面积值在标准曲线上查出对应的溶剂残留量。试验结果以mg/m表示。
5.6化学性能的检验
二基甲苯的测定按GB/T14937的规定进行,其他项自按GB5009.60的规定进行,以三次试验的算术平均值计。
5.7微生物数的检验
5.7.1供试液的制备
用开孔面积为20cm的消毒过的金属模板压在试样的内层面上,将无菌棉签用无菌生理盐水稍沾湿,在板孔范围内擦抹5次,换1支棉签再擦抹5次,每个位置用2支棉签共擦抹10次。共擦抹5个位置100cm。每支棉签擦抹完后立即剪断(或烧断),投入盛有30㎡L无菌生理水的三角烧瓶(或大试管)中。全部擦抹棉签均投人瓶中后,将瓶迅速摇觅1min,静置10min即得1:1供试液。5.7.2试验方法
按卫生部《药品卫生检验方法(1990年版)的规定。5.8异常毒性的检验
5.8.1供试液的制备
取表面积为500cm的试样,用蒸馏水洗2次,剪成约3cm×3cm的小块,放于干净的容器中,加入除去热原的生理盐水50mL,在60℃温度下漫泡2h,然后取出试样,将浸泡液置于高压灭菌器内,121℃温度下灭菌30min,取出放冷即得供试液。5.8.2试验
选取17~20g健康无伤小鼠5只,每只小鼠分别在尾静脉注射.上述供试液0.5mL《4~5s注完)。全部小鼠在注射后48h内不得有死亡。如有死亡时,应另取10只小鼠复试,全部小鼠在48h内不得有苑亡。
6检验规则
6.1产品应由生产厂质检部门按本标准检验合格后方可出厂。6.2产品以相同的原辅料,规格、工艺,配方为一批(批量大时可二天为一批)。6.3外观、尺了及偏差逐卷检验:内层与次内层间剥离强度,溶剂残留量及微生物数按批检验,物理性能、化学性能,热封强度,异常性在首批投产及原料或工艺改变时检验,正常生产每半年进行全项检验。
6. 4除逐卷检验项目外,其余项目检验的抽样数为待检批中的任一卷。6.5逐卷检验的取样量为每卷2m,其余项检验的取样量为抽样卷市去掉最外三层后取至少三层。6.6大肠杆菌、金色郁球菌、绿脓杆菌数及化学性能、异带毒性如有一项不合格则该批产品为不合格;其余项目如不合格,则应重新抽样(逐卷检验不合格则对该卷重新取样)对不台格项复检,如仍不台格则该批产品为不合格。
7标志、包装、运输、贮存
7.1产品内包装材料应清洁、无薄,防潮。内包装应在洁净区内进行,内包装应封孔,外包装可用瓦楞5
纸箱。
YY 0236-1996
7.2包装箱上应注明,生产厂名称、地址,商标产品名称、规格,许可证号,产品批号、数最、净量、生产日期。
7.3每箱产品应附有合格证,其上注明:生产厂名称、商标、产品名称、规格、数量、净重、生产日期及批号、检验员代号。
7.4包装箱上应有“防潮”“小心轻放”及“向上”标志,其图形应符合GB191的规定。7.5运输时应防止撞击、日晒丽淋及污染。7.6产品应贮存在清洁、阴凉,干燥的库房内。产品周围1m以内不得有热源。在上述存条件下,产品保质期为一年(从生产目期起计)。TTKAONHTKAa
中华人民共和国医药
行业标准
药品包装用复合膜(通则)
YY0236—1996
中国标准出版杜出版
北京复兴门外三粤河北衡16号
邮政编码:100045
电话:8522112
中国标准出版社兼皇岛印刷厂印刷新华书店北京发行所发行各地新华书店经售版权专有不得翻印
开本880×12301/16
印张 3/4 字敷 12 千字
反1996年7月第一次印剩
1996年7月筛一版
印数 1—2 000
书号:155066 + 2-10688
定价 6. 00 元
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。