YY 0240-1996
标准分类号
关联标准
出版信息
相关单位信息
标准简介
YY 0240-1996.Pharmaceutical exclplents-Magnesium aluminum sillcate.
5.4.1试剂 和溶液
0. lmol/L的盐酸溶液:取盐酸9mL,加水稀释至1 00mL,即得。
5.4.2测定方法
取本品1g,加新锦过的冷水50mL,混匀后滤过,滤液用0.1mol/L的盐酸溶液滴定至pH=4.0,消耗0.1mol/L的盐股溶液小于10mL.
5.5粘度
在20C时,取本品5%水洛液,按中华人民共和国药典-九九五年版二部附录38页粘度测定法第二法测定(选1号转子,转速60r/min).
5.6重金属
取本品1. 0g.按中华人民共和国药典一九九五年 版二部附录54页重金属检查法第-法测定。
5.7千燥失重
取本品1.0g,在105C干燥至恒重.按中华人民共和国药典--九九五年版二部附录58页干燥失重测定法测定。
5.8炽灼失重
取本品1.0g.r800C高温炉中,炽灼至恒重,按中华人民共和国药典一九九五年版二部附录59页炽灼残渣检在法测定.
5.9铝含悬和镁含量的比
5.9.1试剂和溶液
5.9.1.1稀盐酸:按中华人民共和国药典一九九五年版二部附录171页试液配制.
5.9.1.2乙酸-乙酸铵缓冲液(pH=6.0):按中华人民共和国药典-九九五年版二部附录176页级冲液配制。
5.9.1.3乙二胺四乙酸二 钠液(0.05mol/L) :按中华人民共和国药典- - 九九五年版二部附录180页滴定液配制并稀释。
5.9.1.4锌液(0. 05mol/L).按中华人民共和国药典-九九五年版二部附录186页滴定液配制。
5.9.1.5氧化铵溶液:取筑化铵10.5g.加水使溶解成100mL,即得.
5.9.1.6三乙醇胶溶 液(1→2):取50mL三乙醇胺,加水使溶解成100mL,即得。
5.9.1.7二甲酚椎指示液:取二甲酚椏0.2g,加水100mL使溶解,即得。
5.9.1.8甲基红指示液:取甲苫红0.1g,加氢氧化钠液(0.05mol/L)7.4mL使溶解,再加水稀释至200mL ,即得。
5.9.2测定方法
5.9.2.1氧化铝
取本品0.2g.精密称定,加盐酸2mL与水50mL,煮沸使溶解,放冷,滤过,滤渣用水洗涤,洗液与滤液合并,滴加氨试液至恰好析出沉淀再海加稀盐酸使沉淀恰好溶解.加乙酸~乙酸铵级冲液(pH6.0)10mL.精密加0.05mol/L乙胺四乙酸二钠液25mL,煮沸10min,放冷,加二甲酚橙指示液1mL,用0. 05mol/L锌液滴定至洛液由黄色转变为红色,即得。
5.9.2.2分析结果的表述
5.4.1试剂 和溶液
0. lmol/L的盐酸溶液:取盐酸9mL,加水稀释至1 00mL,即得。
5.4.2测定方法
取本品1g,加新锦过的冷水50mL,混匀后滤过,滤液用0.1mol/L的盐酸溶液滴定至pH=4.0,消耗0.1mol/L的盐股溶液小于10mL.
5.5粘度
在20C时,取本品5%水洛液,按中华人民共和国药典-九九五年版二部附录38页粘度测定法第二法测定(选1号转子,转速60r/min).
5.6重金属
取本品1. 0g.按中华人民共和国药典一九九五年 版二部附录54页重金属检查法第-法测定。
5.7千燥失重
取本品1.0g,在105C干燥至恒重.按中华人民共和国药典--九九五年版二部附录58页干燥失重测定法测定。
5.8炽灼失重
取本品1.0g.r800C高温炉中,炽灼至恒重,按中华人民共和国药典一九九五年版二部附录59页炽灼残渣检在法测定.
5.9铝含悬和镁含量的比
5.9.1试剂和溶液
5.9.1.1稀盐酸:按中华人民共和国药典一九九五年版二部附录171页试液配制.
5.9.1.2乙酸-乙酸铵缓冲液(pH=6.0):按中华人民共和国药典-九九五年版二部附录176页级冲液配制。
5.9.1.3乙二胺四乙酸二 钠液(0.05mol/L) :按中华人民共和国药典- - 九九五年版二部附录180页滴定液配制并稀释。
5.9.1.4锌液(0. 05mol/L).按中华人民共和国药典-九九五年版二部附录186页滴定液配制。
5.9.1.5氧化铵溶液:取筑化铵10.5g.加水使溶解成100mL,即得.
5.9.1.6三乙醇胶溶 液(1→2):取50mL三乙醇胺,加水使溶解成100mL,即得。
5.9.1.7二甲酚椎指示液:取二甲酚椏0.2g,加水100mL使溶解,即得。
5.9.1.8甲基红指示液:取甲苫红0.1g,加氢氧化钠液(0.05mol/L)7.4mL使溶解,再加水稀释至200mL ,即得。
5.9.2测定方法
5.9.2.1氧化铝
取本品0.2g.精密称定,加盐酸2mL与水50mL,煮沸使溶解,放冷,滤过,滤渣用水洗涤,洗液与滤液合并,滴加氨试液至恰好析出沉淀再海加稀盐酸使沉淀恰好溶解.加乙酸~乙酸铵级冲液(pH6.0)10mL.精密加0.05mol/L乙胺四乙酸二钠液25mL,煮沸10min,放冷,加二甲酚橙指示液1mL,用0. 05mol/L锌液滴定至洛液由黄色转变为红色,即得。
5.9.2.2分析结果的表述
标准图片预览




标准内容
中华人民共和国医药行业标准
药用辅料硅酸镁铝
Pharmaceutical exciplents-
Magnesium aluminum silicate
1主题内容与适用范围
YY0240-1996
本标准规定了药用辅料硅酸镁铝的技术要求、试验方法、检验规则、包装、标志、运输和处存的要求。本标准适用于化学合成法制得的硅酸镁铝,在制药工业中用作悬浮剂、增稠剂、崩解剂、粘合剂等。2引用标准
YY/T0188.1一1995药品检验操作规程第1部分,药品检验操作通则中华人民共和国药典一九九五年版二部3产品化学名称、结构式
,化学名称:硅酸镁铝
magnesium aluminum silicate
结构式:Mg、AI、Si和O(OH)的聚合络合物,是由3个八面体铝晶格层和2个四面体硅层组成,铝被镁不同程度置换。
4技术要求
4.1性状
本品为白色或类白色片状或颗粒形粉末,无臭、无味,微有引湿性。本品在水或乙醇中不溶。
4.2项目和指标
国家医药管理局1996-01-30批准1996-07-01实施
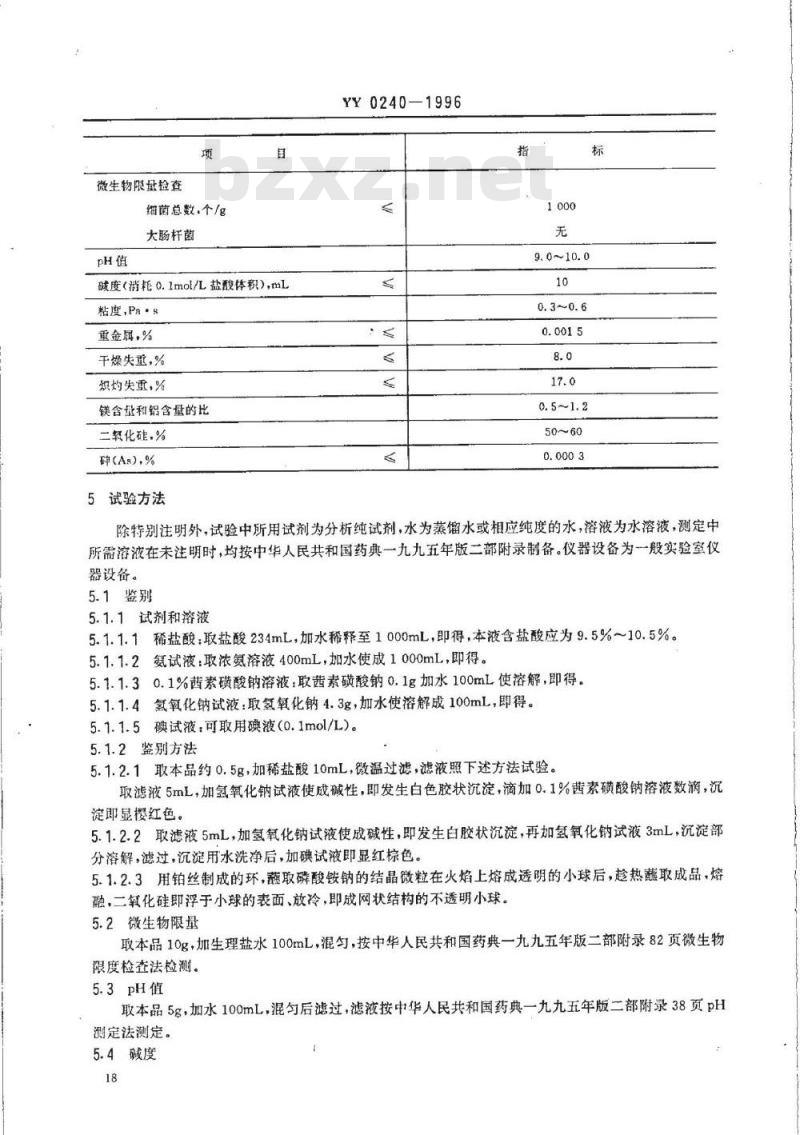
微生物限量检查
细菌总数,个/g
大肠杆菌
碱度(消耗0.1mol/L盐酸体积),mL粘度,Pa·s
重金属,%
干燥失重,%
炽灼失重,%
镁含量和铝含量的比
二载化礁,%
碎(As).%
5试验方法
YY0240—1996
除特别注明外,试验中所用试剂为分析纯试剂,水为蒸馏水或相应纯度的水,溶液为水溶液,测定中所需溶液在未注明时,均按中华人民共和国药典一九九五年版二部附录制备。仪器设备为一般实验室仪器设备。
5.1鉴别
5.1.1试剂和溶液
5.1.1.1稀盐酸:取盐酸234mL,加水稀释至1000mL,即得,本液含盐酸应为9.5%~10.5%。5.1.1.2氨试液:取浓氮溶液400mL,加水使成1000mL,即得。5.1.1.30.1%素磺酸钠溶液:取茜素磺酸钠0.1g加水100mL使溶解,即得。5.1.1.4氢氧化钠试液:取氢氧化钠4.3g,加水使溶解成100mL,即得。5.1.1.5碘试液:可取用碘液(0.1mol/L)。5.1.2鉴别方法
5.1.2.1取本品约0.5g,加稀盐酸10mL,微温过滤,滤液照下述方法试验。取滤液5mL,加氢氧化钠试液使成碱性,即发生白色胶状沉淀,滴加0.1%茜素磺酸钠溶液数滴,沉淀即显樱红色。
5.1.2.2取滤液5mL,加氢氧化钠试液使成碱性,即发生白胶状沉淀,再加氢氧化钠试液3mL,沉淀部分溶解,滤过,沉淀用水洗净后,加碘试液即显红棕色。5.1.2.3用铂丝制成的环,蔽取磷酸铵钠的结晶微粒在火焰上熔成透明的小球后,趁热蘸取成品,熔融,二氧化硅即浮于小球的表面、放冷,即成网状结构的不透明小球。5.2微生物限量
取本品10g,加生理盐水100mL,混匀,按中华人民共和国药典一九九五年版二部附录82页微生物限度检查法检测。
取本品5g,加水100mL,混匀后滤过,滤液按中华人民共和国药典一九九五年版二部附录38页pH测定法测定。
5.4碱度
5.4.1试剂和溶液
YY0240—1996
0.1mol/L的盐酸溶液:取盐酸9mL,加水稀释至1000mL,即得。5.4.2测定方法
取本品1g,加新沸过的冷水50mL,混匀后滤过,滤液用0.1mol/L的盐酸溶液滴定至pH=4.0,消耗0.1mol/L的盐酸溶液小于10mL。5.5粘度
在20℃时,取本品5%水溶液,按中华人民共和国药典一九九五年版二部附录38页粘度测定法第二法测定(选1号转子,转速60r/min)。5.6重金属
取本品1.0g·按中华人民共和国药典一一九九五年版二部附录54页重金属检查法第一法测定。5.7千燥失重
取本品1.0g,在105℃干燥至恒重,按中华人民共和国药典九九五年版二部附录58页干燥失重测定法测定。
5.8炽灼失重
取本品1.0g,置800℃高温炉中,炽灼至恒重,按中华人民共和国药典一九九五年版二部附录59页炽灼残渣检查法测定。
5.9铝含量和镁含量的比
5.9.1试剂和溶液
5.9.1.1稀盐酸:按中华人民共和国药典一九九五年版二部附录171页试液配制。5.9.1.2乙酸-乙酸铵级冲液(pH=6.0):按中华人民共和国药典一九九五年版二部附录176页级冲液配制。
5.9.1.3乙二胺四乙酸二钠液(0.05mol/L):按中华人民共和国药典一九九五年版二部附录180页滴定液配制并稀释。
5.9.1.4锌液(0.05mol/L)。按中华人民共和国药典一九九五年版二部附录186页滴定液配制。5.9.1.5筑化铵溶液:取氟化铵10.5g,加水使溶解成100mL,即得。5.9.1.6三乙醇胺溶液(1→2),取50mL三乙醇胺,加水使溶解成100mL,即得。5.9.1.7二甲酚极指示液:取二甲酚橙0.2g,加水100mL使溶解,即得。5.9.1.8甲基红指示液:取甲基红0.1g,加氢氧化钠液(0.05mol/L)7.4mL使溶解,再加水稀释至200mL,即得。
5.9.2测定方法
5.9.2.1氧化铝
取本品0.2g,精密称定,加盐酸2mL与水50mL,煮沸使溶解,放冷,滤过,滤渣用水洗涤,洗液与滤液合并,滴加氨试液至恰好析出沉淀再滴加稀盐酸使沉淀拾好溶解,加乙酸-乙酸铵冲液(pH6.0)10mL,精密加0.05mol/L乙胺四乙酸二钠液25mL,煮沸10min,放冷,加二甲酚橙指示液1mL,用0.05mol/L锌液滴定至溶液由黄色转变为红色,即得。5.9.2.2分析结果的表述
氧化铝百分含量X,按式(1)计算:X(%)=ViG1-Vc)X0. 050 98)
式中:ci——乙二胺四乙酸二钠溶液的浓度,mol/L,c—锌标准滴定溶液的浓度,mol/LV,一消耗乙二胺四乙酸二钠溶液的体积,mL;V.消耗锌标准滴定溶液的体积,mL;X100
样品的质量g;
YY0240-1996
0.05098——与1.00mL锌标准滴定溶液(c=1.000mol/L)相当的以克表示的氧化铝的质量。5.9.2.3允许误差
本法两次平行测定的相对偏差不得超过0.3%。5.9.2.4氧化镁
取本品约0.2g,精密称定,加盐酸5mL与水50mL加热煮沸,加甲基红指示液1滴,滴加氨试液使溶液由红色变为黄色,再继续煮沸5min,乘热滤过,滤渣用氯化铵溶液(1-→50)30mL洗涤,洗液与滤液合并,放冷,加氨试液10mL,加三乙醇胺溶液(1-→2)5mL,加铬黑T指示剂少许,用0.05mol/L乙二胺四乙酸二钠标准滴定溶液滴定至溶液显纯蓝色,即得。5.9.2.5分析结果的表述
氧化镁的百分含量X按式(2)计算:X(%)=.GX0.040 31 ×100
一乙二胺四乙酸二钠标准滴定浓度,mol/L;式中:C-
V,消耗乙二胺四乙酸二钠标准滴定溶液的体积,mL;mz
样品的质量,g:
与1.0mL乙二胺四乙酸二钠标准滴定溶液(c=1.000mol/L)相当的以克表示的氧化镁的质量。
5.9.2.6允许误差
本法两次平行测定的允许相对偏差不得超过0.3%。5.9.3铝含量和镁含量的比值计算铝含量和镁含量的比值P按式(3)计算:X0.8776
式中:X,氧化铝的含量,%;
X.—一氧化镁的含量,%;
一氧化铝含量与氧化镁含量的比折算成铝含量与镁含最比的系数。0.8776
5.10二氧化硅
5.10.1试剂和溶液
5.10.1.1硫酸(GB625)。
5.10.1.2硝酸(GB626)。
5.10.1.3稀硫酸。
5.10.1.4氢氟酸(GB620)。
5.10.2测定方法
(3)
取本品约0.4g,精密称定,置瓷血中加硫酸3mL与硝酸5mL的混合液,待作用完全,暨沙浴上蒸干,放冷,加稀硫酸10mL与水100mL,煮沸使溶解,倾取上层液,用无灰滤纸滤过,残渣用倾泻法以热水洗涤几次,洗涤液一并滤过,最后将残渣移置滤纸上,用热水洗涤,将残渣连同滤纸置铂制甘中,干燥,炽灼30min,放冷,精密称定,再将残渣用水湿润,加氢氟酸3mL与硫酸3滴,蒸干,炽灼5min,放冷,精密称定,减失的重量,即为供试品中含有二氧化硅的质量。5.10.3分析结果的表述
二氧化硅的百分含量X,按式(4)计算Xg(%)mzx
式中:ms——减失重量g
一样品质量.g.
5.10.4允许误差
YY0240-1996
本法两次平行测定的允许相对偏差不得超过0.3%。5.11砷
取本品0.2g,加稀盐酸10mL,煮沸,放冷,加盐酸5mL与水适量使成23mL,按中华人民共和国药典一九九五年版二部附录56页砷盐检查法第一法测定。6检验规则
6.1本产品由生产厂的质量检验部门进行检验,生产厂应保证所有出厂的产品符合标准的要求,每批产品都应附有产品合格证。免费标准bzxz.net
6.2使用单位可按照本标准对所收到的产品进行质量检验。6.3取样量按YY/T0188.1的规定方法进行。6.4如供需双方对产品质量发生异议,可由双方协商选定仲裁单位,按本标准仲裁。7包装,标志、运输和贮存
7.1包装上应有牢固的标志。内容应包括:产品名称(标明“药用辅料”字样)、批号、产品批文号、生产日期、净重、商标、生产厂名和贮存条件。7.2包装大小可根据用户的要求而定,包装材料必须保证产品密封,防止运输中破损。7.3本品应贮存于阴凉干燥处,尤其应防潮,不要与酸类共储运。附加说明:
本标准由国家医药管理局提出。本标准由国家医药管理局天津药物研究院归口。本标准由郑州化学制药厂负责起草。本标准主要起草人才晓敏、潘锡昶。21
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
药用辅料硅酸镁铝
Pharmaceutical exciplents-
Magnesium aluminum silicate
1主题内容与适用范围
YY0240-1996
本标准规定了药用辅料硅酸镁铝的技术要求、试验方法、检验规则、包装、标志、运输和处存的要求。本标准适用于化学合成法制得的硅酸镁铝,在制药工业中用作悬浮剂、增稠剂、崩解剂、粘合剂等。2引用标准
YY/T0188.1一1995药品检验操作规程第1部分,药品检验操作通则中华人民共和国药典一九九五年版二部3产品化学名称、结构式
,化学名称:硅酸镁铝
magnesium aluminum silicate
结构式:Mg、AI、Si和O(OH)的聚合络合物,是由3个八面体铝晶格层和2个四面体硅层组成,铝被镁不同程度置换。
4技术要求
4.1性状
本品为白色或类白色片状或颗粒形粉末,无臭、无味,微有引湿性。本品在水或乙醇中不溶。
4.2项目和指标
国家医药管理局1996-01-30批准1996-07-01实施
微生物限量检查
细菌总数,个/g
大肠杆菌
碱度(消耗0.1mol/L盐酸体积),mL粘度,Pa·s
重金属,%
干燥失重,%
炽灼失重,%
镁含量和铝含量的比
二载化礁,%
碎(As).%
5试验方法
YY0240—1996
除特别注明外,试验中所用试剂为分析纯试剂,水为蒸馏水或相应纯度的水,溶液为水溶液,测定中所需溶液在未注明时,均按中华人民共和国药典一九九五年版二部附录制备。仪器设备为一般实验室仪器设备。
5.1鉴别
5.1.1试剂和溶液
5.1.1.1稀盐酸:取盐酸234mL,加水稀释至1000mL,即得,本液含盐酸应为9.5%~10.5%。5.1.1.2氨试液:取浓氮溶液400mL,加水使成1000mL,即得。5.1.1.30.1%素磺酸钠溶液:取茜素磺酸钠0.1g加水100mL使溶解,即得。5.1.1.4氢氧化钠试液:取氢氧化钠4.3g,加水使溶解成100mL,即得。5.1.1.5碘试液:可取用碘液(0.1mol/L)。5.1.2鉴别方法
5.1.2.1取本品约0.5g,加稀盐酸10mL,微温过滤,滤液照下述方法试验。取滤液5mL,加氢氧化钠试液使成碱性,即发生白色胶状沉淀,滴加0.1%茜素磺酸钠溶液数滴,沉淀即显樱红色。
5.1.2.2取滤液5mL,加氢氧化钠试液使成碱性,即发生白胶状沉淀,再加氢氧化钠试液3mL,沉淀部分溶解,滤过,沉淀用水洗净后,加碘试液即显红棕色。5.1.2.3用铂丝制成的环,蔽取磷酸铵钠的结晶微粒在火焰上熔成透明的小球后,趁热蘸取成品,熔融,二氧化硅即浮于小球的表面、放冷,即成网状结构的不透明小球。5.2微生物限量
取本品10g,加生理盐水100mL,混匀,按中华人民共和国药典一九九五年版二部附录82页微生物限度检查法检测。
取本品5g,加水100mL,混匀后滤过,滤液按中华人民共和国药典一九九五年版二部附录38页pH测定法测定。
5.4碱度
5.4.1试剂和溶液
YY0240—1996
0.1mol/L的盐酸溶液:取盐酸9mL,加水稀释至1000mL,即得。5.4.2测定方法
取本品1g,加新沸过的冷水50mL,混匀后滤过,滤液用0.1mol/L的盐酸溶液滴定至pH=4.0,消耗0.1mol/L的盐酸溶液小于10mL。5.5粘度
在20℃时,取本品5%水溶液,按中华人民共和国药典一九九五年版二部附录38页粘度测定法第二法测定(选1号转子,转速60r/min)。5.6重金属
取本品1.0g·按中华人民共和国药典一一九九五年版二部附录54页重金属检查法第一法测定。5.7千燥失重
取本品1.0g,在105℃干燥至恒重,按中华人民共和国药典九九五年版二部附录58页干燥失重测定法测定。
5.8炽灼失重
取本品1.0g,置800℃高温炉中,炽灼至恒重,按中华人民共和国药典一九九五年版二部附录59页炽灼残渣检查法测定。
5.9铝含量和镁含量的比
5.9.1试剂和溶液
5.9.1.1稀盐酸:按中华人民共和国药典一九九五年版二部附录171页试液配制。5.9.1.2乙酸-乙酸铵级冲液(pH=6.0):按中华人民共和国药典一九九五年版二部附录176页级冲液配制。
5.9.1.3乙二胺四乙酸二钠液(0.05mol/L):按中华人民共和国药典一九九五年版二部附录180页滴定液配制并稀释。
5.9.1.4锌液(0.05mol/L)。按中华人民共和国药典一九九五年版二部附录186页滴定液配制。5.9.1.5筑化铵溶液:取氟化铵10.5g,加水使溶解成100mL,即得。5.9.1.6三乙醇胺溶液(1→2),取50mL三乙醇胺,加水使溶解成100mL,即得。5.9.1.7二甲酚极指示液:取二甲酚橙0.2g,加水100mL使溶解,即得。5.9.1.8甲基红指示液:取甲基红0.1g,加氢氧化钠液(0.05mol/L)7.4mL使溶解,再加水稀释至200mL,即得。
5.9.2测定方法
5.9.2.1氧化铝
取本品0.2g,精密称定,加盐酸2mL与水50mL,煮沸使溶解,放冷,滤过,滤渣用水洗涤,洗液与滤液合并,滴加氨试液至恰好析出沉淀再滴加稀盐酸使沉淀拾好溶解,加乙酸-乙酸铵冲液(pH6.0)10mL,精密加0.05mol/L乙胺四乙酸二钠液25mL,煮沸10min,放冷,加二甲酚橙指示液1mL,用0.05mol/L锌液滴定至溶液由黄色转变为红色,即得。5.9.2.2分析结果的表述
氧化铝百分含量X,按式(1)计算:X(%)=ViG1-Vc)X0. 050 98)
式中:ci——乙二胺四乙酸二钠溶液的浓度,mol/L,c—锌标准滴定溶液的浓度,mol/LV,一消耗乙二胺四乙酸二钠溶液的体积,mL;V.消耗锌标准滴定溶液的体积,mL;X100
样品的质量g;
YY0240-1996
0.05098——与1.00mL锌标准滴定溶液(c=1.000mol/L)相当的以克表示的氧化铝的质量。5.9.2.3允许误差
本法两次平行测定的相对偏差不得超过0.3%。5.9.2.4氧化镁
取本品约0.2g,精密称定,加盐酸5mL与水50mL加热煮沸,加甲基红指示液1滴,滴加氨试液使溶液由红色变为黄色,再继续煮沸5min,乘热滤过,滤渣用氯化铵溶液(1-→50)30mL洗涤,洗液与滤液合并,放冷,加氨试液10mL,加三乙醇胺溶液(1-→2)5mL,加铬黑T指示剂少许,用0.05mol/L乙二胺四乙酸二钠标准滴定溶液滴定至溶液显纯蓝色,即得。5.9.2.5分析结果的表述
氧化镁的百分含量X按式(2)计算:X(%)=.GX0.040 31 ×100
一乙二胺四乙酸二钠标准滴定浓度,mol/L;式中:C-
V,消耗乙二胺四乙酸二钠标准滴定溶液的体积,mL;mz
样品的质量,g:
与1.0mL乙二胺四乙酸二钠标准滴定溶液(c=1.000mol/L)相当的以克表示的氧化镁的质量。
5.9.2.6允许误差
本法两次平行测定的允许相对偏差不得超过0.3%。5.9.3铝含量和镁含量的比值计算铝含量和镁含量的比值P按式(3)计算:X0.8776
式中:X,氧化铝的含量,%;
X.—一氧化镁的含量,%;
一氧化铝含量与氧化镁含量的比折算成铝含量与镁含最比的系数。0.8776
5.10二氧化硅
5.10.1试剂和溶液
5.10.1.1硫酸(GB625)。
5.10.1.2硝酸(GB626)。
5.10.1.3稀硫酸。
5.10.1.4氢氟酸(GB620)。
5.10.2测定方法
(3)
取本品约0.4g,精密称定,置瓷血中加硫酸3mL与硝酸5mL的混合液,待作用完全,暨沙浴上蒸干,放冷,加稀硫酸10mL与水100mL,煮沸使溶解,倾取上层液,用无灰滤纸滤过,残渣用倾泻法以热水洗涤几次,洗涤液一并滤过,最后将残渣移置滤纸上,用热水洗涤,将残渣连同滤纸置铂制甘中,干燥,炽灼30min,放冷,精密称定,再将残渣用水湿润,加氢氟酸3mL与硫酸3滴,蒸干,炽灼5min,放冷,精密称定,减失的重量,即为供试品中含有二氧化硅的质量。5.10.3分析结果的表述
二氧化硅的百分含量X,按式(4)计算Xg(%)mzx
式中:ms——减失重量g
一样品质量.g.
5.10.4允许误差
YY0240-1996
本法两次平行测定的允许相对偏差不得超过0.3%。5.11砷
取本品0.2g,加稀盐酸10mL,煮沸,放冷,加盐酸5mL与水适量使成23mL,按中华人民共和国药典一九九五年版二部附录56页砷盐检查法第一法测定。6检验规则
6.1本产品由生产厂的质量检验部门进行检验,生产厂应保证所有出厂的产品符合标准的要求,每批产品都应附有产品合格证。免费标准bzxz.net
6.2使用单位可按照本标准对所收到的产品进行质量检验。6.3取样量按YY/T0188.1的规定方法进行。6.4如供需双方对产品质量发生异议,可由双方协商选定仲裁单位,按本标准仲裁。7包装,标志、运输和贮存
7.1包装上应有牢固的标志。内容应包括:产品名称(标明“药用辅料”字样)、批号、产品批文号、生产日期、净重、商标、生产厂名和贮存条件。7.2包装大小可根据用户的要求而定,包装材料必须保证产品密封,防止运输中破损。7.3本品应贮存于阴凉干燥处,尤其应防潮,不要与酸类共储运。附加说明:
本标准由国家医药管理局提出。本标准由国家医药管理局天津药物研究院归口。本标准由郑州化学制药厂负责起草。本标准主要起草人才晓敏、潘锡昶。21
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
