YY 0053-2008
基本信息
标准号: YY 0053-2008
中文名称:心血管植入物和人工器官血液透析器、血液透析滤过器、血液滤过器和血液浓缩器
标准类别:医药行业标准(YY)
标准状态:现行
出版语种:简体中文
下载格式:.zip .pdf
下载大小:1721951
相关标签: 心血管 植入物 人工 器官 血液 透析器 透析 滤过 浓缩器

标准分类号
关联标准
出版信息
相关单位信息
标准简介
YY 0053-2008.Cardiovascular implants and artificial organs-Haemodialysers , haemodiafilters , haemofilters and haemoconcentrators.
YY 0053规定了在人体上使用的血液透析器,血液透析滤过器,血液滤过器和血液浓缩器的技术要求,在本文中涉及的“器件”特指上述产品。
YY 0053不适用于:
体外循环血液管路;
血浆分离器;
血液灌注装置;
:血管通路装置;
.血泵;
体外循环血液管路的压力监测器;
空气监测器;
-制备、供给和监控透析液的系统;
用于进行血液透析、血液滤过或血液透析滤过治疗的系统;
-再处理步骤和设备。
注:血液透析器,血液透析健过器和血液謔过器的体外循环血液管路的要求按照YY0267的规定。
2规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。
GB/T 1962.2-2001注射器 、注射针及其他医疗器械6%(魯尔)圆锥接头第2 部分:锁定接头(GB/T 1962. 2- -2001 ,ISO 594-2:1998 , IDT)
GB/T2828.1计数抽样检验程序第1部分:按接收质量限(AQL)检索的逐批检验抽样计划(GB/T 2828. 1-2003, ISO 2859-1:1999 ,IDT)
GB/T 14233.1医用输液 、输血.注射器具检验方法第1部分:化学分析方法
GB/T14437--1997产品质量计数--次监督抽样检验程序(适用于总体量较大的情形)
GB/T 16886.1- -2001医疗 器械生物学评价第 1部分:评价与试验(idt ISO 10993-1 :1997)
GB/T16886.4--2003医疗器械生物学评价第4部分:与血液相互作用试验选择(ISO10993-4: 2002 ,IDT)
GB/T 16886. 5- -2003医疗 器械生物学评价第 5部分:体外细胞毒性试验(ISO 10993-5:1999,IDT)
GB/T 16886. 7- -2001医疗 器械生物学评价第 7部分:环氧乙烷灭菌残留量(idt ISO 10993-5:1995)
YY 0053规定了在人体上使用的血液透析器,血液透析滤过器,血液滤过器和血液浓缩器的技术要求,在本文中涉及的“器件”特指上述产品。
YY 0053不适用于:
体外循环血液管路;
血浆分离器;
血液灌注装置;
:血管通路装置;
.血泵;
体外循环血液管路的压力监测器;
空气监测器;
-制备、供给和监控透析液的系统;
用于进行血液透析、血液滤过或血液透析滤过治疗的系统;
-再处理步骤和设备。
注:血液透析器,血液透析健过器和血液謔过器的体外循环血液管路的要求按照YY0267的规定。
2规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。
GB/T 1962.2-2001注射器 、注射针及其他医疗器械6%(魯尔)圆锥接头第2 部分:锁定接头(GB/T 1962. 2- -2001 ,ISO 594-2:1998 , IDT)
GB/T2828.1计数抽样检验程序第1部分:按接收质量限(AQL)检索的逐批检验抽样计划(GB/T 2828. 1-2003, ISO 2859-1:1999 ,IDT)
GB/T 14233.1医用输液 、输血.注射器具检验方法第1部分:化学分析方法
GB/T14437--1997产品质量计数--次监督抽样检验程序(适用于总体量较大的情形)
GB/T 16886.1- -2001医疗 器械生物学评价第 1部分:评价与试验(idt ISO 10993-1 :1997)
GB/T16886.4--2003医疗器械生物学评价第4部分:与血液相互作用试验选择(ISO10993-4: 2002 ,IDT)
GB/T 16886. 5- -2003医疗 器械生物学评价第 5部分:体外细胞毒性试验(ISO 10993-5:1999,IDT)
GB/T 16886. 7- -2001医疗 器械生物学评价第 7部分:环氧乙烷灭菌残留量(idt ISO 10993-5:1995)
标准图片预览




标准内容
ICS 11. 040. 30
中华人民共和国医药行业标准
YY 0053—2008
代替YY0053—1991
心血管植入物和人工器官
血液透析
器、血液透析滤过器、血液滤过器和血液浓缩器
Cardiovascular implants and artificial organs-Haemodialysers ,haemodiafilters, haemofilters and haemoconcentrators(IS08637:2004,M0D)
2008-04-25发布
数防伪
国家食品药品监督管理局
2009-12-01实施
中华人民共和国医药
行业标准
心血管植入物和人工器官
血液透析
器、血液透析滤过器、血液滤过器和血液浓缩器
YY0053—2008
中国标准出版社出版发行
北京复兴门外三里河北街16号
邮政编码:100045
网址 spc, nct. cn
电话:6852394668517548
中国标准出版社奏皇岛印刷厂印刷各地新华书店经销
开本 880×1230
印张 1 字数 25 千字
2008年10月第-版
2008年10月第次印刷
书号:155066-219146
定价16.元
如有印装差错由本社发行中心调换版权专有侵权必究
举报电话:(010)68533533
本标准的全部技术内容为强制性。前言
YY0053—2008
本标准修改采用ISO8637:2004《心血管植人物和人T器官血液透析器、血液透析滤过器、血液滤过器和血液浓缩器》。
本标推代替YY0053—1991《空心纤维透析器》。本标推与YY 0053—1991的差异:…一根据国际标准的适用范围,增加了血液透析滤过器、血液滤过器、血被浓缩器等产品,便本标准应用范围更广了;
根据国际标准的相关内容,增加了对多次使用血液透析器的项目指标,使本标准不局限于一次性使用的范围;
根据国际标准的内容及国家相关法规规定,增加了生物学评价的内容,按国内通行的方法与项目进行检验,适合我国国情;
一一使用性能方面将原来肌酐、尿素的下降率改为肌酐,尿素,维生素B12、磷酸喆等四种成分的清除率,增加了针对血液透析滤过器、血液滤过器、血液浓缩器的筛选系数的检测项目,针对白蛋白、肌红蛋白、菊粉等物质的筛选系数进行了规定;试验疗法中提供了多种检测方案供使用方选择,本标准的附录 A、附录B为资料性附录。本标准由国家食品药品监督管理提出。本标准出全国医用体外循环设备标雅化技术委员会归口。本标准起草单位:国家食品药品监督管理局广州医疗器械质量监督检验中心。本标准主要起草人:何晓帆、吴静标、周英。I
1范围
心血管植入物和人工器官血液透析器而液透析滤过器、血液滤过器和血液浓缩器
YY 0053—2008
本标准规定了在人体上使用的血透桁器,血液透析滤过器,血液过器和血液浓缩器的技术要求,在本文中涉及的“器件\特指上述产品。本标准不适用于:
一体外循环血液管路;
血浆分离器;
—血液灌注装置;
一血管通路装置:
--血泵;
一体外循坏血液管路的压力监测器:·空气监测器;
一制备、供给和监控透析的系统;:用于进行血液透析、血液滤过或血透析滤过治疗的系统—-再处理步骤和设备。
往:血液透析器,血被透析滤过器和血液滤过器的体外播坏血液管路的要求按照YY0267 的规定。2规范性引用文件
下列文件中的祭款遇过本标谁的引用而成为本标准的条款,凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注期的引用文件,其最新版本适用于本标准,GB/T1962.2一2001注射器、注射针及其他医疗器械6%(鲁尔)圆锥接头第2部分:锁定接头(GB/T 1962.22001.IS0 594-2:1998,IDT)安B/T2828.1计数抽样检验程序第1部分:接接收质量限(AQL)检索的逐批检验抽样计划(GB/T 2828.1-2003.IS0 2859-1:1999,IDT)GB/T 14233.1医用输液、输血,注射器具检验方法第1部分:化学分析方法GB/工14137一1997产品质量计数一次监督抽样检验程序(适用于总体量较大的情形)GB/T16886.1--2001医疗器械生物学评价第1部分:评价与试验(idtISO109931:1997)GB/T 16886.4—2003医疗器械生物学评价第4部分:与血液相互作用试验选择(ISO 109934,2002,IDT
GB/T 16886. 5 2003
3医疗器械生物学评价第5部分:体外细胞毒性试验(IS0)10993-5:1999.IDT)
GB/T16886.7—2001医疗器械生物学评价第7部分:环氧乙烷灭菌残留量(idt1SO109935:19953
GB/T16886.10—2005
(ISO10993-10:2002,IDT)
医疗器械生物学评价
第10部分:刺激与迟发型超敏反应试验1
YY0053—2008
GB/T16886.11—1997医疗器械生物学评价第11部分:全身毒性试验(idtISO10993-11:1993)YY0267—2008心血管植人物和人上器官液净化装置的体外循环血路用于医疗器械标签、标记和提供信息的符号(YY0466一2003,YY0466--2003医疗器械
ISO 15223:2000,IDT)
中华人民共和国药典
3要求
3.1生物学评价
对于产品中与血液直接或间接接触舒部分应进行生物学危害的评价。3.2无菌
产品应经过一确认过的灭菌过程使之无菌3.3无热原
产品应无热原。
3.4机械性能
3.4.1结构密合性
血液透析器、血灌透糖过器
行确认
按规定的最大跨压的15
按生产厂购的最大做!
(700 mml4))
注:本要求针对:的外部完整
3.4.2血宝密合慢
按生产厂规定最繁跨膜压的
血液透析滤过
3.4.3面液透析器
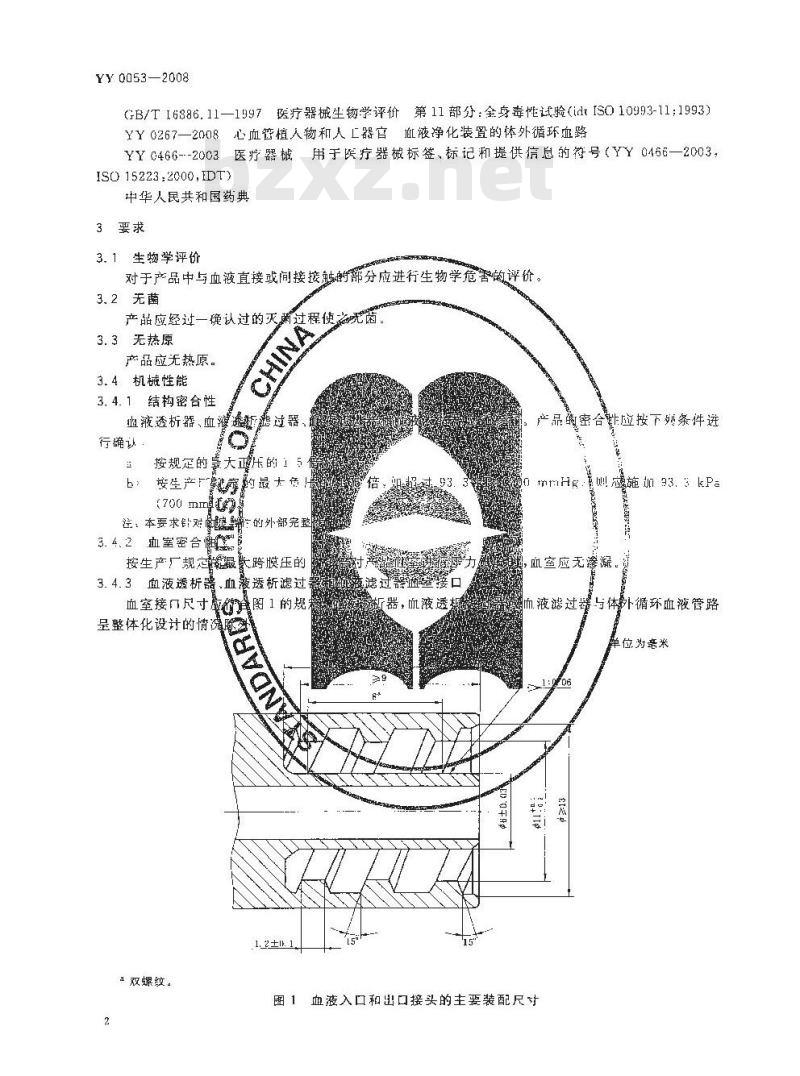
血室接口尺寸
呈整体化设计的情滤除
a双螺纹。
图1的规来
器,航液透
产品敲密合能应按下列条件进
mriH·则应施 93. kPa
血室应无渗凝。
血液滤过与体外循环血液管路
单位为旁米
图1血液入口和出口接头的主要装配尺寸3.4.4血液透析器和血液透析滤过器透析液室接口透析液室接口尺寸应符合图2的规定-6
10.2±0.1
13. 1 ±0.
17. A +83
图2透析液入口和出口的主要装配尺寸3. 4. 5血液滤过器滤过液接口
I'0+Izle
YY 0053—2008
单位为些米
血液滤过器的滤过液接口应符合图2的规定或GB1962.2中鲁尔锥度锁定接头的要求。3.4. 6血液浓缩器血液和滤过液接血液浓缩器血液和滤过液的接口应能提供“个与配套使用产品可靠的连接。3. 5使用性能
3.5.1血液透析器和血液透析滤过器的清除率对尿素、肌酐、酸盐和维生素32的清除率应符合生产厂的规定。血液及透析液的流速应覆盖生产厂规定的范围。
注:作为一个补充,可以包括KA结果。3. 5. 2血液透析滤过器,血液滤过器和血液浓缩器的筛选系数白蛋白、菊粉和肌红蛋白的筛选系数应符合生产厂的规定。试验条件应按照生产厂给定的信息。3.5.3超滤率
超滤率应符合生产厂的规定。试验应盖生产厂规定的跨膜压和血液流速的范围。3. 5. 4 血室容显
血案容量应符合生产厂的规定,试验条件应覆盖生产厂规定的跨膜压范围。如果血室没有顺应性,确定在任一个特定的跨膜压下的容量都是可以接受的。3.5.5压力降
3.5.5.1血室压力降
血塞压力降应符合生产厂的规定。3.5.5.2透析液室压力降
透析液室压力降应符合生产厂的规定。3.6有效期
按腿有效期的规定,产品的性能魔在有效期内得到保证。3
YY 00532008
3.7多次使用器件的要求
如果产晶标明是多欢使用的,则应接规定行复用处理后,进行3.1,3.5的检刻,结果应符合生产厂的规定。
注:生产厂的使用说明书中应对复用程序进行描述,其内容应符合卫生部发布的相关标准中的规定,4
试验方法
4.1总则
在新产品投入市场之前和改型产品需要重新评价时,4.5 中规定的使用性能的项目应预先确认。
试验所需的样品应在生产厂射合格品(经过妍有的量控制程序,英灭菌可使用的)中随机抽取。产品应按生产厂推荐的临床使用的要求准备好。试验应在37℃±1℃购
件下进行。当各变量关系是非线性时,应送行充分测量以便在各数据间作插值法。本章给山的法是仲裁试验方法,如可以证明其他放试验友法在精度和重现性方面具有可比性,则也可值用
图示的各个测试装
安放情况也会带来许
起的压力误差,参数
并森标明
重检测误
爵间,在非
波的除气,收集
试质的降解,试验
4.2生物学评价
血液透析器、[
析滤过器。
GB/T 16886. 1,G
生物学评价。
6886.4、GB
4.2.1环氧乙烷残留戴
按GB/T14231.
4.3无菌
得环氧乙烷雍
4.3.1按《中华人民
药典》的房
注:该方法不宜用于载
4. 3. 2适宜的灭菌方法见
4.4无热原
的不可控
欧及因杂质,藻类案
86.5,GH/T 16886.
方法进行检
实测装叠的形式、结构以及
念压差效立和或态压力下降而引此,PH值,熟、光和时间引起的测起对装置腹污染等。
接与病人的血腋接触的部分应按T16886.1等标准的规定进行
评价滤液透析器、血液透析滤过器、血液滤过器和血液浓缩器的致热原应选择适当的试验方法来
性。按中华人民共和国药典的凝起进行验,应衍合3.3的规定。4.5机械性能
4.5.1结构密合性
4. 5. 1. 1 总则
按下列试验方法进行,应欲合3.4.1的要求4.5.1.2正压试验
将器件装满脱气蒸馏水,放置于 37℃士1 ℃,除与压力测试装置连接的接口外,所有接口均应封闭。对产品施加一个生产厂规定压力 1,5 倍的正压,并封闭测试装置。10 rmin 后,记录压力值并视检查产品是否有泄漏。
4.5.1.3负压试验
将器件装满聪气恭馏水,放置于37℃土1℃,除与压力测试装置连接的接口外,所有接口均应封闭。对产品施加一个生产厂规定的压力1.5倍的负压;除非负压超过93.3kPa(700mmHg)或不作规定,此时应施加 93.3 kPa(700 mmHg)负压并封闭测试装置。10 min 后,记录压力值并日视检查产品是4
杏有泄漏。
4. 5. 2 血室密合性
按生产厂规定的最人跨膜压的1. 5倍对器件血室进行压力试验时,血室应无渗漏。4.5.3血液透析器、血滴透析滤过器和血液滤过器血室接口用通用量具或专用量其进行检验,应符合 3,4. 3 的要求。见图 1 和图 3。YY 0053—2008
单位为毫米
外圆锥
2-内圆锥S
4. 5. 4 血液透
目力检套,
血液透析滤
3.4.4的量
4. 5. 5 血液滤过
器滤过液接口
目力检查并
4.5.6血液浓缩
对器件施加 1
4. 6使用性能
4.6.1清除率
4, 6. 1. 1 总则
的要求或
和滤过落
态轴向托
要求,店
应#每35.1的要求。
按下述方法进行检测,应
4.6、1,2试验液
啮合长度
的要求。
合3.4的骤求。
使用包含一种或儿种试验物质按下列表1中列出的物质)的模拟液(带规透析液)灌注血室。使用透析液灌注血液透析器和血液透滤过器透断液望。注:根据试验步骤的条件变化,按表1列出的溶液的摩尔淤度。列出的溶液只给出一个初始浓度。表1试验液的标准摩尔浓度
尿素/(mmol/L)
肌酐/(μ/1)
磷酸盐/(nmo/L)
维生率Ba/(μtmol/L)
犀尔浓度
15-~35
5001000
1~5,调节7.4±0.1
YY 0053—2008
4. 6. 1. 3 清除率试验步骤
按图4装配试验回路。调节血液及透析液流率至稳定。确定温度、压力和超滤率平稳。在达到指定血液和透析液流率范围后,平稳运行一段时间后,收集样品。在每一个条件下均应进行超滤率的检测。进行样品分析,并按4. 6.1.4中的公式进行除率的计算。注:确定测试可靠性的可能方法是监测质量平衡误差。1
压力控制:
血液透析器:
带超滤控制的透析液供给装置;废液:
试验液;
测量血液进口侧玉力值Pmr
8-—测母血液出口侧压力值
测量透析液进口侧压力值 PDI;
测量透析液出口侧压力值PDo:
图 4测定血液透析器或血液透析滤过器清除率的开环式装置示意图4.6.1.4清除率计算公式
对于血液透析和血液透析滤过,清除率K的计算应用式(1):K:
式中:下载标准就来标准下载网
指血液透析器或血液透析滤过器血液人口的溶液浓度;指血液透析器或血液透析滤过器血液出口的溶液浓度;一指产品人口端的血液流率;
指滤过液流率(超滤率)。
CBr和cBo采用的浓度单位相间。4.6.2血液滤过器、血液透析滤过器和血液浓缩器的筛选系数4.6.2.1总则
按下列试验方法规定进行检测,应符合3.5.2的要求。4. 6.2.2试验液
首选的试验液为含蛋白浓度为60g/L土5g/L的抗凝牛而浆,使用4.6.1.2中列出的含一种或几种溶质的试验液灌注面室。4.6.2.3试验步骤
按图5装配试验回路。调节血液及滤过液流率至稳定(包括温度、流率和压力)。调节超滤率的大小,以6
YY0053—2008
覆盖生产厂给定的范围,成对收集血液样品和滤过液样品,并按4.6.2.4中的公式进行筛选系数的计算。4.6.2.4筛选系数计算公式
CRI +GBO
式中:
指筛选系数:
-指血液透析滤过器、血液滤过器或血液浓缩器血液入口的溶液浓度:指血液透析滤过器、血液滤过器或瓶较浓缩触液出口的溶液浓度;指血液透析滤过器、血液糖过器或血液浓缩器滤过液媒的溶液浓度。在公式中CBr、CBo和 Cr 采用的浓度单位相同:4.6.3超滤率
4.6.3.1试验液
试验液应为抗凝4
蛋白浓度为60g/L±5g/
不应用溶液灌注透折
辣室或憩
4.6.3.2试验步骤
按图5装配让
小,以覆盖生产厂
压力控制:
豹范围。
到大的顺
一血减透析器,血液透析滤过器,血液滤过器或血液浓缩器;3
滤过液泵:
滤过液;
试验液回收器:
血泵;
7--·—废疫;
8———测量血液出口测压力值Ppro:一测量血液进口侧压力值P
测星超滤率的大
度、流率凝压。
翠的值。
测量滤过液侧压力值
图5测定盘管型或中空纤维型血液透析器,血液透析滤过器,血液滤过器或血液浓缩器的超滤率或筛选系数的装置示意图7
YY 0053—2008
4. 6. 4 血室容量
对于空心纤维透析器,腔室的容积按透析器尺寸和成束纤维的根数计算。如果已知膜的尺寸在接触过溶藏之后发生显著变化,则应选择使用下列试验方法。作为另一种选择,用一种易于抽取但又不透过膜的溶液充满血室,测量充满血室的溶液的体积。按给定的跨膜压范围进行测量。如血室容量没有变化,则在单独一个压力下进行检测也是可以接受的4.6.5压力降
4.6.5.1血室压力降
4. 6. 5. 1. 1 总则
接下列试验方法进避行检测,应符合3.5,5.1的要求。4.6.5. 1.2试验液
用蛋白浓度为 60 g/L士5/1.的抗凝牛血浆的试验液或相近粘度的溶液充满血室。用一般透析液填充透析液室或滤过液室。4. 6.5. 1. 3试验步骤
调整而液流率,读取血室出人口压力值,计算压力降。按生产厂提供的血液流率范围重复上述检测。
对于平板型透析器,调整透析液流率,检测压力及血液流率也是必要的。4.6.5.2透析液室压力降
4. 6.5.2. 1 试验液
用一般透析液作试验液充满透析液室。用牛血浆充满血室并密封。
4. 6. 5. 2. 2试验步骤
调整透析液流率,读取透析液室出人口压力值,计算压力降。按生产厂提供的透析液流率范围重复上述检测。
对于顺应性膜的透析器,调整血液流率,按生产提供的血液流率范围检测压力值是必要的。4.7有效期
经过一段加速或实时的保存期(相当于有效期)后,对产品的无菌和机械密合性能进行检测,应符合3.6 的要求。
注:加速过程可参考ASTMF1980《StandardGuideForAcceleratedAgingof sterileMedical IDevicePackages》的规定。
4.8多次使用器件的试验方法
按规定对器件进行复用处理,按对应的试验方法进行检测,结果应符合3.7的要求。5标志
5.1产品上的标志
产品上的标志至少应有下列信息:a)生产厂名称:
b)产品名称;
c)产品规格型号或生产厂器件识别代码;d)生产批号;
c)如适用,血液及透析液流向的标识;f)最大跨膜压:
)有效期;
h)灭菌方式;
i)如适用,一次性使用的说明。注:综上所述,YYC466中的符号也可以来用。5.2单包装上的标志
可在单包装上或透过单包装看到至少应有下列信息:生产厂名称及地址;
b)产品名称;
产品规格型号或生产)器件识别代码;d
生产批号:
无菌和无热琼的声明。可有三种可能性:1)整个产品包装为无菌和无热原;2)液体通道(血液和透析被)为无菌和无热原,或;3)只是血液通道无菌和无热原;灭菌方式;
g)有效期;
一次性使用或多次使用的说明;应有“使用前请阅读使用说明书”的文宁说明;如适用,应有针对超滤控制装置的要求的说明。注:综上所述,YY 0466 中的符号也可以采用。5.3外包装上的标志
外包装上应至少有下列信息:
a)生产厂名称及地址;
b)产品名称,外包装中有产品目录及数量的描述c)产品规格型号或生产厂器件识别代码;d)
生产批号:
无菌及无热原的声明;
关于处理及贮存的警示及说明;有效期;
)如适用,应有针对超滤控制装置的要求的说明。注:综上所述,YY0466中的符号也可以采用。5.4随机文件
每个外包装至少应提供下列信息:a)生产厂名称及地址;
产品名称;
使册说明书:
随生产厂提供的使用指南(如适用)中关于配套设备的说明;2)
体外循环血液管路的连接位置(如适用),及透析管道连接的位置:YY0053-—2008
3)血液透析、血液透析滤过、血液滤过或血液浓缩操作步骤中推荐性关于预充,冲洗和终止的说明;
关于血液流向的说明(如适用):4)
5)典型的连接示意图:
关于抗凝措施和按医嘱的说明;6)
7)一些配套设备的细节要求;
d)注意事项与警告:
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国医药行业标准
YY 0053—2008
代替YY0053—1991
心血管植入物和人工器官
血液透析
器、血液透析滤过器、血液滤过器和血液浓缩器
Cardiovascular implants and artificial organs-Haemodialysers ,haemodiafilters, haemofilters and haemoconcentrators(IS08637:2004,M0D)
2008-04-25发布
数防伪
国家食品药品监督管理局
2009-12-01实施
中华人民共和国医药
行业标准
心血管植入物和人工器官
血液透析
器、血液透析滤过器、血液滤过器和血液浓缩器
YY0053—2008
中国标准出版社出版发行
北京复兴门外三里河北街16号
邮政编码:100045
网址 spc, nct. cn
电话:6852394668517548
中国标准出版社奏皇岛印刷厂印刷各地新华书店经销
开本 880×1230
印张 1 字数 25 千字
2008年10月第-版
2008年10月第次印刷
书号:155066-219146
定价16.元
如有印装差错由本社发行中心调换版权专有侵权必究
举报电话:(010)68533533
本标准的全部技术内容为强制性。前言
YY0053—2008
本标准修改采用ISO8637:2004《心血管植人物和人T器官血液透析器、血液透析滤过器、血液滤过器和血液浓缩器》。
本标推代替YY0053—1991《空心纤维透析器》。本标推与YY 0053—1991的差异:…一根据国际标准的适用范围,增加了血液透析滤过器、血液滤过器、血被浓缩器等产品,便本标准应用范围更广了;
根据国际标准的相关内容,增加了对多次使用血液透析器的项目指标,使本标准不局限于一次性使用的范围;
根据国际标准的内容及国家相关法规规定,增加了生物学评价的内容,按国内通行的方法与项目进行检验,适合我国国情;
一一使用性能方面将原来肌酐、尿素的下降率改为肌酐,尿素,维生素B12、磷酸喆等四种成分的清除率,增加了针对血液透析滤过器、血液滤过器、血液浓缩器的筛选系数的检测项目,针对白蛋白、肌红蛋白、菊粉等物质的筛选系数进行了规定;试验疗法中提供了多种检测方案供使用方选择,本标准的附录 A、附录B为资料性附录。本标准由国家食品药品监督管理提出。本标准出全国医用体外循环设备标雅化技术委员会归口。本标准起草单位:国家食品药品监督管理局广州医疗器械质量监督检验中心。本标准主要起草人:何晓帆、吴静标、周英。I
1范围
心血管植入物和人工器官血液透析器而液透析滤过器、血液滤过器和血液浓缩器
YY 0053—2008
本标准规定了在人体上使用的血透桁器,血液透析滤过器,血液过器和血液浓缩器的技术要求,在本文中涉及的“器件\特指上述产品。本标准不适用于:
一体外循环血液管路;
血浆分离器;
—血液灌注装置;
一血管通路装置:
--血泵;
一体外循坏血液管路的压力监测器:·空气监测器;
一制备、供给和监控透析的系统;:用于进行血液透析、血液滤过或血透析滤过治疗的系统—-再处理步骤和设备。
往:血液透析器,血被透析滤过器和血液滤过器的体外播坏血液管路的要求按照YY0267 的规定。2规范性引用文件
下列文件中的祭款遇过本标谁的引用而成为本标准的条款,凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注期的引用文件,其最新版本适用于本标准,GB/T1962.2一2001注射器、注射针及其他医疗器械6%(鲁尔)圆锥接头第2部分:锁定接头(GB/T 1962.22001.IS0 594-2:1998,IDT)安B/T2828.1计数抽样检验程序第1部分:接接收质量限(AQL)检索的逐批检验抽样计划(GB/T 2828.1-2003.IS0 2859-1:1999,IDT)GB/T 14233.1医用输液、输血,注射器具检验方法第1部分:化学分析方法GB/工14137一1997产品质量计数一次监督抽样检验程序(适用于总体量较大的情形)GB/T16886.1--2001医疗器械生物学评价第1部分:评价与试验(idtISO109931:1997)GB/T 16886.4—2003医疗器械生物学评价第4部分:与血液相互作用试验选择(ISO 109934,2002,IDT
GB/T 16886. 5 2003
3医疗器械生物学评价第5部分:体外细胞毒性试验(IS0)10993-5:1999.IDT)
GB/T16886.7—2001医疗器械生物学评价第7部分:环氧乙烷灭菌残留量(idt1SO109935:19953
GB/T16886.10—2005
(ISO10993-10:2002,IDT)
医疗器械生物学评价
第10部分:刺激与迟发型超敏反应试验1
YY0053—2008
GB/T16886.11—1997医疗器械生物学评价第11部分:全身毒性试验(idtISO10993-11:1993)YY0267—2008心血管植人物和人上器官液净化装置的体外循环血路用于医疗器械标签、标记和提供信息的符号(YY0466一2003,YY0466--2003医疗器械
ISO 15223:2000,IDT)
中华人民共和国药典
3要求
3.1生物学评价
对于产品中与血液直接或间接接触舒部分应进行生物学危害的评价。3.2无菌
产品应经过一确认过的灭菌过程使之无菌3.3无热原
产品应无热原。
3.4机械性能
3.4.1结构密合性
血液透析器、血灌透糖过器
行确认
按规定的最大跨压的15
按生产厂购的最大做!
(700 mml4))
注:本要求针对:的外部完整
3.4.2血宝密合慢
按生产厂规定最繁跨膜压的
血液透析滤过
3.4.3面液透析器
血室接口尺寸
呈整体化设计的情滤除
a双螺纹。
图1的规来
器,航液透
产品敲密合能应按下列条件进
mriH·则应施 93. kPa
血室应无渗凝。
血液滤过与体外循环血液管路
单位为旁米
图1血液入口和出口接头的主要装配尺寸3.4.4血液透析器和血液透析滤过器透析液室接口透析液室接口尺寸应符合图2的规定-6
10.2±0.1
13. 1 ±0.
17. A +83
图2透析液入口和出口的主要装配尺寸3. 4. 5血液滤过器滤过液接口
I'0+Izle
YY 0053—2008
单位为些米
血液滤过器的滤过液接口应符合图2的规定或GB1962.2中鲁尔锥度锁定接头的要求。3.4. 6血液浓缩器血液和滤过液接血液浓缩器血液和滤过液的接口应能提供“个与配套使用产品可靠的连接。3. 5使用性能
3.5.1血液透析器和血液透析滤过器的清除率对尿素、肌酐、酸盐和维生素32的清除率应符合生产厂的规定。血液及透析液的流速应覆盖生产厂规定的范围。
注:作为一个补充,可以包括KA结果。3. 5. 2血液透析滤过器,血液滤过器和血液浓缩器的筛选系数白蛋白、菊粉和肌红蛋白的筛选系数应符合生产厂的规定。试验条件应按照生产厂给定的信息。3.5.3超滤率
超滤率应符合生产厂的规定。试验应盖生产厂规定的跨膜压和血液流速的范围。3. 5. 4 血室容显
血案容量应符合生产厂的规定,试验条件应覆盖生产厂规定的跨膜压范围。如果血室没有顺应性,确定在任一个特定的跨膜压下的容量都是可以接受的。3.5.5压力降
3.5.5.1血室压力降
血塞压力降应符合生产厂的规定。3.5.5.2透析液室压力降
透析液室压力降应符合生产厂的规定。3.6有效期
按腿有效期的规定,产品的性能魔在有效期内得到保证。3
YY 00532008
3.7多次使用器件的要求
如果产晶标明是多欢使用的,则应接规定行复用处理后,进行3.1,3.5的检刻,结果应符合生产厂的规定。
注:生产厂的使用说明书中应对复用程序进行描述,其内容应符合卫生部发布的相关标准中的规定,4
试验方法
4.1总则
在新产品投入市场之前和改型产品需要重新评价时,4.5 中规定的使用性能的项目应预先确认。
试验所需的样品应在生产厂射合格品(经过妍有的量控制程序,英灭菌可使用的)中随机抽取。产品应按生产厂推荐的临床使用的要求准备好。试验应在37℃±1℃购
件下进行。当各变量关系是非线性时,应送行充分测量以便在各数据间作插值法。本章给山的法是仲裁试验方法,如可以证明其他放试验友法在精度和重现性方面具有可比性,则也可值用
图示的各个测试装
安放情况也会带来许
起的压力误差,参数
并森标明
重检测误
爵间,在非
波的除气,收集
试质的降解,试验
4.2生物学评价
血液透析器、[
析滤过器。
GB/T 16886. 1,G
生物学评价。
6886.4、GB
4.2.1环氧乙烷残留戴
按GB/T14231.
4.3无菌
得环氧乙烷雍
4.3.1按《中华人民
药典》的房
注:该方法不宜用于载
4. 3. 2适宜的灭菌方法见
4.4无热原
的不可控
欧及因杂质,藻类案
86.5,GH/T 16886.
方法进行检
实测装叠的形式、结构以及
念压差效立和或态压力下降而引此,PH值,熟、光和时间引起的测起对装置腹污染等。
接与病人的血腋接触的部分应按T16886.1等标准的规定进行
评价滤液透析器、血液透析滤过器、血液滤过器和血液浓缩器的致热原应选择适当的试验方法来
性。按中华人民共和国药典的凝起进行验,应衍合3.3的规定。4.5机械性能
4.5.1结构密合性
4. 5. 1. 1 总则
按下列试验方法进行,应欲合3.4.1的要求4.5.1.2正压试验
将器件装满脱气蒸馏水,放置于 37℃士1 ℃,除与压力测试装置连接的接口外,所有接口均应封闭。对产品施加一个生产厂规定压力 1,5 倍的正压,并封闭测试装置。10 rmin 后,记录压力值并视检查产品是否有泄漏。
4.5.1.3负压试验
将器件装满聪气恭馏水,放置于37℃土1℃,除与压力测试装置连接的接口外,所有接口均应封闭。对产品施加一个生产厂规定的压力1.5倍的负压;除非负压超过93.3kPa(700mmHg)或不作规定,此时应施加 93.3 kPa(700 mmHg)负压并封闭测试装置。10 min 后,记录压力值并日视检查产品是4
杏有泄漏。
4. 5. 2 血室密合性
按生产厂规定的最人跨膜压的1. 5倍对器件血室进行压力试验时,血室应无渗漏。4.5.3血液透析器、血滴透析滤过器和血液滤过器血室接口用通用量具或专用量其进行检验,应符合 3,4. 3 的要求。见图 1 和图 3。YY 0053—2008
单位为毫米
外圆锥
2-内圆锥S
4. 5. 4 血液透
目力检套,
血液透析滤
3.4.4的量
4. 5. 5 血液滤过
器滤过液接口
目力检查并
4.5.6血液浓缩
对器件施加 1
4. 6使用性能
4.6.1清除率
4, 6. 1. 1 总则
的要求或
和滤过落
态轴向托
要求,店
应#每35.1的要求。
按下述方法进行检测,应
4.6、1,2试验液
啮合长度
的要求。
合3.4的骤求。
使用包含一种或儿种试验物质按下列表1中列出的物质)的模拟液(带规透析液)灌注血室。使用透析液灌注血液透析器和血液透滤过器透断液望。注:根据试验步骤的条件变化,按表1列出的溶液的摩尔淤度。列出的溶液只给出一个初始浓度。表1试验液的标准摩尔浓度
尿素/(mmol/L)
肌酐/(μ/1)
磷酸盐/(nmo/L)
维生率Ba/(μtmol/L)
犀尔浓度
15-~35
5001000
1~5,调节7.4±0.1
YY 0053—2008
4. 6. 1. 3 清除率试验步骤
按图4装配试验回路。调节血液及透析液流率至稳定。确定温度、压力和超滤率平稳。在达到指定血液和透析液流率范围后,平稳运行一段时间后,收集样品。在每一个条件下均应进行超滤率的检测。进行样品分析,并按4. 6.1.4中的公式进行除率的计算。注:确定测试可靠性的可能方法是监测质量平衡误差。1
压力控制:
血液透析器:
带超滤控制的透析液供给装置;废液:
试验液;
测量血液进口侧玉力值Pmr
8-—测母血液出口侧压力值
测量透析液进口侧压力值 PDI;
测量透析液出口侧压力值PDo:
图 4测定血液透析器或血液透析滤过器清除率的开环式装置示意图4.6.1.4清除率计算公式
对于血液透析和血液透析滤过,清除率K的计算应用式(1):K:
式中:下载标准就来标准下载网
指血液透析器或血液透析滤过器血液人口的溶液浓度;指血液透析器或血液透析滤过器血液出口的溶液浓度;一指产品人口端的血液流率;
指滤过液流率(超滤率)。
CBr和cBo采用的浓度单位相间。4.6.2血液滤过器、血液透析滤过器和血液浓缩器的筛选系数4.6.2.1总则
按下列试验方法规定进行检测,应符合3.5.2的要求。4. 6.2.2试验液
首选的试验液为含蛋白浓度为60g/L土5g/L的抗凝牛而浆,使用4.6.1.2中列出的含一种或几种溶质的试验液灌注面室。4.6.2.3试验步骤
按图5装配试验回路。调节血液及滤过液流率至稳定(包括温度、流率和压力)。调节超滤率的大小,以6
YY0053—2008
覆盖生产厂给定的范围,成对收集血液样品和滤过液样品,并按4.6.2.4中的公式进行筛选系数的计算。4.6.2.4筛选系数计算公式
CRI +GBO
式中:
指筛选系数:
-指血液透析滤过器、血液滤过器或血液浓缩器血液入口的溶液浓度:指血液透析滤过器、血液滤过器或瓶较浓缩触液出口的溶液浓度;指血液透析滤过器、血液糖过器或血液浓缩器滤过液媒的溶液浓度。在公式中CBr、CBo和 Cr 采用的浓度单位相同:4.6.3超滤率
4.6.3.1试验液
试验液应为抗凝4
蛋白浓度为60g/L±5g/
不应用溶液灌注透折
辣室或憩
4.6.3.2试验步骤
按图5装配让
小,以覆盖生产厂
压力控制:
豹范围。
到大的顺
一血减透析器,血液透析滤过器,血液滤过器或血液浓缩器;3
滤过液泵:
滤过液;
试验液回收器:
血泵;
7--·—废疫;
8———测量血液出口测压力值Ppro:一测量血液进口侧压力值P
测星超滤率的大
度、流率凝压。
翠的值。
测量滤过液侧压力值
图5测定盘管型或中空纤维型血液透析器,血液透析滤过器,血液滤过器或血液浓缩器的超滤率或筛选系数的装置示意图7
YY 0053—2008
4. 6. 4 血室容量
对于空心纤维透析器,腔室的容积按透析器尺寸和成束纤维的根数计算。如果已知膜的尺寸在接触过溶藏之后发生显著变化,则应选择使用下列试验方法。作为另一种选择,用一种易于抽取但又不透过膜的溶液充满血室,测量充满血室的溶液的体积。按给定的跨膜压范围进行测量。如血室容量没有变化,则在单独一个压力下进行检测也是可以接受的4.6.5压力降
4.6.5.1血室压力降
4. 6. 5. 1. 1 总则
接下列试验方法进避行检测,应符合3.5,5.1的要求。4.6.5. 1.2试验液
用蛋白浓度为 60 g/L士5/1.的抗凝牛血浆的试验液或相近粘度的溶液充满血室。用一般透析液填充透析液室或滤过液室。4. 6.5. 1. 3试验步骤
调整而液流率,读取血室出人口压力值,计算压力降。按生产厂提供的血液流率范围重复上述检测。
对于平板型透析器,调整透析液流率,检测压力及血液流率也是必要的。4.6.5.2透析液室压力降
4. 6.5.2. 1 试验液
用一般透析液作试验液充满透析液室。用牛血浆充满血室并密封。
4. 6. 5. 2. 2试验步骤
调整透析液流率,读取透析液室出人口压力值,计算压力降。按生产厂提供的透析液流率范围重复上述检测。
对于顺应性膜的透析器,调整血液流率,按生产提供的血液流率范围检测压力值是必要的。4.7有效期
经过一段加速或实时的保存期(相当于有效期)后,对产品的无菌和机械密合性能进行检测,应符合3.6 的要求。
注:加速过程可参考ASTMF1980《StandardGuideForAcceleratedAgingof sterileMedical IDevicePackages》的规定。
4.8多次使用器件的试验方法
按规定对器件进行复用处理,按对应的试验方法进行检测,结果应符合3.7的要求。5标志
5.1产品上的标志
产品上的标志至少应有下列信息:a)生产厂名称:
b)产品名称;
c)产品规格型号或生产厂器件识别代码;d)生产批号;
c)如适用,血液及透析液流向的标识;f)最大跨膜压:
)有效期;
h)灭菌方式;
i)如适用,一次性使用的说明。注:综上所述,YYC466中的符号也可以来用。5.2单包装上的标志
可在单包装上或透过单包装看到至少应有下列信息:生产厂名称及地址;
b)产品名称;
产品规格型号或生产)器件识别代码;d
生产批号:
无菌和无热琼的声明。可有三种可能性:1)整个产品包装为无菌和无热原;2)液体通道(血液和透析被)为无菌和无热原,或;3)只是血液通道无菌和无热原;灭菌方式;
g)有效期;
一次性使用或多次使用的说明;应有“使用前请阅读使用说明书”的文宁说明;如适用,应有针对超滤控制装置的要求的说明。注:综上所述,YY 0466 中的符号也可以采用。5.3外包装上的标志
外包装上应至少有下列信息:
a)生产厂名称及地址;
b)产品名称,外包装中有产品目录及数量的描述c)产品规格型号或生产厂器件识别代码;d)
生产批号:
无菌及无热原的声明;
关于处理及贮存的警示及说明;有效期;
)如适用,应有针对超滤控制装置的要求的说明。注:综上所述,YY0466中的符号也可以采用。5.4随机文件
每个外包装至少应提供下列信息:a)生产厂名称及地址;
产品名称;
使册说明书:
随生产厂提供的使用指南(如适用)中关于配套设备的说明;2)
体外循环血液管路的连接位置(如适用),及透析管道连接的位置:YY0053-—2008
3)血液透析、血液透析滤过、血液滤过或血液浓缩操作步骤中推荐性关于预充,冲洗和终止的说明;
关于血液流向的说明(如适用):4)
5)典型的连接示意图:
关于抗凝措施和按医嘱的说明;6)
7)一些配套设备的细节要求;
d)注意事项与警告:
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。