YY/T 0114-2008
基本信息
标准号: YY/T 0114-2008
中文名称:医用输液、输血、注射器具用聚乙烯专用料
标准类别:医药行业标准(YY)
标准状态:现行
出版语种:简体中文
下载格式:.zip .pdf
下载大小:885503

标准分类号
关联标准
出版信息
相关单位信息
标准简介
YY/T 0114-2008.Polyethylene material for manufacture of infusion,transfusion and injection
equipments for medical use.
YY/T 0114规定了医用输液、输血、注射器具用聚乙烯专用料的要求、试验方法、检验规则、标志、包装、运输和贮存。
YY/T 0114适用于医用输液、输血、注射器具用聚乙烯专用料(以下简称“医用聚乙烯专用料")。
2规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勒误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。
GB/T 1033- 1986 塑料 密度和相对密度试验方法(eqv ISO/DIS 1183:1984)
GB/T 1040.1-2006塑料拉伸性 能的测定第 1部分:总则(ISO 527-1:1993,IDT)
GB/T 1040.2- 2006塑料拉伸性能的测定 第2部分:模塑和挤塑塑料的试验条件(ISO 527-2.1993,IDT)
GB/T 1250- -1989极限数 值的表示方法和判定方法
GB/T 1843--1996塑料 悬臂梁冲击试验方法(eqv ISO 180 :1993)
GB/T 1845.2- 2006 塑料聚乙烯(PE)模塑 和挤出材料第 2部分:试样制备和性能测定
GB/T 2547塑料 树脂取样方法
GB/T 2918- 1998 塑料 试样状态调节和试验的标准环境(idt ISO 291 :1997)
GB/T3682-2000热塑性塑料熔体质量流动速率和熔体体积流动速率的测定(idtISO1133:1997)
GB/T 9341- 2000 塑料 弯曲性能试验方法(idt ISO 178:1993)
GB/T 9352- 1988 热塑 性塑料压塑试样的制备(neq ISO 293:1986)
GB/T 14233. 1- -1998医用输液 、输血、注射器具检验方法第1部分:化学分析方法:
GB/T 14233. 2- -2005医用输 液、输血.注射器具检验方法第2部分:生物学试验方法
GB/T 16886. 1医疗器械生物 学评价第1部分:评价与试验(GB/T 16886. 1--2001,idt ISO 10993-1 :1997)
GB/T 17037.1- -1997热 塑性塑料材料注塑试样的制备第 1部分:一般原理及多用途试样和长条试样的制备
YY 0466医疗器械 用于医疗器械标签、标记和提供信息的符号(YY 0466- -2003, IsO 15223.2000,IDT)
SH/T 1541- -2006 热 塑性塑料颗粒外观试验方法
3要求
3.1颗粒外观
equipments for medical use.
YY/T 0114规定了医用输液、输血、注射器具用聚乙烯专用料的要求、试验方法、检验规则、标志、包装、运输和贮存。
YY/T 0114适用于医用输液、输血、注射器具用聚乙烯专用料(以下简称“医用聚乙烯专用料")。
2规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勒误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。
GB/T 1033- 1986 塑料 密度和相对密度试验方法(eqv ISO/DIS 1183:1984)
GB/T 1040.1-2006塑料拉伸性 能的测定第 1部分:总则(ISO 527-1:1993,IDT)
GB/T 1040.2- 2006塑料拉伸性能的测定 第2部分:模塑和挤塑塑料的试验条件(ISO 527-2.1993,IDT)
GB/T 1250- -1989极限数 值的表示方法和判定方法
GB/T 1843--1996塑料 悬臂梁冲击试验方法(eqv ISO 180 :1993)
GB/T 1845.2- 2006 塑料聚乙烯(PE)模塑 和挤出材料第 2部分:试样制备和性能测定
GB/T 2547塑料 树脂取样方法
GB/T 2918- 1998 塑料 试样状态调节和试验的标准环境(idt ISO 291 :1997)
GB/T3682-2000热塑性塑料熔体质量流动速率和熔体体积流动速率的测定(idtISO1133:1997)
GB/T 9341- 2000 塑料 弯曲性能试验方法(idt ISO 178:1993)
GB/T 9352- 1988 热塑 性塑料压塑试样的制备(neq ISO 293:1986)
GB/T 14233. 1- -1998医用输液 、输血、注射器具检验方法第1部分:化学分析方法:
GB/T 14233. 2- -2005医用输 液、输血.注射器具检验方法第2部分:生物学试验方法
GB/T 16886. 1医疗器械生物 学评价第1部分:评价与试验(GB/T 16886. 1--2001,idt ISO 10993-1 :1997)
GB/T 17037.1- -1997热 塑性塑料材料注塑试样的制备第 1部分:一般原理及多用途试样和长条试样的制备
YY 0466医疗器械 用于医疗器械标签、标记和提供信息的符号(YY 0466- -2003, IsO 15223.2000,IDT)
SH/T 1541- -2006 热 塑性塑料颗粒外观试验方法
3要求
3.1颗粒外观
标准图片预览




标准内容
ICS 11. 040. 20
中华人民共和国医药行业标准
YY/T 0114——2008
代替YY0114—1993
医用输液、输血、注射器具
用聚乙烯专用料
Polyethylene material for manufacturc of infusion , transfusion and injectioneguipments for nedical use
2008-10-17 发布
国家食品药品监督管理局
2010-01-01实施
本标准代替YY0114—1993医用输液、输血、注射器具用聚乙烯专用料》。本标准与YY01141993相比主要差异如下:由强制性标准调整为推荐性标准;增加了“颗粒外观”要求;
修改了“熔体质量流动速率”要求:修改了“悬臂梁缺口冲击强度”单位和要求;增加了“紫外吸光度”要求;
修改了“重金属含量”要求。
本标准由全国医用输液器具标准化技术委员会提山。本标出国家食品药品监督管理局济南医疗器械质量监督检验中心归口。YY/T 0114—2008
本标准起草单位:中国石化股份有限公司齐音分公司研究院、山东省医疗器械产品质量检验中心,本标耀主要起草人:刘少成、张广明、程志凌、苑东兴、李晶、刘莉莉。本标准十1993年4月首次发布。
1范围
医用输液、输血、注射器具
用聚乙烯专用料
YY/T 0114—2008
本标准规定了医用输液、输血、注射器具用聚乙烯专用料的要求、试验方法、检验规测、标志、包装、运输和存。
本标推适用于医用输液、输血、注射器具用案乙烯专用料(以下简称“医用乙烯专用料”)。2规范性引用文件
下列文件中的条款通过本标推的引用而成为本标准的紊款。凡是注日期的引用文件,其随后所准的修收单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励报据本标准达成协议的各方研究是否的使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。GB/T1033—1986塑料密度和相对密度试验力法(eqVIS0/DIS1183:1984)GB/T1040.1—2006塑料拉仲性能的测定第1部分:总则(ISO527-1:1993,IDT)GB/T1040.22006塑料拉伸性能的测定第2部分:模塑和挤塑塑料的试验条件(1SO527-2:1993IT
极限数值的表示方法和判定方法GB/T 1250-1989
GB/T1843—1996塑料悬臂梁冲击试验方法(eqISO180:1993)GB/T1845.2一2006塑料聚乙烯(PE)模塑和挤出材料第2部分:试样制备和性能测定GB/T2547塑料树脂取样方法wwW.bzxz.Net
GB/T2918—1998塑料试样状态调节和试验的标准环境(idtISO291:1997)GB/T3682—2000
热塑性塑料熔体质量流动速率和熔体体积流动速率的测定(idtISO1133:1997)GB/T 9341—2000
塑料弯曲性能试验方法(idtISQ178:1993)GB/T9352—1988热塑性塑料压塑试样的制备(neqIS0293:1586)GB/T 14233.11998
医用输液、输面、注射器具检验方法第1部分:化学分析方法GB/I 14233.2:2005医用输液输血、注射器具检验方法第2部分:生物学试验方法GB/T 16886. 1
医疗器械生学评价第1部分:评价与试验(CB/T16886.1--2001,idt 1SO 10993-1:1997)
GB/T17037.1—1997热塑性塑料材料注塑试样的制备第1部分:-般原理及多用途试样和长条试样的制备
YY0466医疗器械用于医疗器械标签、标记和提供信息的符号(YY0466—2003,ISO15223:2000,DT)
SH/T15412006热塑性塑料颗粒外观试验方法3要求
3.1颗粒外观
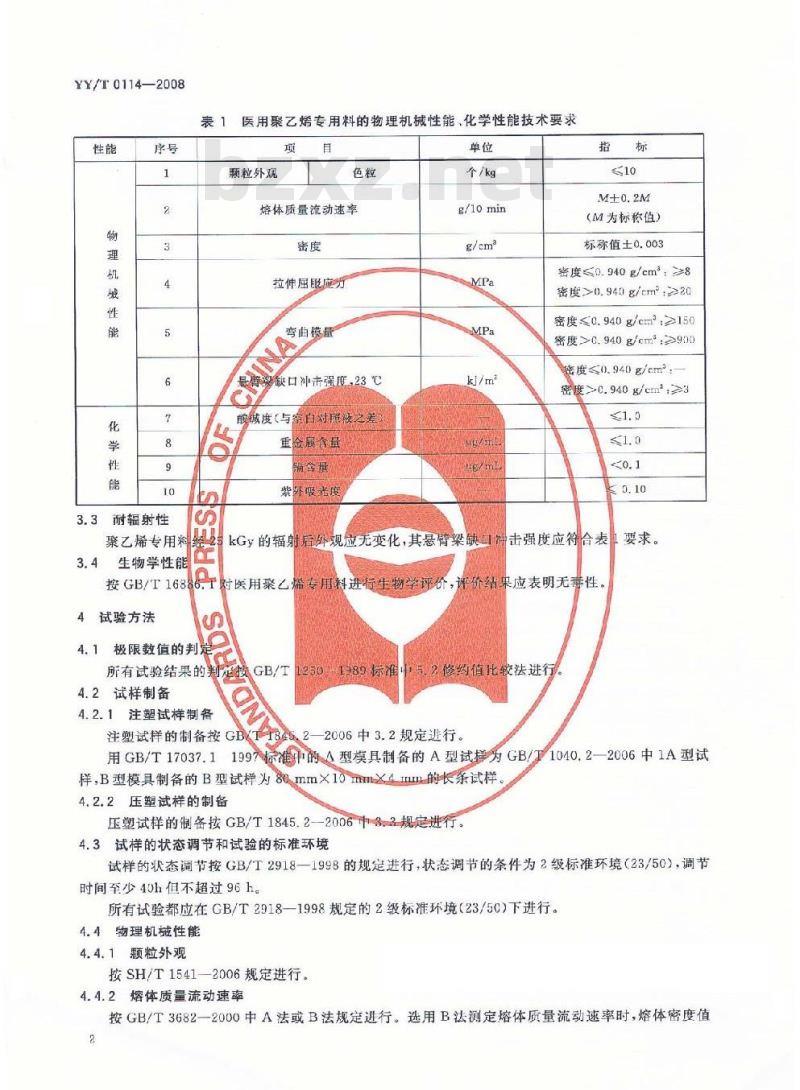
医用聚艺烯专用料为本色颗粒,3.2医用暴乙烯专用料的物理机械性能、化学性能医用聚乙烯专用料的物理机械性能,化学性能见表1。YY/T0114—2008
3.3耐辐射性
聚乙烯专用料
生物学性能
表1医用聚乙烯专用料的物理机械性能、化学性能技术要求项
颗粒外观
熔体质量流动速率
拉伸屈服应力
弯曲模量
缺口冲击强度,23℃
堂白对照液之差
酸减度(与密
重金履各量
编备量
紫外吸光度
个/kg
g/10min
(M为标称值)
标称值土0.003
密度≤0.940g/cm2≥8
密度>0.940g/cm:≥20
密度≤0.940g/cm:≥150
密度>0.940g/cm:>900
密度<0.940g/cm*:
密度>0.940g/cm2,≥3
kGy的辐射后外观应无变化,其悬背梁缺口游击强度应符合表要求。
按GB/T16886.1对医用聚乙烯专用料进行生物学评价,评价结果应表明无毒性。试验方法
极限数值的判定
所有试验结果的判定安GB/T
1250-1989标准中52修约值比较法进行4.2试样制备
注塑试样制备
注塑试样的制备按GBA8452—2006中3.2规定进行。用GB/T17037.11997标准中的A型模具制备的A型试样为GB/T1040.2—2006中1A型试样,B型模具制备的B型试样为80mm×10mmX4mm的长条试样4.2.2压塑试样的制备
压塑试样的制备按GB/T1845.2-2006中-3.3规定进行。4.3试样的状态调节和试验的标准环境试样的状态调节按GB/T2918一1998的规定进行,状态调节的条件为2级标准环境(23/50),调节时间至少40h但不超过96h。
所有试验都应在GB/T2918—1998规定的2级标准环境(23/50)下进行。4.4物理机械性能
4.4.1颗粒外观
按SH/T1541—2006规定进行。
4.4.2熔体质量流动速率
按GB/T3682一2000中A法或B法规定进行。选用B法测定熔体质量流动速率时,熔体密度值2
YY/T0114—2008
为0.7636g/cm。试验条件为D(温度:190℃、负荷:2.16kg)或G(温度:190C、负荷:21.6kg)。注:试验前,使用相应有证标准样品可保证试验数据的可靠性。4.4.3密度
按GB/T1845.2一2006规定,在注塑或压塑样试样的中问部分截取,在常压下经200mL蒸馏水煮沸30min,待自然冷却至室温后进行测试。按GB/T1033—1986中D法进行。
4.4.4拉伸屈服应力
试样的制备按照4.2规定进行注塑或压塑注塑采用GB/T17037.1—1997标准中的A型模具试样。压塑采用机加工制备GB/T1040.22006中的1B型试样。
试样的状态调节按4.
3规定进行
测试按GB/T1040
4.4.5弯曲模量
试样的制备按照
注塑采用GB
5规定进行,试验速度为50mm/mlg42现定进行准塑或压塑
1997标准中的B型模具制备80mmx10mmx4mm的长条试样。压17087.1
mx10mmx4mm的长务试样。
塑采用机加工制备
试样的状态调节摄4.3规定进行。测试按GB
2000执定进行
试验速度为2mm/min
神击强度
4.4.6悬臂染
图进行生级为
试样按照
1h~4h内加工
冲击试验的试样
缺口类型为
试群的状态调节按4.3规定进行。测试接GBU
4.5化学性能
4.5.1试样制备
96规定的1型。样条应在注塑后的1843-1996中规定的A型。加工缺口后的样条为悬臂梁缺口-1996规定进行测试。
试样按4.2.2规讲行压塑战样厚应为(05土.05)mm4.5.2供试液制备
将4.5.1制备的试释度B/T14233.1-1998中4.3规定的方法3制备供试液及空白对照液。4.5.3酸碱度
取按4.5.2制备的供试液和对照液,按GB/T14233.1-1998中5A.1进行。4.5.4重金属含量
取按4.5.2制备的供试液,按GB/T14233.1—1998中5.6.1进行。钢含量测定按GB/T14233.1—1998中5.9.1进行。
4.5.5紫外吸光度
取4.5.2制备的供试液,按GB/T14233.1-1998中5.7规定在220nm~350nm波长范围内进行。
4.6耐辐射性能
试样按4.2规定进行注塑或压塑,然后按4.4.6规定加工缺口。使试样经受25kGy的辐射剂量。辐射两周后按4.4.6进行试验。4.7生物学性能
按GB/T16886或GB/T14233.2规定的生物学试验方法进行。注:GB/T16886系列试验方法标准见参考文献。YY/T 114-2008
5检验规则
5.1组批规则与抽样方案
5.1.1组批规则
医用聚乙烯专用料应成批提交检验,检验分为型式检验和出厂检验。以同一生产线上、相同原料、相同工艺所生产的同·牌号的户品组批,或以一个料仓经掺合后的产品或一定生产周期的产品为批。5.1.2抽样方案
生产厂可在料仓的取样口抽样。包装后的产品应按GB/T2547规定进行。5.2型式检验
5.2.1在下列情况下应进行型式检验:a)新产品投产时;
b)T艺有重大改变时;
连续生产中每年不少于一钦;
停产半年以上恢复生产时;
c)合同规定要求时。
5.2.2第3章规定的所有项目为型式检验项民。生物学相容性评价应按GB/T16886.1规定的基本原则进行。
5.2.3全部检验项符合第3章中规定时判定合格,若有任一项不合格时判定该批产品型式检验不合格。
5.3出厂检验
出厂检验项目包括:密度、熔体质量流动速率,拉伸屈服应力、弯曲模量、悬臀梁缺口冲击强度和化学性能。
若化学性能有任一项不合格时判该批产品不合格。物理机械检验结果有不合格时,应重新自该批产品巾取双倍来样单元数,对不合格项目进行复验,复验结果仍不合格,则判定该批产品为不含格品。6标志
医用乙烯专用料产品外包装上标志应包括下列内容:a)产品名称、厂名、址:
b)产品牌号、批号;
标准号:
d)净重(kg);
e)“怕晒”“怕雨”等符合YY0466的标志或文字。7包装、贮存
7.1包装
医用聚乙烯专用料应至少采用双层包装,包装应保证在产品运输、贮存时不被污染,7.2贮存
医用聚乙烯专用料应贮存在通风、干爆、清洁并保持有良好消防设施的仓库内。贮存时远离热源,并防止阳光直射。
参考文献
YY/T 0114—2008
[1GB/T16886.32008医疗器械生物学评价第3部分:遗传毒性致癌性和生殖毒性试验(1SO 10993-3:2003,IDT)
[2′GB/T 16886. 4—2003
医疗器械生物学评价第4部分:与血液相互作用试验选择(ISO 10993-4:2002,IDT)
[3]GB/T 16886.5—2003F
医疗器械生物学评价第5部分:体外细胞毒性试验(ISO10993-5:1999,IDT)
GB/T 16886. 6—1997
医疗器械生物学评价第6部分:植人后局部反应试验(ISU10993-6:1994,[4
[57GB/T 16886.9—2001
(ISO 10993-9:1999,DT)
[6GB/T 16886.10—2005
(ISO 10993-10:2002,IDT)
[7] GB/T 16886. 11-1997
医疗器械生物学评价第9部分:潜在降解产物的定性和定量框架医疗器械生物学评价第10部分:刺激与迟发型超敏反应试验医疗器械生物学评价第11部分:全身毒性试验(IS0)10993-11:1993,[8]GB/T 16886. 12
(ISO 10993-12:2002,IDT)
医疗器械生物学评价
第12部分:样品制备与参照样品[97 GB/T 16886,13—2001
1医疗器械生物学评价第13部分:聚合物医疗器械的降解产物的定性与定量(ISO10993-13:1998,IDT)[10]GB/T16886.16--2003医疗器械生物学评价第16部分:降解产物和可溶出物的毒带动力学研究段计(ISO10993-16:1997,IDT)[II]GB/T 16886. 17--2005
5医疗器械生物学评价第17部分:可沥滤物允许限量的建立(ISO 10993-17:2002,DT)
YY/T0114-2008
中华人民共和国医药
行业标准
医用输液、输血,注射器具
用聚乙烯专用料
YY/T 0114-2008
中国标准出版社出版发行
北京复兴门外-里河北街16号
部酸编码:100045
网址www,spe,net.c
电话:6852394668517548
中国标准出版社秦皇岛印刷厂印刷各地新华书店经销
开本880×12301/16
印张 0.75
字数 11千字
2008年12月第一版
2008年12月第一次印刷
书号:155066·2-19301
定价14.00元
由本社发行中心调换
如有印装差错
版权专有侵权必究
举报电话:(010)68533533
8002110 /
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国医药行业标准
YY/T 0114——2008
代替YY0114—1993
医用输液、输血、注射器具
用聚乙烯专用料
Polyethylene material for manufacturc of infusion , transfusion and injectioneguipments for nedical use
2008-10-17 发布
国家食品药品监督管理局
2010-01-01实施
本标准代替YY0114—1993医用输液、输血、注射器具用聚乙烯专用料》。本标准与YY01141993相比主要差异如下:由强制性标准调整为推荐性标准;增加了“颗粒外观”要求;
修改了“熔体质量流动速率”要求:修改了“悬臂梁缺口冲击强度”单位和要求;增加了“紫外吸光度”要求;
修改了“重金属含量”要求。
本标准由全国医用输液器具标准化技术委员会提山。本标出国家食品药品监督管理局济南医疗器械质量监督检验中心归口。YY/T 0114—2008
本标准起草单位:中国石化股份有限公司齐音分公司研究院、山东省医疗器械产品质量检验中心,本标耀主要起草人:刘少成、张广明、程志凌、苑东兴、李晶、刘莉莉。本标准十1993年4月首次发布。
1范围
医用输液、输血、注射器具
用聚乙烯专用料
YY/T 0114—2008
本标准规定了医用输液、输血、注射器具用聚乙烯专用料的要求、试验方法、检验规测、标志、包装、运输和存。
本标推适用于医用输液、输血、注射器具用案乙烯专用料(以下简称“医用乙烯专用料”)。2规范性引用文件
下列文件中的条款通过本标推的引用而成为本标准的紊款。凡是注日期的引用文件,其随后所准的修收单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励报据本标准达成协议的各方研究是否的使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。GB/T1033—1986塑料密度和相对密度试验力法(eqVIS0/DIS1183:1984)GB/T1040.1—2006塑料拉仲性能的测定第1部分:总则(ISO527-1:1993,IDT)GB/T1040.22006塑料拉伸性能的测定第2部分:模塑和挤塑塑料的试验条件(1SO527-2:1993IT
极限数值的表示方法和判定方法GB/T 1250-1989
GB/T1843—1996塑料悬臂梁冲击试验方法(eqISO180:1993)GB/T1845.2一2006塑料聚乙烯(PE)模塑和挤出材料第2部分:试样制备和性能测定GB/T2547塑料树脂取样方法wwW.bzxz.Net
GB/T2918—1998塑料试样状态调节和试验的标准环境(idtISO291:1997)GB/T3682—2000
热塑性塑料熔体质量流动速率和熔体体积流动速率的测定(idtISO1133:1997)GB/T 9341—2000
塑料弯曲性能试验方法(idtISQ178:1993)GB/T9352—1988热塑性塑料压塑试样的制备(neqIS0293:1586)GB/T 14233.11998
医用输液、输面、注射器具检验方法第1部分:化学分析方法GB/I 14233.2:2005医用输液输血、注射器具检验方法第2部分:生物学试验方法GB/T 16886. 1
医疗器械生学评价第1部分:评价与试验(CB/T16886.1--2001,idt 1SO 10993-1:1997)
GB/T17037.1—1997热塑性塑料材料注塑试样的制备第1部分:-般原理及多用途试样和长条试样的制备
YY0466医疗器械用于医疗器械标签、标记和提供信息的符号(YY0466—2003,ISO15223:2000,DT)
SH/T15412006热塑性塑料颗粒外观试验方法3要求
3.1颗粒外观
医用聚艺烯专用料为本色颗粒,3.2医用暴乙烯专用料的物理机械性能、化学性能医用聚乙烯专用料的物理机械性能,化学性能见表1。YY/T0114—2008
3.3耐辐射性
聚乙烯专用料
生物学性能
表1医用聚乙烯专用料的物理机械性能、化学性能技术要求项
颗粒外观
熔体质量流动速率
拉伸屈服应力
弯曲模量
缺口冲击强度,23℃
堂白对照液之差
酸减度(与密
重金履各量
编备量
紫外吸光度
个/kg
g/10min
(M为标称值)
标称值土0.003
密度≤0.940g/cm2≥8
密度>0.940g/cm:≥20
密度≤0.940g/cm:≥150
密度>0.940g/cm:>900
密度<0.940g/cm*:
密度>0.940g/cm2,≥3
kGy的辐射后外观应无变化,其悬背梁缺口游击强度应符合表要求。
按GB/T16886.1对医用聚乙烯专用料进行生物学评价,评价结果应表明无毒性。试验方法
极限数值的判定
所有试验结果的判定安GB/T
1250-1989标准中52修约值比较法进行4.2试样制备
注塑试样制备
注塑试样的制备按GBA8452—2006中3.2规定进行。用GB/T17037.11997标准中的A型模具制备的A型试样为GB/T1040.2—2006中1A型试样,B型模具制备的B型试样为80mm×10mmX4mm的长条试样4.2.2压塑试样的制备
压塑试样的制备按GB/T1845.2-2006中-3.3规定进行。4.3试样的状态调节和试验的标准环境试样的状态调节按GB/T2918一1998的规定进行,状态调节的条件为2级标准环境(23/50),调节时间至少40h但不超过96h。
所有试验都应在GB/T2918—1998规定的2级标准环境(23/50)下进行。4.4物理机械性能
4.4.1颗粒外观
按SH/T1541—2006规定进行。
4.4.2熔体质量流动速率
按GB/T3682一2000中A法或B法规定进行。选用B法测定熔体质量流动速率时,熔体密度值2
YY/T0114—2008
为0.7636g/cm。试验条件为D(温度:190℃、负荷:2.16kg)或G(温度:190C、负荷:21.6kg)。注:试验前,使用相应有证标准样品可保证试验数据的可靠性。4.4.3密度
按GB/T1845.2一2006规定,在注塑或压塑样试样的中问部分截取,在常压下经200mL蒸馏水煮沸30min,待自然冷却至室温后进行测试。按GB/T1033—1986中D法进行。
4.4.4拉伸屈服应力
试样的制备按照4.2规定进行注塑或压塑注塑采用GB/T17037.1—1997标准中的A型模具试样。压塑采用机加工制备GB/T1040.22006中的1B型试样。
试样的状态调节按4.
3规定进行
测试按GB/T1040
4.4.5弯曲模量
试样的制备按照
注塑采用GB
5规定进行,试验速度为50mm/mlg42现定进行准塑或压塑
1997标准中的B型模具制备80mmx10mmx4mm的长条试样。压17087.1
mx10mmx4mm的长务试样。
塑采用机加工制备
试样的状态调节摄4.3规定进行。测试按GB
2000执定进行
试验速度为2mm/min
神击强度
4.4.6悬臂染
图进行生级为
试样按照
1h~4h内加工
冲击试验的试样
缺口类型为
试群的状态调节按4.3规定进行。测试接GBU
4.5化学性能
4.5.1试样制备
96规定的1型。样条应在注塑后的1843-1996中规定的A型。加工缺口后的样条为悬臂梁缺口-1996规定进行测试。
试样按4.2.2规讲行压塑战样厚应为(05土.05)mm4.5.2供试液制备
将4.5.1制备的试释度B/T14233.1-1998中4.3规定的方法3制备供试液及空白对照液。4.5.3酸碱度
取按4.5.2制备的供试液和对照液,按GB/T14233.1-1998中5A.1进行。4.5.4重金属含量
取按4.5.2制备的供试液,按GB/T14233.1—1998中5.6.1进行。钢含量测定按GB/T14233.1—1998中5.9.1进行。
4.5.5紫外吸光度
取4.5.2制备的供试液,按GB/T14233.1-1998中5.7规定在220nm~350nm波长范围内进行。
4.6耐辐射性能
试样按4.2规定进行注塑或压塑,然后按4.4.6规定加工缺口。使试样经受25kGy的辐射剂量。辐射两周后按4.4.6进行试验。4.7生物学性能
按GB/T16886或GB/T14233.2规定的生物学试验方法进行。注:GB/T16886系列试验方法标准见参考文献。YY/T 114-2008
5检验规则
5.1组批规则与抽样方案
5.1.1组批规则
医用聚乙烯专用料应成批提交检验,检验分为型式检验和出厂检验。以同一生产线上、相同原料、相同工艺所生产的同·牌号的户品组批,或以一个料仓经掺合后的产品或一定生产周期的产品为批。5.1.2抽样方案
生产厂可在料仓的取样口抽样。包装后的产品应按GB/T2547规定进行。5.2型式检验
5.2.1在下列情况下应进行型式检验:a)新产品投产时;
b)T艺有重大改变时;
连续生产中每年不少于一钦;
停产半年以上恢复生产时;
c)合同规定要求时。
5.2.2第3章规定的所有项目为型式检验项民。生物学相容性评价应按GB/T16886.1规定的基本原则进行。
5.2.3全部检验项符合第3章中规定时判定合格,若有任一项不合格时判定该批产品型式检验不合格。
5.3出厂检验
出厂检验项目包括:密度、熔体质量流动速率,拉伸屈服应力、弯曲模量、悬臀梁缺口冲击强度和化学性能。
若化学性能有任一项不合格时判该批产品不合格。物理机械检验结果有不合格时,应重新自该批产品巾取双倍来样单元数,对不合格项目进行复验,复验结果仍不合格,则判定该批产品为不含格品。6标志
医用乙烯专用料产品外包装上标志应包括下列内容:a)产品名称、厂名、址:
b)产品牌号、批号;
标准号:
d)净重(kg);
e)“怕晒”“怕雨”等符合YY0466的标志或文字。7包装、贮存
7.1包装
医用聚乙烯专用料应至少采用双层包装,包装应保证在产品运输、贮存时不被污染,7.2贮存
医用聚乙烯专用料应贮存在通风、干爆、清洁并保持有良好消防设施的仓库内。贮存时远离热源,并防止阳光直射。
参考文献
YY/T 0114—2008
[1GB/T16886.32008医疗器械生物学评价第3部分:遗传毒性致癌性和生殖毒性试验(1SO 10993-3:2003,IDT)
[2′GB/T 16886. 4—2003
医疗器械生物学评价第4部分:与血液相互作用试验选择(ISO 10993-4:2002,IDT)
[3]GB/T 16886.5—2003F
医疗器械生物学评价第5部分:体外细胞毒性试验(ISO10993-5:1999,IDT)
GB/T 16886. 6—1997
医疗器械生物学评价第6部分:植人后局部反应试验(ISU10993-6:1994,[4
[57GB/T 16886.9—2001
(ISO 10993-9:1999,DT)
[6GB/T 16886.10—2005
(ISO 10993-10:2002,IDT)
[7] GB/T 16886. 11-1997
医疗器械生物学评价第9部分:潜在降解产物的定性和定量框架医疗器械生物学评价第10部分:刺激与迟发型超敏反应试验医疗器械生物学评价第11部分:全身毒性试验(IS0)10993-11:1993,[8]GB/T 16886. 12
(ISO 10993-12:2002,IDT)
医疗器械生物学评价
第12部分:样品制备与参照样品[97 GB/T 16886,13—2001
1医疗器械生物学评价第13部分:聚合物医疗器械的降解产物的定性与定量(ISO10993-13:1998,IDT)[10]GB/T16886.16--2003医疗器械生物学评价第16部分:降解产物和可溶出物的毒带动力学研究段计(ISO10993-16:1997,IDT)[II]GB/T 16886. 17--2005
5医疗器械生物学评价第17部分:可沥滤物允许限量的建立(ISO 10993-17:2002,DT)
YY/T0114-2008
中华人民共和国医药
行业标准
医用输液、输血,注射器具
用聚乙烯专用料
YY/T 0114-2008
中国标准出版社出版发行
北京复兴门外-里河北街16号
部酸编码:100045
网址www,spe,net.c
电话:6852394668517548
中国标准出版社秦皇岛印刷厂印刷各地新华书店经销
开本880×12301/16
印张 0.75
字数 11千字
2008年12月第一版
2008年12月第一次印刷
书号:155066·2-19301
定价14.00元
由本社发行中心调换
如有印装差错
版权专有侵权必究
举报电话:(010)68533533
8002110 /
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。