YY 0070-2008
基本信息
标准号: YY 0070-2008
中文名称:食管窥镜
标准类别:医药行业标准(YY)
标准状态:现行
出版语种:简体中文
下载格式:.zip .pdf
下载大小:1364266
相关标签: 窥镜

标准分类号
关联标准
出版信息
相关单位信息
标准简介
YY 0070-2008.Esophagoscope.
YY 0070规定了食管窥镜的定义及分类、要求、试验方法、检验规则标志、使用说明书、包装、运输和贮存的要求。
YY 0070适用于医疗临床使用的食管窥镜(以下简称窥镜),窥镜主要适用于食管病变的检查和/或与手术器械配合进行病变部位的治疗。
2规范性引用文件
下列文件中的条款通过在本标准中引用而成为本标准的条款,凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件中的最新版本,凡是不注日期的引用文件,其最新版本适用于本标准。
GB/T 191- -2000 包装 储运图示标志
GB/T 2829- -2002 周期检验计数抽样 程序及表(适用于对过程稳定性的检验)
GB9706.1- 1995医用电气设备第一部分 :安全通用要求(idt IEC 601-1 :1998)
GB9706.4- 1999医用电气设备第二部分:高频手术设备安全专用要求(idt IEC 60601-2-2; .1991)
GB9706.19- 20000 医用电气设备 第2部分:内窥镜设备安全专用要求(idt IEC 60601-2-18;1996)
GB/T 16886.1- -2001 医疗 器械生物学评价第 1部分:评价与试验(ISO 10993-1 :1997 ,IDT)
GB/T 16886.5- -2003 医疗 器械生物学评价第5部分:体外细胞毒性试验(ISO 10993-51999,IDT)
GB/T 16886. 10- -2005医疗器械生物学评价 第 10部分:刺激与迟发型超敏反应试验(ISO 10993-10; 2002 ,IDT)
GB/T 14975- -2002 结构用不锈 钢无缝钢管
YY/T 0149- -2006不锈钢医用器械耐腐蚀性能试验方法
YY0466- 2003 医疗器械用于 医疗器械标签、标记和提供信息的符号(ISO 15223 2000,IDT)国家食品药品监督管理局令第10号医疗 器械说明书、标签和包装标识管理规定
3定义和分类
3.1术语和定义
下列术语和定义适用于本标准。食管窥镜esophagoscope一种没有光学系统 ,具有观察目的,能伸人人体食管进行检查、诊断的硬管内窥镜。
3.2分类
3.2.1窥镜按照明方式不同分为内置照明和外置照明两种类型。
YY 0070规定了食管窥镜的定义及分类、要求、试验方法、检验规则标志、使用说明书、包装、运输和贮存的要求。
YY 0070适用于医疗临床使用的食管窥镜(以下简称窥镜),窥镜主要适用于食管病变的检查和/或与手术器械配合进行病变部位的治疗。
2规范性引用文件
下列文件中的条款通过在本标准中引用而成为本标准的条款,凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件中的最新版本,凡是不注日期的引用文件,其最新版本适用于本标准。
GB/T 191- -2000 包装 储运图示标志
GB/T 2829- -2002 周期检验计数抽样 程序及表(适用于对过程稳定性的检验)
GB9706.1- 1995医用电气设备第一部分 :安全通用要求(idt IEC 601-1 :1998)
GB9706.4- 1999医用电气设备第二部分:高频手术设备安全专用要求(idt IEC 60601-2-2; .1991)
GB9706.19- 20000 医用电气设备 第2部分:内窥镜设备安全专用要求(idt IEC 60601-2-18;1996)
GB/T 16886.1- -2001 医疗 器械生物学评价第 1部分:评价与试验(ISO 10993-1 :1997 ,IDT)
GB/T 16886.5- -2003 医疗 器械生物学评价第5部分:体外细胞毒性试验(ISO 10993-51999,IDT)
GB/T 16886. 10- -2005医疗器械生物学评价 第 10部分:刺激与迟发型超敏反应试验(ISO 10993-10; 2002 ,IDT)
GB/T 14975- -2002 结构用不锈 钢无缝钢管
YY/T 0149- -2006不锈钢医用器械耐腐蚀性能试验方法
YY0466- 2003 医疗器械用于 医疗器械标签、标记和提供信息的符号(ISO 15223 2000,IDT)国家食品药品监督管理局令第10号医疗 器械说明书、标签和包装标识管理规定
3定义和分类
3.1术语和定义
下列术语和定义适用于本标准。食管窥镜esophagoscope一种没有光学系统 ,具有观察目的,能伸人人体食管进行检查、诊断的硬管内窥镜。
3.2分类
3.2.1窥镜按照明方式不同分为内置照明和外置照明两种类型。
标准图片预览




标准内容
ICS11.040
中华人民共和国医药行业标准
YY 00702008
代替YY0070—1992
食管窥镜
Esophagoscope
2008-04-25发布
敬码方伪
国家食品药品监督管理局
2009-12-01实施
中华人民共和国医药
行业标准
食管窥镜
YY0070—2008
中国标准出版社出版发行
北京复兴门外三里河北街16号
邮政编码:100045
网址spc.net.cn
电话:6852394668517548
中国标准出版社秦皇岛印刷厂印刷各地新华书店经销
开本880×12301/16印张0.75字数16千字2008年9月第一版 2008年9月第一次印刷书号:155066-2-19056定价14.00元如有印装差错由本社发行中心调换版权专有侵权必究
举报电话:(01068533533
本标准代替YY0070—1992《食管窥镜》。本标准与YY0070—1992的差异如下:YY0070-2008
增加了定义和分类:将食管窥镜按照照明方式不同分为内置照明和外置照明两种;增加了照度、生物相容性、耐腐蚀性能等要求。本标准的附录A是规范性附录。
本标准由全国医用光学和仪器标准化分技术委员会提出并归口。本标准起草单位:杭州桐庐尖端内窥镜有限公司。本标准主要起草人:刘萍、徐天松、刘世源。本标准所代替标准的历次版本发布情况为:WS2-110—1974.WS2-111—1974
-YY0070—1992。
1范围
食管窥镜
YY0070—2008
本标准规定了食管窥镜的定义及分类、要求、试验方法、检验规则、标志、使用说明书、包装、运输和贮存的要求。
本标准适用于医疗临床使用的食管窥镜(以下简称窥镜),窥镜主要适用于食管病变的检查和/或与手术器械配合进行病变部位的治疗。2规范性引用文件
下列文件中的条款通过在本标准中引用而成为本标准的条款,凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件中的最新版本,凡是不注日期的引用文件,其最新版本适用于本标准。GB/T191—2000包装储运图示标志GB/T2829一2002周期检验计数抽样程序及表(适用于对过程稳定性的检验)GB9706.1—1995医用电气设备第—部分:安全通用要求(idtIEC601-1:1998)GB9706.4—1999
GB9706.19—2000
医用电气设备第二部分:高频手术设备安全专用要求(idtIEC60601-2-2:医用电气设备第2部分:内窥镜设备安全专用要求(idtIEC60601-2-18:GB/T16886.1—2001
GB/T16886.5—2003
医疗器械生物学评价第1部分:评价与试验(ISO10993-1:1997,IDT)医疗器械生物学评价第5部分:体外细胞毒性试验(ISO10993-5:1999,GB/T16886.10—2005
(ISO10993-10.2002,IDT)
医疗器械生物学评价第10部分:刺激与发型超敏反应试验GB/T14975-—2002结构用不锈钢无缝钢管YY/T0149—2006不锈钢医用器械耐腐蚀性能试验方法YY0466—2003医疗器械用于医疗器械标签、标记和提供信息的符号(ISO15223:2000,IDT)国家食品药品监督管理局令第10号医疗器械说明书标签和包装标识管理规定3定义和分类
3.1术语和定义
下列术语和定义适用于本标准。食管宽镜esophagoscope
一种没有光学系统,具有观察目的,能伸人人体食管进行检查、诊断的硬管内窥镜。3.2分类
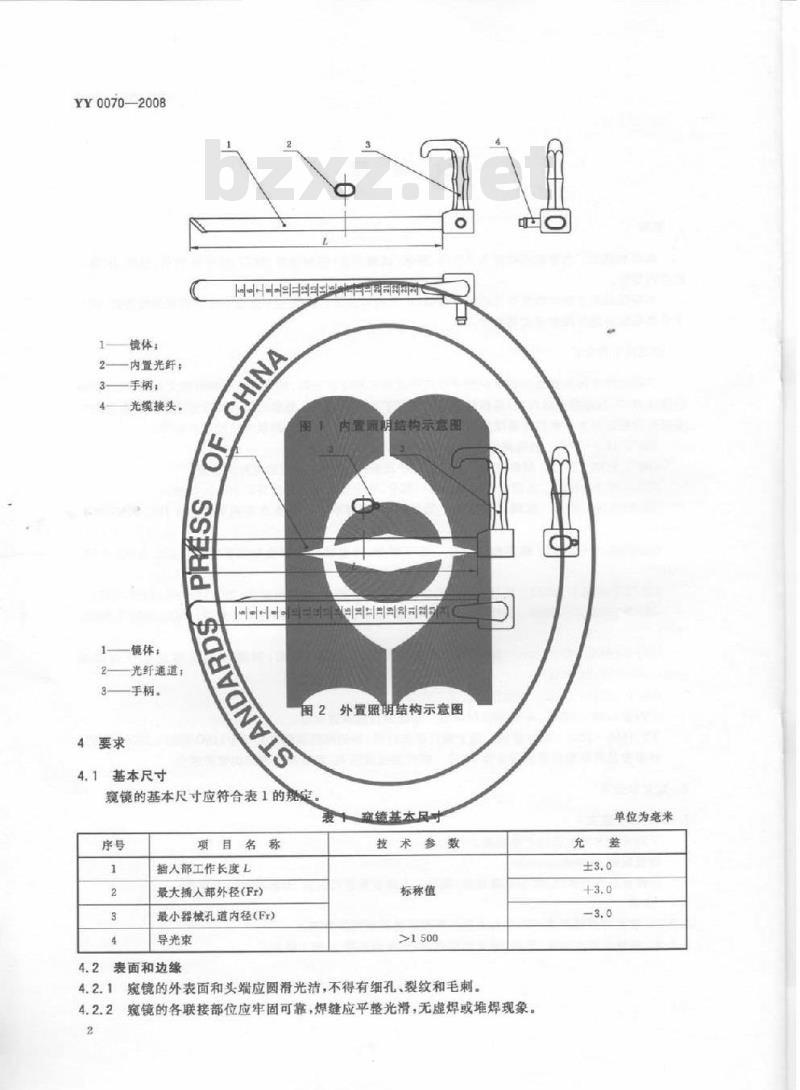
3.2.1窥镜按照明方式不同分为内置照明和外置照明两种类型。3.2.2窥镜主要由镜体、手柄、导光束组成,外型结构如图1、图2要求。1
YY0070—2008
镜体;
一内置光纤:
手柄;
光缆接头,
镜体:
光纤通道,
手柄。
4要求
4.1基本尺寸
内冒氟剪
用结构示意图
图2外置照明结构示意图
窥镜的基本尺寸应符合表1的规定。表十密镜基本民寸
项目名称
插人部工作长度L
最大插人部外径(Fr)
最小器械孔道内径(Fr)
导光束
4.2表面和边缘
技术参数
标称值
窥镜的外表面和头端应圆滑光洁,不得有细孔、裂纹和毛刺。窥镜的各联接部位应牢固可靠,焊缝应平整光滑,无虚焊或堆焊现象。充
单位为毫米
4.3照度
窥镜在工作距离15mm处光照度应不低于2500lx。4.4标记
窥镜插入部分的外表面应刻有长度标记,刻度应清晰。4.5配合性能
外置照明结构的导光束插入专用通道时应滑动自如,不得有卡滞现象。4.6表面粗糙度
窥镜的插人部分如有光亮表面,其表面粗糖度值Ro.2um。4.7生物相容性
YY0070—2008
窥镜插人人体部分的外表面材料,其插人部外表面应采用结构用不锈钢1Cr18Ni9Ti或3Cr13无缝异形钢管材料或符合生相容性的真他材料制造,否则,应按GB16886.1-2001的要求进行检验,应符合:
a)细胞毒性记分
b)无致敏反应:
c)刺激反应
4.8耐腐蚀性能
手I:
型应不大于
窥镜应有良存的腐蚀性能在带规2006第5章中
4.9安全性
窥镜与冷
的规定,具体要
5试验方法
5.1尺寸检验www.bzxz.net
连使用的安
时录AC规范性
以通用或专用
通检测,其维果应符合
5.2表面试验
在足够的照明视和手
5.3照度试验
下经药物消毒或态部后,外表齿应不低于YY/T0149-和GB9706.19
2.4.4前的要求
000中BF型设备
用150W卤素灯格照度调到最大值与窥镜连接,在背景喷照度你于冷光源照度值1%的环境下,在工作距离15mm处放级精度照度计探头,待照度计显示值稳定后连续测量三次,读出数值。其结果应符合4.3的要3
5.4配合性能试验
仿使用动作,将导光束插入导光桌专用通道进行插拨,其结果应符合4.5的要求。5.5表面粗糙度试验
以标准样板比对或电测法进行,其结果应符合4.6的要求。5.6生物相容性试验
查验符合生物相容性的有关证明材料。应符合4.7的要求,否则按下述方法进行试验:a)按GB/T16886.5—2003规定的方法进行,应符合4.7a)的要求;b)按GB/T16886.10—2005规定的方法进行,应符合4.7b)、c)的要求。5.7耐腐蚀性能试验
按照YY/T0149—2006中第5章沸水试验法或按下列方法试验,应符合4.8的要求:将内窥镜浸人35℃的水中30min,然后浸入2%戊二醛消毒液中100min,可用福尔马林熏蒸40min,取出后用35℃的清水冲洗消毒液,并擦干静置2h后观察。3
YY0070—2008
5.8安全试验
按附录A(规范性附录)规定的方法进行,其结果应符合4.9的要求。6检验规则
6.1总则
窥镜应由制造厂质量检验部门检验合格,并附有产品质量检验合格证后方可出厂。6.2检验分类
窥镜检验出厂检验和型式检验。6.3出厂检验
6.3.1窥镜的出厂检验应逐渐进行,检验项目为4.1~4.6及附录A(规范性附录)中规定的出厂检验项目。
6.3.2出厂检验项目若有一项不合格,就判该件不合格。6.4型式检验
6.4.1下列情况下进行型式检验:准产注册前(包括老产品转产);间陷一年以上投产时;
在设计、工艺或材料有重大改变时;国家质量监督部门提出要求时。6.4.2型式检验在同批原材料生产的出厂检验合格的产品中抽样,按照GB/T2829—2002的规定进行。采用一次抽样方案,其检验项目及不合格分类、判别水平(DL)、不合格质量水平(RQL)(每百单位产品不合格数)见表2的规定。
不合格分类
检验项目
判别水平 DL
不合格质量水平RQL
判别数
表2型式检验抽样表
4.3、4.4、4.5、4.6、4.8
任一不合格
2[0,1]
6.5生物相容性评价
6.5.1在下列情况之一,应进行生物相容性评价:a
准产注册前:
材料首次使用时,未证明生物相容性是安全的;b)
制造产品的材料来源或技术条件改变时;?
产品配方、工艺、初级包装或灭菌改变时:d)
贮存期内最终产品中的任何变化;e
产品用途改变时;
g)有迹象表明产品用于人体时会产生不良作用。6.5.2进行生物相容性试验时,按检验所需量抽样,并应全部合格7标志
7.1标志内容
7.1.1产品标志
每件窥镜都应有以下标志:
2[1,2]
a)制造公司商标或其生产厂的标志;b)每支窥镜应标明最大插人部外径、最小器械孔道内径、工作长度;c)产品出厂编号:
YY0070—-2008
由于尺寸和外形的原因无法在窥镜上标注时,所要求的标记应标注在使用说明书上。7.1.2合格证标志
产品合格证上应有以下标志:
a)生产企业名称;
b)产品名称及规格;
c)检验日期。
检验员代号。
7.1.3外包标志
外包装上的标志应符合《医疗器械说明书、标签和包装标识管理规定》的要求及YY0466—2003、GB/T191—2000的有关规定,并增加下列内容:a)体积(长x宽×高)
b)毛重、净重:
c)“易碎物品”“向上”“怕雨”等字样和标志。7.2标志要求
7.2.1当窥镜按生产厂的使用说明书在使用清洁,消毒灭菌和贮存后,标记必须保持清晰。1.2.2外包装箱上的字样和标志应保证不因历时较久而模糊不清。8使用说明书
使用说明书的编写应符合《医疗器械说明书、标签和包装标识管理规定》的要求。9包装、运输和贮存
9.1包装
9.1.1每套窥镜应有产品说明书、检验合格证和装箱清单各一份,用塑料袋包装,放置在箱内9.1.2窥镜装人内村有泡沫塑料的硬质手提箱内并使各附件分隔固定,然后再装入防震防湿的外包装箱。
9.2运输
运输要求按订货合同规定。
9.3贮存
包装后的窥镜应贮存在相对湿度不超过80%,无腐蚀性气体和通风良好的室内。YY0070—2008
A.1产品特征
附录A
(规范性附录)
与冷光源互连使用的安全要求
食管窥镜为内窥镜电气设备的BF型应用部分。A.2外部标记
A.2.1要求
应有下列”永久贴牢的”和“清楚易认的”标记a)企业标志:
b)产品型号。
A.2.2试验方法
按GB9706.1—1995中6.1规定的方法进行检查和试验A.3随机文件齐全性
要求:应符合GB9706.1-1995中6.8.1的规定。A3.1
试验方法:查阅随机文件。
A.4使用说明书
A,4.1要求:应符合GB9706.11995中6.8.2a)、d),GB9706.19—2000中6.8.2aa)的规定。A.4.2试验方法:查阅随机文件。A.5技术说明书
A.5.1要求:可与使用说明书合并。此部分的内容应符合GB9706.1-1995中6.8.3.a)的要求。A.5.2试验方法:查阅随机文件。A.6环境条件
A.6.1要求
A.6.1.1运输和贮存
运输和贮存应符合下列要求:
a)环境温度范围-40℃~+55℃;b)相对湿度范围:10%~80%;
c)大气压力范围:500hPa~1060hPa。A.6.1.2运行
运行应符合下列要求:
a)环境温度范围:10℃~40℃;b)相对湿度范围:30%~80%;
c大气压力范围:860hPa~1060hPa。6
A.6.2试验方法
按GB9706.1—1995中的规定进行,A.7应用部分的隔离
YY0070—2008
A.7.1要求:与配套的医用电器设备连接,食管窥镜作为其应用部分应符合GB9706.1—1995中17c)的要求。
A.7.2试验方法:通过检查和漏电流试验进行检验。A.8工作温度下的连续漏电流
A.8.1要求:应不超过表A.1所列容许值。表A.1连续漏电流
患者漏电流
惠者漏电流(应用部分加网电压)正常状态
单位为毫安
单一故障状态
A.8.2试验方法:按GB9706.1-1995中第19章和GB9706.1—1995中19.4h)的规定。A.9高频漏电流
A.9.1要求:应符合GB9706.4—1999中19.101的要求。A.9.2试验方法:与配套的高频发生器连接后,按GB9706.4—1999中19.101规定的方法进行试验,检验其是否符合要求,
A.10正常工作温度下电介质强度要求:按表A.2所规定的部位之间应能承受50Hz,正弦波及规定试验电压1min,无击穿和A.10.1
闪络现象。
表A.2电介质强度检测部位及试验电压代号
检测部位
应用部分(者电路)和带电部分之间,内宽镜的外表面和内窥镜任何带电电路之间
保护接地端或与内窥镜带电部件隔离的功能接地端相连的部件和内窥镜的外表面之间
单位为伏特
试验电压
试验方法:按GB9706.1—1995中20.4的规定,使用医用电气设备电击防护参数测试仪进行试验。A.10.2
潮湿预处理后的连续漏电流
要求:应不超过表A1所列的允许值。A.11.2试验方法:潮湿预处理按GB9706.1—1995中4.10进行,潮湿预处理后连续漏电流试验,按GB9706.1—1995中19.4h)的规定。A.12潮湿预处理后的电介质强度A.12.1要求:按表A2所规定的部位之间应能承受50Hz,正弦波及规定试验电压1min,无击穿和闪络现象
A12.2试验方法:潮湿预处理按GB9706.1—1995中4.10进行,潮湿预处理后的电介质强度试验,按GB9706.1-1995中20.4的规定,使用医用电气设备电击防护参数测试仪进行试验。YY0070—2008
A.13面、角、边的安全性
A.13.1要求:应符合GB9706.1—1995中第23章的要求。A.13.2试验方法:以目力观察和手感检查。A.14超温危险的防护
A14.1要求:应符合GB9706.1—1995中42.3、GB9706.19—2000中42.3的要求。A.14.2试验方法:按GB9706.1-1995中42.3、GB9706.19—2000中42.3的规定的方法进行。A.15清洗、消毒和灭菌
A15.1要求:可以采用高温高压消毒灭菌的内窥镜,应符合GB9706.1-1995中44.7的要求,A.15.2试验方法:按GB9706.1-1995、GB9706.19—2000中44.7的要求进行。版权专有侵权必究
书号:1550662-19056
YY0070-2008
定价:
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国医药行业标准
YY 00702008
代替YY0070—1992
食管窥镜
Esophagoscope
2008-04-25发布
敬码方伪
国家食品药品监督管理局
2009-12-01实施
中华人民共和国医药
行业标准
食管窥镜
YY0070—2008
中国标准出版社出版发行
北京复兴门外三里河北街16号
邮政编码:100045
网址spc.net.cn
电话:6852394668517548
中国标准出版社秦皇岛印刷厂印刷各地新华书店经销
开本880×12301/16印张0.75字数16千字2008年9月第一版 2008年9月第一次印刷书号:155066-2-19056定价14.00元如有印装差错由本社发行中心调换版权专有侵权必究
举报电话:(01068533533
本标准代替YY0070—1992《食管窥镜》。本标准与YY0070—1992的差异如下:YY0070-2008
增加了定义和分类:将食管窥镜按照照明方式不同分为内置照明和外置照明两种;增加了照度、生物相容性、耐腐蚀性能等要求。本标准的附录A是规范性附录。
本标准由全国医用光学和仪器标准化分技术委员会提出并归口。本标准起草单位:杭州桐庐尖端内窥镜有限公司。本标准主要起草人:刘萍、徐天松、刘世源。本标准所代替标准的历次版本发布情况为:WS2-110—1974.WS2-111—1974
-YY0070—1992。
1范围
食管窥镜
YY0070—2008
本标准规定了食管窥镜的定义及分类、要求、试验方法、检验规则、标志、使用说明书、包装、运输和贮存的要求。
本标准适用于医疗临床使用的食管窥镜(以下简称窥镜),窥镜主要适用于食管病变的检查和/或与手术器械配合进行病变部位的治疗。2规范性引用文件
下列文件中的条款通过在本标准中引用而成为本标准的条款,凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件中的最新版本,凡是不注日期的引用文件,其最新版本适用于本标准。GB/T191—2000包装储运图示标志GB/T2829一2002周期检验计数抽样程序及表(适用于对过程稳定性的检验)GB9706.1—1995医用电气设备第—部分:安全通用要求(idtIEC601-1:1998)GB9706.4—1999
GB9706.19—2000
医用电气设备第二部分:高频手术设备安全专用要求(idtIEC60601-2-2:医用电气设备第2部分:内窥镜设备安全专用要求(idtIEC60601-2-18:GB/T16886.1—2001
GB/T16886.5—2003
医疗器械生物学评价第1部分:评价与试验(ISO10993-1:1997,IDT)医疗器械生物学评价第5部分:体外细胞毒性试验(ISO10993-5:1999,GB/T16886.10—2005
(ISO10993-10.2002,IDT)
医疗器械生物学评价第10部分:刺激与发型超敏反应试验GB/T14975-—2002结构用不锈钢无缝钢管YY/T0149—2006不锈钢医用器械耐腐蚀性能试验方法YY0466—2003医疗器械用于医疗器械标签、标记和提供信息的符号(ISO15223:2000,IDT)国家食品药品监督管理局令第10号医疗器械说明书标签和包装标识管理规定3定义和分类
3.1术语和定义
下列术语和定义适用于本标准。食管宽镜esophagoscope
一种没有光学系统,具有观察目的,能伸人人体食管进行检查、诊断的硬管内窥镜。3.2分类
3.2.1窥镜按照明方式不同分为内置照明和外置照明两种类型。3.2.2窥镜主要由镜体、手柄、导光束组成,外型结构如图1、图2要求。1
YY0070—2008
镜体;
一内置光纤:
手柄;
光缆接头,
镜体:
光纤通道,
手柄。
4要求
4.1基本尺寸
内冒氟剪
用结构示意图
图2外置照明结构示意图
窥镜的基本尺寸应符合表1的规定。表十密镜基本民寸
项目名称
插人部工作长度L
最大插人部外径(Fr)
最小器械孔道内径(Fr)
导光束
4.2表面和边缘
技术参数
标称值
窥镜的外表面和头端应圆滑光洁,不得有细孔、裂纹和毛刺。窥镜的各联接部位应牢固可靠,焊缝应平整光滑,无虚焊或堆焊现象。充
单位为毫米
4.3照度
窥镜在工作距离15mm处光照度应不低于2500lx。4.4标记
窥镜插入部分的外表面应刻有长度标记,刻度应清晰。4.5配合性能
外置照明结构的导光束插入专用通道时应滑动自如,不得有卡滞现象。4.6表面粗糙度
窥镜的插人部分如有光亮表面,其表面粗糖度值Ro.2um。4.7生物相容性
YY0070—2008
窥镜插人人体部分的外表面材料,其插人部外表面应采用结构用不锈钢1Cr18Ni9Ti或3Cr13无缝异形钢管材料或符合生相容性的真他材料制造,否则,应按GB16886.1-2001的要求进行检验,应符合:
a)细胞毒性记分
b)无致敏反应:
c)刺激反应
4.8耐腐蚀性能
手I:
型应不大于
窥镜应有良存的腐蚀性能在带规2006第5章中
4.9安全性
窥镜与冷
的规定,具体要
5试验方法
5.1尺寸检验www.bzxz.net
连使用的安
时录AC规范性
以通用或专用
通检测,其维果应符合
5.2表面试验
在足够的照明视和手
5.3照度试验
下经药物消毒或态部后,外表齿应不低于YY/T0149-和GB9706.19
2.4.4前的要求
000中BF型设备
用150W卤素灯格照度调到最大值与窥镜连接,在背景喷照度你于冷光源照度值1%的环境下,在工作距离15mm处放级精度照度计探头,待照度计显示值稳定后连续测量三次,读出数值。其结果应符合4.3的要3
5.4配合性能试验
仿使用动作,将导光束插入导光桌专用通道进行插拨,其结果应符合4.5的要求。5.5表面粗糙度试验
以标准样板比对或电测法进行,其结果应符合4.6的要求。5.6生物相容性试验
查验符合生物相容性的有关证明材料。应符合4.7的要求,否则按下述方法进行试验:a)按GB/T16886.5—2003规定的方法进行,应符合4.7a)的要求;b)按GB/T16886.10—2005规定的方法进行,应符合4.7b)、c)的要求。5.7耐腐蚀性能试验
按照YY/T0149—2006中第5章沸水试验法或按下列方法试验,应符合4.8的要求:将内窥镜浸人35℃的水中30min,然后浸入2%戊二醛消毒液中100min,可用福尔马林熏蒸40min,取出后用35℃的清水冲洗消毒液,并擦干静置2h后观察。3
YY0070—2008
5.8安全试验
按附录A(规范性附录)规定的方法进行,其结果应符合4.9的要求。6检验规则
6.1总则
窥镜应由制造厂质量检验部门检验合格,并附有产品质量检验合格证后方可出厂。6.2检验分类
窥镜检验出厂检验和型式检验。6.3出厂检验
6.3.1窥镜的出厂检验应逐渐进行,检验项目为4.1~4.6及附录A(规范性附录)中规定的出厂检验项目。
6.3.2出厂检验项目若有一项不合格,就判该件不合格。6.4型式检验
6.4.1下列情况下进行型式检验:准产注册前(包括老产品转产);间陷一年以上投产时;
在设计、工艺或材料有重大改变时;国家质量监督部门提出要求时。6.4.2型式检验在同批原材料生产的出厂检验合格的产品中抽样,按照GB/T2829—2002的规定进行。采用一次抽样方案,其检验项目及不合格分类、判别水平(DL)、不合格质量水平(RQL)(每百单位产品不合格数)见表2的规定。
不合格分类
检验项目
判别水平 DL
不合格质量水平RQL
判别数
表2型式检验抽样表
4.3、4.4、4.5、4.6、4.8
任一不合格
2[0,1]
6.5生物相容性评价
6.5.1在下列情况之一,应进行生物相容性评价:a
准产注册前:
材料首次使用时,未证明生物相容性是安全的;b)
制造产品的材料来源或技术条件改变时;?
产品配方、工艺、初级包装或灭菌改变时:d)
贮存期内最终产品中的任何变化;e
产品用途改变时;
g)有迹象表明产品用于人体时会产生不良作用。6.5.2进行生物相容性试验时,按检验所需量抽样,并应全部合格7标志
7.1标志内容
7.1.1产品标志
每件窥镜都应有以下标志:
2[1,2]
a)制造公司商标或其生产厂的标志;b)每支窥镜应标明最大插人部外径、最小器械孔道内径、工作长度;c)产品出厂编号:
YY0070—-2008
由于尺寸和外形的原因无法在窥镜上标注时,所要求的标记应标注在使用说明书上。7.1.2合格证标志
产品合格证上应有以下标志:
a)生产企业名称;
b)产品名称及规格;
c)检验日期。
检验员代号。
7.1.3外包标志
外包装上的标志应符合《医疗器械说明书、标签和包装标识管理规定》的要求及YY0466—2003、GB/T191—2000的有关规定,并增加下列内容:a)体积(长x宽×高)
b)毛重、净重:
c)“易碎物品”“向上”“怕雨”等字样和标志。7.2标志要求
7.2.1当窥镜按生产厂的使用说明书在使用清洁,消毒灭菌和贮存后,标记必须保持清晰。1.2.2外包装箱上的字样和标志应保证不因历时较久而模糊不清。8使用说明书
使用说明书的编写应符合《医疗器械说明书、标签和包装标识管理规定》的要求。9包装、运输和贮存
9.1包装
9.1.1每套窥镜应有产品说明书、检验合格证和装箱清单各一份,用塑料袋包装,放置在箱内9.1.2窥镜装人内村有泡沫塑料的硬质手提箱内并使各附件分隔固定,然后再装入防震防湿的外包装箱。
9.2运输
运输要求按订货合同规定。
9.3贮存
包装后的窥镜应贮存在相对湿度不超过80%,无腐蚀性气体和通风良好的室内。YY0070—2008
A.1产品特征
附录A
(规范性附录)
与冷光源互连使用的安全要求
食管窥镜为内窥镜电气设备的BF型应用部分。A.2外部标记
A.2.1要求
应有下列”永久贴牢的”和“清楚易认的”标记a)企业标志:
b)产品型号。
A.2.2试验方法
按GB9706.1—1995中6.1规定的方法进行检查和试验A.3随机文件齐全性
要求:应符合GB9706.1-1995中6.8.1的规定。A3.1
试验方法:查阅随机文件。
A.4使用说明书
A,4.1要求:应符合GB9706.11995中6.8.2a)、d),GB9706.19—2000中6.8.2aa)的规定。A.4.2试验方法:查阅随机文件。A.5技术说明书
A.5.1要求:可与使用说明书合并。此部分的内容应符合GB9706.1-1995中6.8.3.a)的要求。A.5.2试验方法:查阅随机文件。A.6环境条件
A.6.1要求
A.6.1.1运输和贮存
运输和贮存应符合下列要求:
a)环境温度范围-40℃~+55℃;b)相对湿度范围:10%~80%;
c)大气压力范围:500hPa~1060hPa。A.6.1.2运行
运行应符合下列要求:
a)环境温度范围:10℃~40℃;b)相对湿度范围:30%~80%;
c大气压力范围:860hPa~1060hPa。6
A.6.2试验方法
按GB9706.1—1995中的规定进行,A.7应用部分的隔离
YY0070—2008
A.7.1要求:与配套的医用电器设备连接,食管窥镜作为其应用部分应符合GB9706.1—1995中17c)的要求。
A.7.2试验方法:通过检查和漏电流试验进行检验。A.8工作温度下的连续漏电流
A.8.1要求:应不超过表A.1所列容许值。表A.1连续漏电流
患者漏电流
惠者漏电流(应用部分加网电压)正常状态
单位为毫安
单一故障状态
A.8.2试验方法:按GB9706.1-1995中第19章和GB9706.1—1995中19.4h)的规定。A.9高频漏电流
A.9.1要求:应符合GB9706.4—1999中19.101的要求。A.9.2试验方法:与配套的高频发生器连接后,按GB9706.4—1999中19.101规定的方法进行试验,检验其是否符合要求,
A.10正常工作温度下电介质强度要求:按表A.2所规定的部位之间应能承受50Hz,正弦波及规定试验电压1min,无击穿和A.10.1
闪络现象。
表A.2电介质强度检测部位及试验电压代号
检测部位
应用部分(者电路)和带电部分之间,内宽镜的外表面和内窥镜任何带电电路之间
保护接地端或与内窥镜带电部件隔离的功能接地端相连的部件和内窥镜的外表面之间
单位为伏特
试验电压
试验方法:按GB9706.1—1995中20.4的规定,使用医用电气设备电击防护参数测试仪进行试验。A.10.2
潮湿预处理后的连续漏电流
要求:应不超过表A1所列的允许值。A.11.2试验方法:潮湿预处理按GB9706.1—1995中4.10进行,潮湿预处理后连续漏电流试验,按GB9706.1—1995中19.4h)的规定。A.12潮湿预处理后的电介质强度A.12.1要求:按表A2所规定的部位之间应能承受50Hz,正弦波及规定试验电压1min,无击穿和闪络现象
A12.2试验方法:潮湿预处理按GB9706.1—1995中4.10进行,潮湿预处理后的电介质强度试验,按GB9706.1-1995中20.4的规定,使用医用电气设备电击防护参数测试仪进行试验。YY0070—2008
A.13面、角、边的安全性
A.13.1要求:应符合GB9706.1—1995中第23章的要求。A.13.2试验方法:以目力观察和手感检查。A.14超温危险的防护
A14.1要求:应符合GB9706.1—1995中42.3、GB9706.19—2000中42.3的要求。A.14.2试验方法:按GB9706.1-1995中42.3、GB9706.19—2000中42.3的规定的方法进行。A.15清洗、消毒和灭菌
A15.1要求:可以采用高温高压消毒灭菌的内窥镜,应符合GB9706.1-1995中44.7的要求,A.15.2试验方法:按GB9706.1-1995、GB9706.19—2000中44.7的要求进行。版权专有侵权必究
书号:1550662-19056
YY0070-2008
定价:
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。