YY/T 0660-2008
基本信息
标准号: YY/T 0660-2008
中文名称:外科植入物用聚醚醚酮(PEEK)聚合物的标准规范
标准类别:医药行业标准(YY)
标准状态:现行
出版语种:简体中文
下载格式:.zip .pdf
下载大小:676681

标准分类号
关联标准
出版信息
相关单位信息
标准简介
YY/T 0660-2008.Standard specification for polyetheretherketone( PEEK) polymers for surgical implant applications.
YY/T 0660涵盖了由原料供应商提供的PEEK聚合物原料(粒料、粉料等)。本标准提供了当这些热塑性塑料制造用于人体的植人器械,诸如外科植入物、外科或牙科器械的部件时的要求和相关的试验方法。
任何一种材料,生产部件或器械时的加工技术(例如模塑、挤出、机加工、装配、灭菌等)均可改变其性能。这些聚合物成品的性能由原料供应商、医疗器械制造商以及管理机构所认可的合适的试验方法来进行试验,以确保其安全及有效性。
YY/T 0660中所包括的性能仅适用于聚醚醚酮聚合物。标准中要求的性能适用于注塑成型的产品。成品、材料或包含着色剂、填充剂、加工助剂或其他添加剂,以及混有PEEK聚合物的共混物或再生材料不在本标准范畴之内。
YY/T 0660旨在推荐物理、化学以及生物学试验方法,针对医疗植人器械所使用的PEEK聚合物,确立其性能的合理可信度水平。在选择材料过程中,应按照最终使用要求考虑所列举的性能。当按照本标准的要求对材料进行评价时,可能涉及到危险性材料操作以及仪器。本标准并非试图对所涉及到的所有安全问题进行阐述,即便是那些与其使用有关的安全问题。确立适当的安全及操作规范,以及在应用前明确管理限制的适用性,是YY/T 0660用户自身的责任。
2规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注8期的引用文件,其最新版本适用于本标准。
GB/T 16886. 1- -2001医疗器械生物学评价第1部分:评价与试验(idt ISO 10993-1 :1997)
GB/T 16886. 2- -2000医疗器械生物学评价第 2部分:动物保护要求(idt ISO 10993-2:1992)
GB/T 16886. 3- -1997医疗器械生物学评价第3部分:遗传毒性、致癌性和生殖毒性试验(idt ISO 10993-3 :1992)
GB/T 16886.4- -2003 医疗器械生 物学评价第 4部分:与血液相互作用试验选择(ISO 10993-4: 2002 ,IDT)
GB/T 16886.5- -2003 医疗器械生 物学评价第 5部分:体外细胞毒性试验(IsO 10993-5.1999,IDT)
GB/T 16886.6- -1997医疗器械生物学评价 第6部分:植入后局部反应试验(idt ISO 10993-4:1994)
GB/T 16886.7- 2001 医疗 器械生物学评价第 7部分:环氧乙烷灭菌残留量(idt ISO 10993-5:1995)
GB/T 16886.9- -2001医疗 器械生物学评价第 9部分:潜在降解产物的定性和定量框架
YY/T 0660涵盖了由原料供应商提供的PEEK聚合物原料(粒料、粉料等)。本标准提供了当这些热塑性塑料制造用于人体的植人器械,诸如外科植入物、外科或牙科器械的部件时的要求和相关的试验方法。
任何一种材料,生产部件或器械时的加工技术(例如模塑、挤出、机加工、装配、灭菌等)均可改变其性能。这些聚合物成品的性能由原料供应商、医疗器械制造商以及管理机构所认可的合适的试验方法来进行试验,以确保其安全及有效性。
YY/T 0660中所包括的性能仅适用于聚醚醚酮聚合物。标准中要求的性能适用于注塑成型的产品。成品、材料或包含着色剂、填充剂、加工助剂或其他添加剂,以及混有PEEK聚合物的共混物或再生材料不在本标准范畴之内。
YY/T 0660旨在推荐物理、化学以及生物学试验方法,针对医疗植人器械所使用的PEEK聚合物,确立其性能的合理可信度水平。在选择材料过程中,应按照最终使用要求考虑所列举的性能。当按照本标准的要求对材料进行评价时,可能涉及到危险性材料操作以及仪器。本标准并非试图对所涉及到的所有安全问题进行阐述,即便是那些与其使用有关的安全问题。确立适当的安全及操作规范,以及在应用前明确管理限制的适用性,是YY/T 0660用户自身的责任。
2规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注8期的引用文件,其最新版本适用于本标准。
GB/T 16886. 1- -2001医疗器械生物学评价第1部分:评价与试验(idt ISO 10993-1 :1997)
GB/T 16886. 2- -2000医疗器械生物学评价第 2部分:动物保护要求(idt ISO 10993-2:1992)
GB/T 16886. 3- -1997医疗器械生物学评价第3部分:遗传毒性、致癌性和生殖毒性试验(idt ISO 10993-3 :1992)
GB/T 16886.4- -2003 医疗器械生 物学评价第 4部分:与血液相互作用试验选择(ISO 10993-4: 2002 ,IDT)
GB/T 16886.5- -2003 医疗器械生 物学评价第 5部分:体外细胞毒性试验(IsO 10993-5.1999,IDT)
GB/T 16886.6- -1997医疗器械生物学评价 第6部分:植入后局部反应试验(idt ISO 10993-4:1994)
GB/T 16886.7- 2001 医疗 器械生物学评价第 7部分:环氧乙烷灭菌残留量(idt ISO 10993-5:1995)
GB/T 16886.9- -2001医疗 器械生物学评价第 9部分:潜在降解产物的定性和定量框架
标准图片预览




标准内容
ICS 11.040.40
中华人民共和国医药行业标准
YY/T 0660—2008
外科植入物用聚醚醚酮(PEEK)聚合物的标准规范
Standard specification for polyetheretherketone(PEEK)polymers for surgical implant applications(ASTM F 2026-07,M0D)
2008-04-25发布
国家食品药品监督管理局
2009-06-01实施
YY/T0660—2008
本标准修改采用ASTMF2026-07《外科植人物用案醚醚酮(PEEK)聚合物的标准规范》,技术内容不变。
本标准与ASTMF2026-07的主要差异如下:一按照汉语芽惯对一些编排格式进行了髂改;将一些适用于美国标准的表述改为适用于我国标的表述;-将第2章“规范性引用文件”中已转化为国标的国际标准用转化的国标代替:将原文表1中的编辑性错误进行修改1-除第8章“关键词”。
本标准的附录 A为资料性附录,本标准由全国外科植入物和矫形器械标准化技术委员会提出并归口。本标准起草单位:国家食品药品监督管理局天津医疗器械质量监督检验中心。本标准主起草人,马春宝、樊铂、李沅、姜熙。1范围
外科植入物用聚醚醚酮(PEEK)聚合物的标准规范
YY/T 0660—2008
本标准涵盖了由原料供应商提供的PEEK聚合物原料(粒料、粉料等)。本标提供了当这些热塑性塑料制造用于人体的植入器械,诸如外科植入物、外科或牙科器械的部件时的要求和相关的试验方法。
任何·种材料,生产部件或器械时的加工技术(例如模塑、挤出、机加工、装配,灭菌等)均可改变其性能。这些骤合物成品的性能由原料供应商、医疗器械制造商以及管理机构所认可的合适的试验方法来进行试验,以确保其安全及有效性。标准中所包括的性能仅适用于骤醛醛酮聚合物。标准中要求的性能适用于注塑成型的产品。成品、材料或包含着色剂、填充剂、加工助剂或其他添加剂,以及混有PEEK合物的共混物或再生材料不在本标准范畴之内。
本标准片在推荐物理、化学以及生物学试验方法,针对医疗植入器械所使用的PEEK聚合物,确立其性能的合理可信度水平。在选择材料过程中,应按照最终使用要求考虑所列举的性能。当按照本标准的要求对材料进行评价时,可能涉及到危险性材料、操作以及仪器。本标准并非试图对所涉及到的所有安全问题进行阐述,即便是那些与其使用有关的安全问题。确立适当的安全及操作规范,以及在应用前明确理限制的适用性,是本标准用户自身的责任。2规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括断误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达或协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。GB/T16886.1—2001医疗器械生物学评价第1部分:评价与试验(idtISO10993-1:1997)GB/T16886.22000医疗器械生物学评价第2部分:动物保护要求(idtISO10993-2:1992)GB/T16886.3--1997
(idt IS0 10993-3:1992)
GB/T16886.1—2003
4:2002IDT)
GB/T 16886.5—2003
医疗器械生物学评价第3部分:遗传毒性、致癌性和生殖毒性试验医疗器械生物学评价第 4部分:与血液相万作用试验选择(ISO 10993医疗器械生物学评价第5部分:体外细胞毒性试验(ISO10993-5:1999,GB/T 16886.6—1997
医疗器械生物学评价第6部分:植人后局部反应试验(idtISO10993-4:1994)
GB/T 16886.7—2001
GB/T 16886, 9—2001
(idt ISO 10993-9 :1999)
GB/T16886.102005
(ISO10993-10.2002,DT)
医疗器械生物学评价第7部分:环氧乙烷灭菌残留量(idtIS010993-5:医疗器械生物学评价第9部分:潜在降解产物的定性和定最框架医疗器械生物学评价第10部分:刺激与迟发型超敏反应试验1
YY/T 0660-2008
GB/T16886.11—1997
医疗器械生物学评价第11部分:全身毒性试验(idtISO10993-11:1993)
GB/T16886.122005医疗器械生物学评价第12部分:样品制备与参照样品(ISO10993-12:2002,IDT)
热塑性塑料熔体质量流动速率(MFR)及体积流动速率(MVR)的测量ISO1133塑料
ISO1628-1
塑料聚合物稀溶液粘数及特性粘数测定的标准方法指南第1部分:一般条件ASTMD149
ASTMD256
ASTMD570
ASTMD638
ASTMD648
ASTMD695
ASTMD696
ASIMD790
ASTMD792
ASTMD955
在工业用电频率下有关电绝缘材料介电击穿电压及介电强度的试验方法塑料Izod摆锤冲击强度试验方法塑料吸水率试验方法
塑料拉伸性能试验方法
弯曲载高作用下塑料挠曲温度试验方法刚性塑料压缩性能试验方法
一30之间:值用石英热膨胀计测定塑料线性热膨胀系数试验方法非增强塑料及电绝缘材料弯曲性能试验方法增强和
置换法测定
塑料的密度及
重(相对密度)的试验方法
根模具尺寸测定热塑性塑科的收缝量试验方注
利用熔融指数仪测定热塑性塑料的流速试验方法ASTMD123
50C利用密度梯度技术测定塑料密度试验方法ASTMD150
科制样操作规程
ASTMD1898
用差示扫描量热仪(DSC)对聚合体熔化热焙及结晶化进行测试的试验方法ASTMD34
利用差示扫描量热仪DS)测定案合易热转变温度的试验才法ASTMD34免费标准bzxz.net
ASTMD4000
针对塑料材料的分类系
大对材料及器械选择一
ASTMF748
般生物学试验方法的操作规程
外科植人物用的聚芳酮PAEK案合物的规范ASTMF1579
美国食品药品监督管理局,规则21CFR77.24152美国药典,XXI卷,或最新版本
3术语和定义
下列术语和定义适用于个标准。3.1
制品fabricated forms
由原料转化而成。通过机加工、挤出以及压缩铸模将原料(如纤维、管材、棒材、厚板、薄板、薄膜或复杂成形的部件及器械)转化成形状及形式3.2
合成复合物formulatedcompound由原料制造的含有期望或不期望助剂的PEEK材料,部件或器械。3.3
原料virginforms
通过反应签合成的PEEK聚合体形式。典型的形式为粒料或粉料。由原料可制成纤维,管材、棒材、厚板、薄板、薄膜或特殊部件及器械。1)摘自美国药典,12601TwinbrcokPkwy,Rockville,MD208522)摘自美国食品药品监督管理局,5600FisherLn,Rockville,MD25857.2
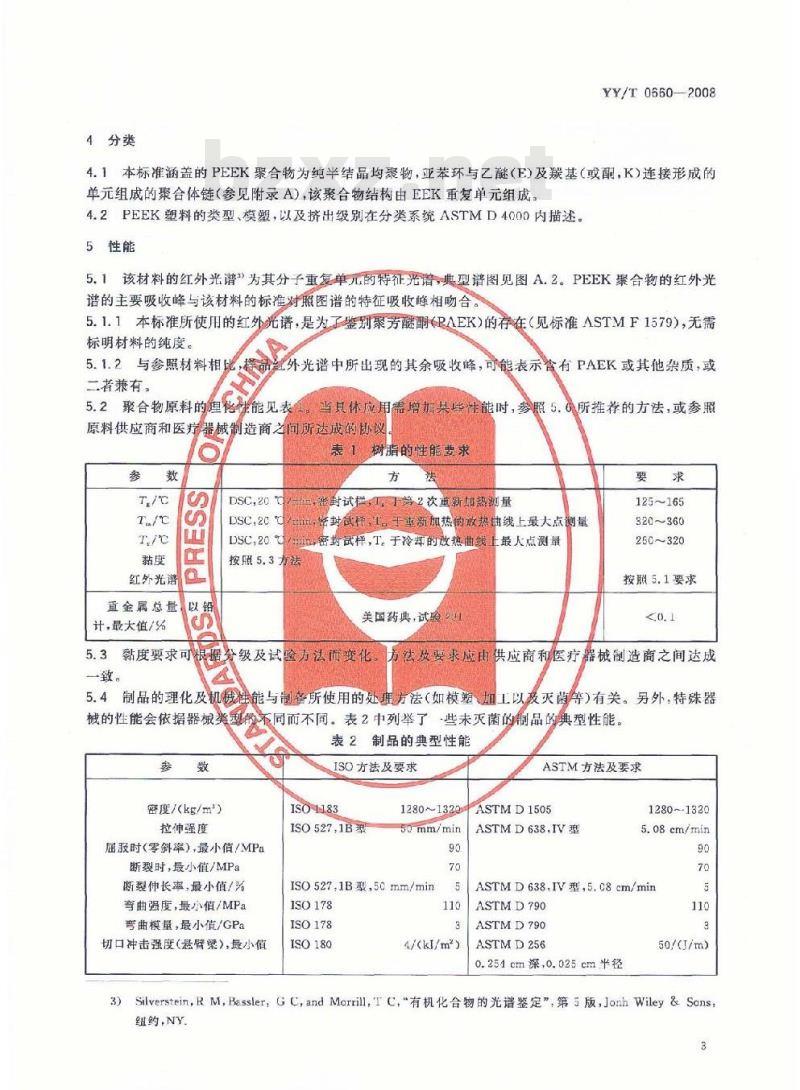
4分类
YY/T0660—2008
4.1本标准涵盖的PEEK聚合物为纯半结品均聚物,亚苯环与乙醚(E)及炭基(或酮,K)连接形成的单元组成的聚合体链(参见附录A),该聚合物结构由EEK重复单元组成。4.2PEEK塑料的类型、模塑,以及挤出级别在分类系统ASTMD4000内描述。5性能
5.1该材料的红外光谱”为其分子重复单儿的特征光谐,典型谱图见图A.2。PEEK聚合物的红外光谱的主要吸收峰与该材料的标准对照图谱的特征吸收峰相吻合。5.1.1本标准所使用的红外光谱,是为了鉴别聚芳醚酮(PAEK)的存在(见标准ASTMF1579),无需标明材料的纯度。
5.1.2与参照材料相比
二者兼有。
择品红外光谱中所出现的其余吸收峰,可能表示合有PAEK或其他杂质,或5.2聚合物原料的理化
生能见表
当具体应用需增加某性能时,参照5.6所推荐的方法,或参照原料供应商和医疗器械制造商之问所达成的协议表
红外光谱
直金属总量
计·最大值/%
DSC,20
DSC,20℃
DSC,20℃
按照5.3方法
树脂的性能要求
封试样,于第2次重新期热测量
学封武样,1手重新加热的政热由线上最大点创最密封试样,T,于冷却的放热曲线美国药典,试验1
上最人点测量
125165
920~360
260~320
按照5.1要求
黏度要求可根据分级及试验方法面变化,方法效要求应由供应商和医疗器械制造商之间达成5.3
一致。
5.4制品的理化及机械性能与制备所使用的处理方法(如模塑加工以及灭菌等)有关。另外,特殊器械的性能会依据器械类型不同而不同。表2中列举了一些未灭菌的制品的典型性能。表2制品的典型性能
密度/(kg/m)
拉伸强度
屈股时(零斜率),最小值/MPa断裂时,最小值/MPa
断裂伸长率,最小值/%
弯曲强度,最小值/MPa
弯曲模量,最小值/GPa
切口冲击强度(悬臂梁),最小值ISO方法及要求
ISO1183
ISO527.1B型
1280~1320
50.mm/min
ISO527.1B型,50mm/min
ISO178
ISO178
ISO180
4/(kJ/m2)
ASTM方法及要求
ASTMD1505
ASTMD638,IV型
1280~1320
5.08cm/min
ASTMD638.IV型.5.c8.cm/min
ASTMD790
ASTMD790
ASTMD256
0.254cm深,0.025cm半径
50/(/m)
3)Silverstein,RM,Bassler,GC,andMarrill,TC,“有机化合物的光谱鉴定”,第5版,JonhWiley&Sans纽约,NY.
YY/T 660—2008
5.5特测样品由聚合物或成品部件(机加工、注塑等)加工而成,这种方式可以有效地表征未灭菌成品部件的材料性能。
5.6试验及试验过程应该能确保对供应商提供的聚合物原料进行客观的检验及表征。以下是一些可能适用的试验方法:试验方法ASTMD119,试验法ASTMD256,试验方法ASTMD570,试验方法ASTM D 638,试验方法 ASTM D 648,测试方法 ASTM D 695,试验方法 ASTM I 696,试验方法ASTMD790,试验方法ASTMD792,试验方法ASTMD955,试验方法ASTMD1238,试验方法ASTMD1505,试验方法ASTMD3417,试验方法ASTMD3418,以及分类系统ASTMD4000。6制样
按照标准制样步骤对材料进行制样,如操作规范ASTMD1898中所描述的方法,用户与供应商之间达协议还可用其他制样技术。生物相容性
PEEK聚合物和使用这些材料制作的植人器械的生物相容性,应该按照操作规范ASTMF748和GB/T16886要求进行测定,包装商、医疗器械制造商和管理机构达成协议的除外。A.1基本原理
附录A
(资料性附录)
YY/T 0660--2008
A.1.1PEEK案合物可以通过多数适合热塑性聚合物的技术进行处理。用PFEK聚合物制造的医疗器械及医疗器械部件可被灭菌。可使用的灭菌方祛包括蒸汽、环氧乙烷以及射线灭菌。重复灭菌可以削弱任何塑料材料制成的部件的强度。PEEK部件在保证其性能的前提下的灭菌数决于很多因案,包括桑合物的分子量、设计制造、预期功能以及器械的灭菌方法。因此,制造商必须对器械进行测试,以确定安全使用的灭菌次数。A1.2结晶度水平可以反映该材料的特性。性能特点与结晶度百分比有关。某些添加剂及处理方法(如,过度交联)可以限制这些材料的结品能力。因此,应该使用适当的试验方法对桑合物及其制品的特性进行评帖,以确保其有效性。A,1.3合成复合物、如工部件及器械,可能含有制造过程或最终产品预期用途需要的助剂。这些助剂以及含助剂的合成复合物、部件以及器械的生物相容性,应该按照操作规范 ASTM F 748 或GB/T16886 进行评价。
A.2PEEK的化学结构
PEEK的化学结构见图A.1。
图 A.1 PEEK 的化学结构
A.3PEEK的典型红外光谱
PEEK的典型红外光谱见图A,2。
YY/T 0660—2008
1/(%)62.000
图A.2PEEK的典型红外光谱
考文献
YY/T0660—2008
[1]AutianJ,生物材料的毒理学评价:“王要急性毒性筛选方案”,人工器官杂志,第1卷第1期,1997年,第53页
E2]AutianJ.“塑料毒性方法及结果的新领域\,CRC毒理学关键综述,1973年,第18页[3]Homsy,CA,AnsevinKD,O'Brannan,W,等.“聚合物生物相容性的快速体外筛选\,人分手化学科学杂志,A1卷,第3期,1997年5月,第615-634页[41Rice,R M,Hegyeli,AF,Gourlay SJ等,“聚合材料的生物相容性测试:体外研究的体内相关性”,生物材料研究杂志,第12卷,1978年,第13页,YY/T 0660-2008
中华人民共和国医药
行业标准
外科植入物用疑醒醛酮(PEEK)
聚合物的标准规范
YY/T 0660-2008
中国标雅出版社出版发行
北京复兴门外三里河北街16 号
邮政编码:100045
网址 www, spc. net. cn
电话:6852394668517548
中国标准出版社秦皇岛印刷厂印刷各地新华书店经销
开本880×12301/16印张D.75字数14千字2008年9月第一版2008年9月第一次印周书号:1550662-19006定价14.00元如有印装差错由本社发行中心调换版权专有侵权必究
举报电话:(010)68533533
藕稚17bzw.cn脆熊干他铁干颛17jzw.com脆黛蜂
紅衰張科5鳍湖
他铁峰梁鹉轰
1桌60婴
8002—0990 L/Xx
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国医药行业标准
YY/T 0660—2008
外科植入物用聚醚醚酮(PEEK)聚合物的标准规范
Standard specification for polyetheretherketone(PEEK)polymers for surgical implant applications(ASTM F 2026-07,M0D)
2008-04-25发布
国家食品药品监督管理局
2009-06-01实施
YY/T0660—2008
本标准修改采用ASTMF2026-07《外科植人物用案醚醚酮(PEEK)聚合物的标准规范》,技术内容不变。
本标准与ASTMF2026-07的主要差异如下:一按照汉语芽惯对一些编排格式进行了髂改;将一些适用于美国标准的表述改为适用于我国标的表述;-将第2章“规范性引用文件”中已转化为国标的国际标准用转化的国标代替:将原文表1中的编辑性错误进行修改1-除第8章“关键词”。
本标准的附录 A为资料性附录,本标准由全国外科植入物和矫形器械标准化技术委员会提出并归口。本标准起草单位:国家食品药品监督管理局天津医疗器械质量监督检验中心。本标准主起草人,马春宝、樊铂、李沅、姜熙。1范围
外科植入物用聚醚醚酮(PEEK)聚合物的标准规范
YY/T 0660—2008
本标准涵盖了由原料供应商提供的PEEK聚合物原料(粒料、粉料等)。本标提供了当这些热塑性塑料制造用于人体的植入器械,诸如外科植入物、外科或牙科器械的部件时的要求和相关的试验方法。
任何·种材料,生产部件或器械时的加工技术(例如模塑、挤出、机加工、装配,灭菌等)均可改变其性能。这些骤合物成品的性能由原料供应商、医疗器械制造商以及管理机构所认可的合适的试验方法来进行试验,以确保其安全及有效性。标准中所包括的性能仅适用于骤醛醛酮聚合物。标准中要求的性能适用于注塑成型的产品。成品、材料或包含着色剂、填充剂、加工助剂或其他添加剂,以及混有PEEK合物的共混物或再生材料不在本标准范畴之内。
本标准片在推荐物理、化学以及生物学试验方法,针对医疗植入器械所使用的PEEK聚合物,确立其性能的合理可信度水平。在选择材料过程中,应按照最终使用要求考虑所列举的性能。当按照本标准的要求对材料进行评价时,可能涉及到危险性材料、操作以及仪器。本标准并非试图对所涉及到的所有安全问题进行阐述,即便是那些与其使用有关的安全问题。确立适当的安全及操作规范,以及在应用前明确理限制的适用性,是本标准用户自身的责任。2规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括断误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达或协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。GB/T16886.1—2001医疗器械生物学评价第1部分:评价与试验(idtISO10993-1:1997)GB/T16886.22000医疗器械生物学评价第2部分:动物保护要求(idtISO10993-2:1992)GB/T16886.3--1997
(idt IS0 10993-3:1992)
GB/T16886.1—2003
4:2002IDT)
GB/T 16886.5—2003
医疗器械生物学评价第3部分:遗传毒性、致癌性和生殖毒性试验医疗器械生物学评价第 4部分:与血液相万作用试验选择(ISO 10993医疗器械生物学评价第5部分:体外细胞毒性试验(ISO10993-5:1999,GB/T 16886.6—1997
医疗器械生物学评价第6部分:植人后局部反应试验(idtISO10993-4:1994)
GB/T 16886.7—2001
GB/T 16886, 9—2001
(idt ISO 10993-9 :1999)
GB/T16886.102005
(ISO10993-10.2002,DT)
医疗器械生物学评价第7部分:环氧乙烷灭菌残留量(idtIS010993-5:医疗器械生物学评价第9部分:潜在降解产物的定性和定最框架医疗器械生物学评价第10部分:刺激与迟发型超敏反应试验1
YY/T 0660-2008
GB/T16886.11—1997
医疗器械生物学评价第11部分:全身毒性试验(idtISO10993-11:1993)
GB/T16886.122005医疗器械生物学评价第12部分:样品制备与参照样品(ISO10993-12:2002,IDT)
热塑性塑料熔体质量流动速率(MFR)及体积流动速率(MVR)的测量ISO1133塑料
ISO1628-1
塑料聚合物稀溶液粘数及特性粘数测定的标准方法指南第1部分:一般条件ASTMD149
ASTMD256
ASTMD570
ASTMD638
ASTMD648
ASTMD695
ASTMD696
ASIMD790
ASTMD792
ASTMD955
在工业用电频率下有关电绝缘材料介电击穿电压及介电强度的试验方法塑料Izod摆锤冲击强度试验方法塑料吸水率试验方法
塑料拉伸性能试验方法
弯曲载高作用下塑料挠曲温度试验方法刚性塑料压缩性能试验方法
一30之间:值用石英热膨胀计测定塑料线性热膨胀系数试验方法非增强塑料及电绝缘材料弯曲性能试验方法增强和
置换法测定
塑料的密度及
重(相对密度)的试验方法
根模具尺寸测定热塑性塑科的收缝量试验方注
利用熔融指数仪测定热塑性塑料的流速试验方法ASTMD123
50C利用密度梯度技术测定塑料密度试验方法ASTMD150
科制样操作规程
ASTMD1898
用差示扫描量热仪(DSC)对聚合体熔化热焙及结晶化进行测试的试验方法ASTMD34
利用差示扫描量热仪DS)测定案合易热转变温度的试验才法ASTMD34免费标准bzxz.net
ASTMD4000
针对塑料材料的分类系
大对材料及器械选择一
ASTMF748
般生物学试验方法的操作规程
外科植人物用的聚芳酮PAEK案合物的规范ASTMF1579
美国食品药品监督管理局,规则21CFR77.24152美国药典,XXI卷,或最新版本
3术语和定义
下列术语和定义适用于个标准。3.1
制品fabricated forms
由原料转化而成。通过机加工、挤出以及压缩铸模将原料(如纤维、管材、棒材、厚板、薄板、薄膜或复杂成形的部件及器械)转化成形状及形式3.2
合成复合物formulatedcompound由原料制造的含有期望或不期望助剂的PEEK材料,部件或器械。3.3
原料virginforms
通过反应签合成的PEEK聚合体形式。典型的形式为粒料或粉料。由原料可制成纤维,管材、棒材、厚板、薄板、薄膜或特殊部件及器械。1)摘自美国药典,12601TwinbrcokPkwy,Rockville,MD208522)摘自美国食品药品监督管理局,5600FisherLn,Rockville,MD25857.2
4分类
YY/T0660—2008
4.1本标准涵盖的PEEK聚合物为纯半结品均聚物,亚苯环与乙醚(E)及炭基(或酮,K)连接形成的单元组成的聚合体链(参见附录A),该聚合物结构由EEK重复单元组成。4.2PEEK塑料的类型、模塑,以及挤出级别在分类系统ASTMD4000内描述。5性能
5.1该材料的红外光谱”为其分子重复单儿的特征光谐,典型谱图见图A.2。PEEK聚合物的红外光谱的主要吸收峰与该材料的标准对照图谱的特征吸收峰相吻合。5.1.1本标准所使用的红外光谱,是为了鉴别聚芳醚酮(PAEK)的存在(见标准ASTMF1579),无需标明材料的纯度。
5.1.2与参照材料相比
二者兼有。
择品红外光谱中所出现的其余吸收峰,可能表示合有PAEK或其他杂质,或5.2聚合物原料的理化
生能见表
当具体应用需增加某性能时,参照5.6所推荐的方法,或参照原料供应商和医疗器械制造商之问所达成的协议表
红外光谱
直金属总量
计·最大值/%
DSC,20
DSC,20℃
DSC,20℃
按照5.3方法
树脂的性能要求
封试样,于第2次重新期热测量
学封武样,1手重新加热的政热由线上最大点创最密封试样,T,于冷却的放热曲线美国药典,试验1
上最人点测量
125165
920~360
260~320
按照5.1要求
黏度要求可根据分级及试验方法面变化,方法效要求应由供应商和医疗器械制造商之间达成5.3
一致。
5.4制品的理化及机械性能与制备所使用的处理方法(如模塑加工以及灭菌等)有关。另外,特殊器械的性能会依据器械类型不同而不同。表2中列举了一些未灭菌的制品的典型性能。表2制品的典型性能
密度/(kg/m)
拉伸强度
屈股时(零斜率),最小值/MPa断裂时,最小值/MPa
断裂伸长率,最小值/%
弯曲强度,最小值/MPa
弯曲模量,最小值/GPa
切口冲击强度(悬臂梁),最小值ISO方法及要求
ISO1183
ISO527.1B型
1280~1320
50.mm/min
ISO527.1B型,50mm/min
ISO178
ISO178
ISO180
4/(kJ/m2)
ASTM方法及要求
ASTMD1505
ASTMD638,IV型
1280~1320
5.08cm/min
ASTMD638.IV型.5.c8.cm/min
ASTMD790
ASTMD790
ASTMD256
0.254cm深,0.025cm半径
50/(/m)
3)Silverstein,RM,Bassler,GC,andMarrill,TC,“有机化合物的光谱鉴定”,第5版,JonhWiley&Sans纽约,NY.
YY/T 660—2008
5.5特测样品由聚合物或成品部件(机加工、注塑等)加工而成,这种方式可以有效地表征未灭菌成品部件的材料性能。
5.6试验及试验过程应该能确保对供应商提供的聚合物原料进行客观的检验及表征。以下是一些可能适用的试验方法:试验方法ASTMD119,试验法ASTMD256,试验方法ASTMD570,试验方法ASTM D 638,试验方法 ASTM D 648,测试方法 ASTM D 695,试验方法 ASTM I 696,试验方法ASTMD790,试验方法ASTMD792,试验方法ASTMD955,试验方法ASTMD1238,试验方法ASTMD1505,试验方法ASTMD3417,试验方法ASTMD3418,以及分类系统ASTMD4000。6制样
按照标准制样步骤对材料进行制样,如操作规范ASTMD1898中所描述的方法,用户与供应商之间达协议还可用其他制样技术。生物相容性
PEEK聚合物和使用这些材料制作的植人器械的生物相容性,应该按照操作规范ASTMF748和GB/T16886要求进行测定,包装商、医疗器械制造商和管理机构达成协议的除外。A.1基本原理
附录A
(资料性附录)
YY/T 0660--2008
A.1.1PEEK案合物可以通过多数适合热塑性聚合物的技术进行处理。用PFEK聚合物制造的医疗器械及医疗器械部件可被灭菌。可使用的灭菌方祛包括蒸汽、环氧乙烷以及射线灭菌。重复灭菌可以削弱任何塑料材料制成的部件的强度。PEEK部件在保证其性能的前提下的灭菌数决于很多因案,包括桑合物的分子量、设计制造、预期功能以及器械的灭菌方法。因此,制造商必须对器械进行测试,以确定安全使用的灭菌次数。A1.2结晶度水平可以反映该材料的特性。性能特点与结晶度百分比有关。某些添加剂及处理方法(如,过度交联)可以限制这些材料的结品能力。因此,应该使用适当的试验方法对桑合物及其制品的特性进行评帖,以确保其有效性。A,1.3合成复合物、如工部件及器械,可能含有制造过程或最终产品预期用途需要的助剂。这些助剂以及含助剂的合成复合物、部件以及器械的生物相容性,应该按照操作规范 ASTM F 748 或GB/T16886 进行评价。
A.2PEEK的化学结构
PEEK的化学结构见图A.1。
图 A.1 PEEK 的化学结构
A.3PEEK的典型红外光谱
PEEK的典型红外光谱见图A,2。
YY/T 0660—2008
1/(%)62.000
图A.2PEEK的典型红外光谱
考文献
YY/T0660—2008
[1]AutianJ,生物材料的毒理学评价:“王要急性毒性筛选方案”,人工器官杂志,第1卷第1期,1997年,第53页
E2]AutianJ.“塑料毒性方法及结果的新领域\,CRC毒理学关键综述,1973年,第18页[3]Homsy,CA,AnsevinKD,O'Brannan,W,等.“聚合物生物相容性的快速体外筛选\,人分手化学科学杂志,A1卷,第3期,1997年5月,第615-634页[41Rice,R M,Hegyeli,AF,Gourlay SJ等,“聚合材料的生物相容性测试:体外研究的体内相关性”,生物材料研究杂志,第12卷,1978年,第13页,YY/T 0660-2008
中华人民共和国医药
行业标准
外科植入物用疑醒醛酮(PEEK)
聚合物的标准规范
YY/T 0660-2008
中国标雅出版社出版发行
北京复兴门外三里河北街16 号
邮政编码:100045
网址 www, spc. net. cn
电话:6852394668517548
中国标准出版社秦皇岛印刷厂印刷各地新华书店经销
开本880×12301/16印张D.75字数14千字2008年9月第一版2008年9月第一次印周书号:1550662-19006定价14.00元如有印装差错由本社发行中心调换版权专有侵权必究
举报电话:(010)68533533
藕稚17bzw.cn脆熊干他铁干颛17jzw.com脆黛蜂
紅衰張科5鳍湖
他铁峰梁鹉轰
1桌60婴
8002—0990 L/Xx
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。