SN/T 2530-2010
基本信息
标准号: SN/T 2530-2010
中文名称:贝类、果蔬和水样中脊髓灰质炎病毒检测方法 普通RT-PCR方法和实时荧光RT-PCR方法
标准类别:商检行业标准(SN)
标准状态:现行
发布日期:2010-03-02
实施日期:2010-09-16
出版语种:简体中文
下载格式:.rar .pdf
下载大小:1355545
相关标签: 贝类 果蔬 水样 病毒检测 方法 PCR 实时 荧光

标准分类号
关联标准
出版信息
出版社:中国标准出版社
标准价格:0.0 元
出版日期:2010-09-16
相关单位信息
发布部门:国家质量监督检验检疫总局
标准简介
SN/T 2530-2010 贝类、果蔬和水样中脊髓灰质炎病毒检测方法 普通RT-PCR方法和实时荧光RT-PCR方法 SN/T2530-2010 标准下载解压密码:www.bzxz.net
标准图片预览




标准内容
中华人民共和国出入境检验检疫行业标准SN/T 2530—2010
贝类、果蔬和水样中脊髓灰质炎病毒检测方法
普通RT-PCR方法和
实时荧光RT-PCR方法
Determination of polioviruses in shellfish,fruit,vegetable and water-ConventionalRT-PCRandreal-timeRT-PCR2010-03-02发布
中华人民共和国
国家质量监督检验检疫总局
2010-09-16实施
中华人民共和国出人境检验检疫行业标准
贝类、果蔬和水样中脊髓灰质炎病毒检测方法普通RT-PCR方法和
实时荧光RT-PCR方法
SN/T2530—2010
中国标准出版社出版
北京复兴门外三里河北街16号
邮政编码:100045
网址spc.net.cn
电话:6852394668517548
中国标准出版社秦皇岛印刷厂印刷*
开本880×12301/16印张1:字数25千字2010年5月第一版2010年5月第一次印刷印数1—1600
书号:155066·2-20869
定价18.00元
//foodmate.net
http:
本标准中附录A为规范性附录,附录B为资料性附录。本标准由国家认证认可监督管理委员会提出并归口。本标准起草单位:中华人民共和国上海出入境检验检疫局。本标准主要起草人:李想、潘良文、卢钟山、吕蓉、张舒亚、黄一、刘月明、高琴。本标准系首次发布的出入境检验检疫行业标准http://foodmate.netSN/T2530—2010
1范围
贝类、果蔬和水样中脊髓灰质炎病毒检测方法普通RT-PCR方法和
实时荧光RT-PCR方法
SN/T2530—2010
本标准规定了贝类、果蔬和水样中脊髓灰质炎病毒普通RT-PCR方法和实时荧光RT-PCR方法本标准适用于贝类、果蔬和水样中脊髓灰质炎病毒的定性检测。2规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准SN/T1193基因检验实验室技术要求3术语和定义
下列术语和定义适用于本标准。3.1
Ct值cyclethreshold
每个反应管内的荧光信号达到设定的域值时所经历的循环数。3.2
质粒标准分子plasmidreferencemolecule一种包含病毒特异性cDNA片段的重组质粒分子,可作为病毒PCR检测中的阳性对照。4方法提要
用合适的裂解液(如Tri-reagent)提取贝类样品中病毒RNA,并根据脊髓灰质炎病毒RNA3末端含有Poly(A)的结构,用连接Oligo(dT)25的磁珠特异性吸附脊髓灰质炎病毒RNA进行纯化。对水样中的病毒进行富集后,采用合适的方法提取和纯化病毒RNA。用合适的缓冲液洗脱果蔬样品表面病毒后,对病毒进行富集,并采用合适的方法提取纯化病毒RNA。利用普通RT-PCR或实时荧光RT-PCR方法进行检测。本研究通过构建质粒标准分子(每个质粒分子包含1拷贝扩增片段),确定适于I型、Ⅱ型、Ⅱ型脊髓灰质炎病毒检测的普通RT-PCR体系检测下限均为50拷贝,实时荧光RT-PCR体系检测下限均为2拷贝。
5试剂
所有实验用试剂均为分析纯;除特别说明外,实验用水为蒸馏水或去离子水。5.1阳性标本:脊髓灰质炎病毒,一80℃冰箱保存;或含脊髓灰质炎病毒检测目的片段的质粒标准分子,一20℃冰箱保存
5.2甘氨酸缓冲液:见A.1.1。
5.3PEG8000溶液:见A.1.2。
5.4PBS缓冲液:见A.1.3。
雪品伙伴网ht:
SN/T2530—2010
裂解液:Tri-reagent或其他等效裂解液(如:TRIzol)。Oligo(dT)25磁珠:Dynabeads-oligo(dT)25或等效品。超纯水(无RNase和DNase污染):见A.2.3。75%乙醇:见A.2.4。
三氯甲烷。
异丙醇。
1XRNA吸附缓冲液:见A.2.5。
2XRNA吸附缓冲液:见A.2.6。
漂洗缓冲液:见A.2.7。
5.14PrimeScriptTMRT reagentKit,TaKaRa,Cat.No.DRR037S。5.15BlendTa-PlusDNA聚合酶及配套缓冲液和dNTPs,ToYoBo,Cat.No.BTQ-201。5.16PremixExTaqTM(PerfectRealTime)及配套ROX荧光校正试剂(50×).TaKaRa,Cat.No.DRR039A
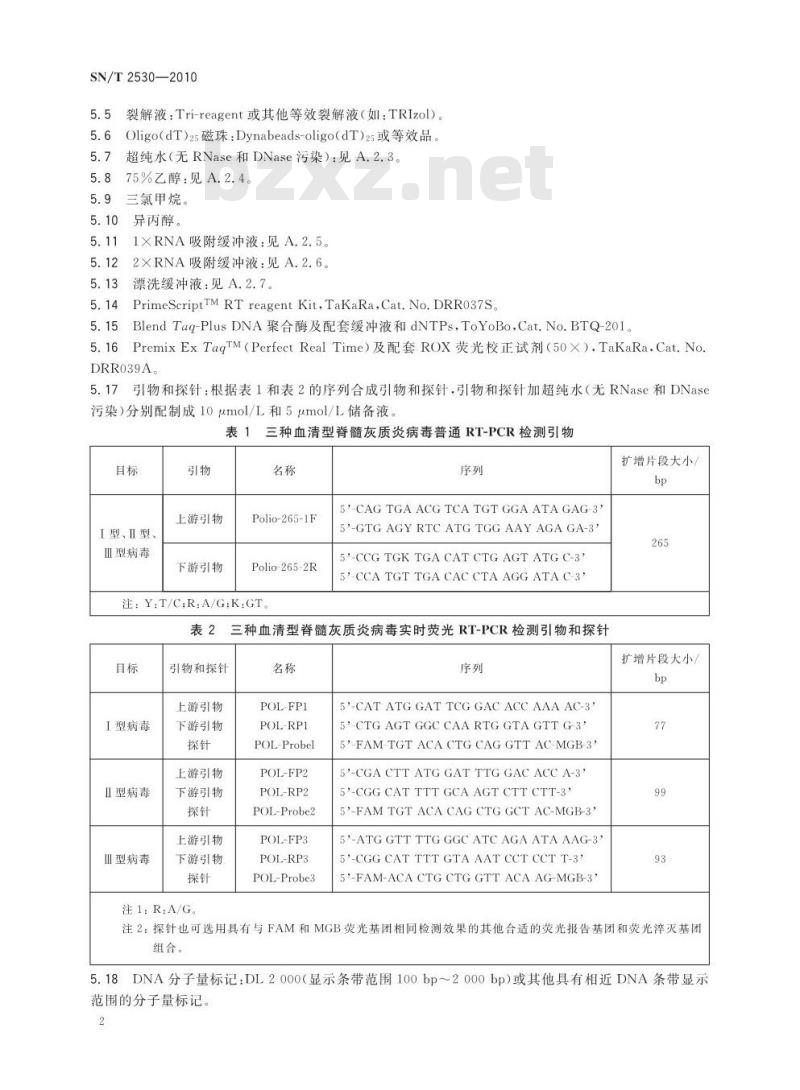
5.17引物和探针:根据表1和表2的序列合成引物和探针,引物和探针加超纯水(无RNase和DNase污染)分别配制成10umol/L和5umol/L储备液表1三种血清型脊髓灰质炎病毒普通RT-PCR检测引物目标
I型、I型、
皿型病毒
上游引物
下游引物
Polio-265-1F
Polio-265-2R
注: Y.T/C,R.A/G;K.GT.
5-CAGTGAACGTCATGTGGAATAGAG-35'-GTGAGYRTCATGTGGAAYAGAGA-35'-CCGTGKTGACAT CTGAGTATGC-3*5-CCATGT TGA CACCTAAGGATAC-3表2
三种血清型脊髓灰质炎病毒实时荧光RT-PCR检测引物和探针目标
I型病毒
Ⅱ型病毒
Ⅲ型病毒
引物和探针
上游引物
下游引物
上游引物
下游引物
上游引物
下游引物
注1:R:A/G。
POL-FP1
POL-RP1
POL-Probel
POL-FP2
POL-RP2
POL-Probe2
POL-FP3
POL-RP3
POL-Probe3
5'-CAT ATG GAT TCG GAC ACCAAA AC-3'5CTG AGT GGC CAA RTG GTA GTT G-3\5-FAM-TGTACACTGCAGGTTAC-MGB-3'5-CGACTTATGGATTTGGACACCA-3'
5'-CGGCAT TTT GCA AGT CTT CTT-3'5°-FAM TGT ACA CAG CTG GCT AC-MGB-3'5'-ATGGTTTTGGGCATCAGAATAAAG-3*5'-CGGCAT TTTGTA AAT CCT CCT T-3*5'-FAM-ACA CTG CTG GTT ACA AG-MGB-3\扩增片段大小
扩增片段大小/
注2:探针也可选用具有与FAM和MGB荧光基团相同检测效果的其他合适的荧光报告基团和荧光淬灭基团组合。
5.18DNA分子量标记:DL2000(显示条带范围100bp~2000bp)或其他具有相近DNA条带显示范围的分子量标记。
http:
950XTAE缓冲液:见A.1.4。
溴化乙锭(EB)溶液(10mg/mL):见A.1.5。含0.5ug/mL漠化乙锭(EB)的1.5%琼脂糖凝胶:见A.1.6。5.21
5.2210×加样缓冲液:见A.1.7。5.23QIAampViralRNAMiniKit.Qiagen,Cat.No.52904:见A.2.8。6仪器
实时荧光PCR仪。
6.2PCR仪。
6.3电泳仪。
凝胶成像分析系统
6.5冷冻离心机。
6.6勾浆器。
6.7恒温孵育器。
6.8振荡器。
6.9微量加样器:2.5μ、10μL、100μL、200μL和1mL。6.10
高压灭菌锅。
生物安全柜。
-80℃冰箱,-20℃冰箱。
6.13无RNase和DNase污染的玻璃容器:见附录A.2.1。SN/T2530—2010
6.14无RNase和DNase污染的离心管(1.5mL、15mL,50mL).无RNase和DNase污染的移液器吸嘴(10μL、200μL、1mL)无RNase和DNase污染的药匙、无RNase和DNase污染的0.2mLPCR扩增反应管,无RNase和DNase污染聚乙烯薄膜袋:见附录A.2.26.15磁性抽提架。
6.16已灭菌直径为47mm,孔径为0.45um的乙酸/硝酸混合纤维素滤膜[密理博(上海)贸易有限公司,Cat.No.R7SN20186]及配套过滤器。6.17无菌一次性50mL针管
6.18乙烯薄膜袋:50mm×70mm自封袋,使用前紫外杀菌20min。7检测方法
7.1实验室要求
实验室设施应达到SN/T1193实验室技术要求7.2样品制备和脊髓灰质炎病毒RNA提取7.2.1贝类样品中脊髓灰质炎病毒RNA提取7.2.1.1小心切开贝类样品组织,解剖取下贝类的肠腺组织。7.2.1.2取5g左右肠腺组织加入35mL甘氨酸缓冲液7.2.1.3使用匀浆器高速匀浆3min~5min,使肠腺组织完全被打碎并与缓冲液混合均匀,将匀浆液装人50mL离心管,250r/min37℃或室温振荡30min。7.2.1.4将样品匀浆液于4℃,10000g离心30min。7.2.1.5移取上清液至一新的50mL离心管,加人等体积的PEG8000溶液,颠倒混匀5次。冰上放置至少1h后,4℃,10000g离心5min,弃尽上清液,保留沉淀。7.2.1.6向沉淀中加入5mL裂解液,剧烈振荡30s.室温放置5min转移溶液至一15mL离心管,加人1.2mL三氯甲烷,剧烈振荡30s,室温放置5min,7. 2. 1. 7
12000g离心5min,吸取上清液至另一15mL离心管。3
雪品伙伴双ht
SN/T2530-—2010
7.2.1.8向上清液中加人0.5倍体积(约2.5mL)异丙醇,颠倒混匀后,室温放置5min,4℃,5000g离心5min
7.2.1.9弃尽上清液,用5mL,4℃预冷的75%乙醇洗涤沉淀。7.2.1.10重复步骤7.2.1.9两次,最后一次弃尽上清液。7.2.1.11沉淀重悬于300μL超纯水(无RNase和DNase污染)中,将悬液转移至一1.5mL离心管中。
2加人400μL1×RNA吸附缓冲液,振荡30s,60℃放置3min7.2.1.12
7. 2. 1. 13
加人100uLOligo(dT)25磁珠,轻柔混合,磁性抽提架上放置1min。4弃尽上清液,加入500μL2XRNA吸附缓冲液,室温下晃动5min洗涤。7.2.1.14
5离心管在磁性抽提架上放置1min,弃尽上清液。加人500μL漂洗缓冲液,颠倒混匀5次,7.2.1.15
离心管在磁性抽提架上放置1min,弃去上清液。7.2.1.16重复步骤7.2.1.15三次。7.2.1.17沉淀用100μL超纯水(无RNase和DNase污染)悬浮,90℃放置2min释放RNA。离心管在磁性抽提架上放置1min将上清液移至另一1.5mL离心管中,可即吸取5μL进行RT-PCR检测7.2.2水样中脊髓灰质炎病毒RNA提取(使用Qiagen公司QIAampViralRNAMiniKit)7.2.2.1用50mL针管分次取100mL~200mL水样过一直径为47mm,孔径为0.45um的乙酸/硝酸混合纤维素滤膜,小心取出滤膜,平整放于聚乙烯薄膜袋中。7.2.2.2向薄膜袋中加入1130μLBufferAVL-carrierRNA混合液,使滤膜充分浸于缓冲液中。剧烈振荡15s~30s,室温浸泡滤膜20min~30min后,小心将液体完全转移到15mL离心管中。7.2.2.3(可选步骤)若回收液体中存在明显可见的固体物质,4000g离心3min,转移上清液至一新15mL离心管中。
7.2.2.4加人1120uL无水乙醇,剧烈振荡15s,5000g离心15s收集液体。7.2.2.5将上述液体630μL转移至带有2mL收集管的离心柱中,6000g离心1min.弃收集管中液体。
7.2.2.6重复步骤7.2.2.5,直至所有混合液均通过离心柱,最后一次离心后将离心柱放入一新2mL收集管中。
7.2.2.7加人500μLBufferAW1,6000g离心1min,将离心柱放入一新2mL收集管中。7.2.2.8加人500μLBufferAW2,20000g离心3min。7.2.2.9将离心柱放入一新2mL收集管中,20000g离心1min以彻底除去残余在离心柱膜上液体7.2.2.10将离心柱放入一新1.5mL离心管中,小心的在离心柱膜中央加入60μLBufferAVE,室温放置1min~2min,6000g离心1min。1.5mL离心管中的液体即为提取的病毒RNA样品,可即吸取5μL进行RT-PCR检测
7.2.3蔬菜和水果样品中脊髓灰质炎病毒RNA提取1>(使用Qiagen公司QIAampViralRNAMiniKit)
7.2.3.1取15g左右水果或蔬菜样品装人50mL离心管中,加人35mL甘氨酸缓冲液(pH9.5),250r/min37℃或室温振荡30min
7.2.3.2将装有水果或蔬菜样品的混合液于4℃,12000g离心30min。7.2.3.3转移上清液至一新50mL离心管,加人等体积PEG8000溶液,颠倒混匀5次。4℃放置过夜,4℃,12000g离心30min,弃尽上清液,保留沉淀。1)水样和果蔬样品中病毒RNA的提取方法是针对QIAampViralRNAMiniKit,Qiagen,Cat.No.52904给出的给出这一信息是为了方便本标准使用者,并不表示只认可该产品,如果其他等效产品具有相同的效果,则可使用等效产品。
雪品伙伴欧ht
SN/T2530—2010
7.2.3.4向沉淀中加人140μLPBS缓冲液使沉淀完全悬浮,加人565μLBufferAVL-carrierRNA混合液,剧烈振荡15s~30s,室温放置10min。7.2.3.5加人560uL无水乙醇,剧烈振荡15s,5000g离心15s收集液体。将上述液体630μL转移至带有2mL收集管的离心柱中,6000g离心1min,弃收集管中7.2.3.6
液体。
重复步骤7.2.3.6,将离心柱放人一新2mL收集管中。7.2.3.8
加人500μLBufferAW1,6000g离心1min,将离心柱放入一新的2mL收集管中。7.2.3.9
液体。
加人500uLBufferAW2.20000g离心3min。将离心柱放入一新2mL收集管中,20000g离心1min以彻底除去残余在离心柱膜上7.2.3.11将离心柱放人一新1.5mL离心管中,小心的在离心柱膜中央加人60μLBufferAVE,室温放置1min~2min,6000g离心1min。1.5mL离心管中的液体即为提取的病毒RNA样品,可即吸取5μL进行RT-PCR检测。
7.3RT-PCR检测
7.3.1普通RT-PCR
7.3.1.1普通RT-PCR反应体系
病毒RNA逆转录为cDNA的反应体系见表3,PCR反应体系见表4。反应体系中各试剂的量可根据不同试剂盒进行适当调整。每个反应体系设置两个平行反应。以脊髓灰质炎病毒cDNA或含脊髓灰质炎病毒检测目的片段的质粒标准分子DNA作为阳性对照模板,以不含有脊髓灰质炎病毒cDNA或脊髓灰质炎病毒检测目的片段质粒标准分子DNA的样品作为阴性对照模板,以水代替模板作为空白对照。
病毒RNA逆转录反应体系1)
逆转录反应缓冲液
转录酶
Oligo dTPrimer
Random 6 mers
模板RNA
超纯水(无RNase和DNase污染)总体积
储液浓度
50μmol/L
100μmol/L
终浓度
2.5μmol/L
5μmol/L
表4三种血清型脊髓灰质炎病毒普通PCR反应体系2名
PCR反应缓冲液
引物Polio-265-1F
储液浓度
10mmol/L
10μmol/L
终浓度
0.2mmol/L
0.4μmol/L
使用量/μL
使用量/μL
该反应体系针对PrimeScriptRTreagentKit,TaKaRa,Cat.No.DRRo37S给出,给出这一信息是为了方便本标准使用者,并不表示只认可该产品,如果其他等效产品具有相同的效果,则可使用等效产品该反应体系针对BlendTag-PlusDNA聚合酶及配套缓冲液和dNTPs:ToYoBo,Cat.No.BTQ-2o1给出·给出2)
这一信息是为了方便本标准使用者,并不表示只认可该产品,如果其他等效产品具有相同的效果,则可使用等效产品。
btt
SN/T2530—2010
引物Polio-265-2R
BlendTaq-plusDNA聚合酶
超纯水(无RNase和DNase污染)总体积
7.3.1.2普通RT-PCR反应参数!
表4(续)
储液浓度
10μmol/L
终浓度
0.4μmol/L
0.05U/μL
病毒RNA逆转录为cDNA的反应参数:37℃,20min;85℃,5s;使用量/uL
普通PCR反应参数:94℃.2min;94℃.30s58℃.30s,72℃.30s,40个循环。72℃.5min。7.3.1.3PCR产物的琼脂糖凝胶电泳检测将适量50XTAE稀释成1×TAE溶液,配制溴化乙锭含量为0.5μg/mL的1.5%琼脂糖凝胶。取PCR产物15μL,加1.5μL上样缓冲液点样进行电泳,并在其中一孔道加人DNA分子量标记以判断PCR产物的片段大小。电压大小根据电泳槽长度来确定,一般控制在3V/cm~5V/cm,当溴酚蓝移动到凝胶边缘时关闭电源,电泳检测结果用凝胶成像分析系统记录。7.3.1.4普通RT-PCR检测下限
I型、Ⅱ型、Ⅱ型脊髓灰质炎病毒普通RT-PCR体系检测下限均为50拷贝质粒标准分子DNA。7.3.2实时荧光RT-PCR
7.3.2.1实时荧光RT-PCR反应体系病毒RNA逆转录为cDNA的反应体系见表3.PCR反应体系见表5,表6。每个反应体系设置两个平行反应。其中POL-FP1/RP1/Probel用于I型脊髓灰质炎病毒的实时荧光RT-PCR检测;POLFP2/RP2/Probe2用于Ⅱ型脊髓灰质炎病毒的实时荧光RT-PCR检测;POL-FP3/RP3/Probe3用于Ⅲ型脊髓灰质炎病毒的实时荧光RT-PCR检测。三对引物和探针可分别用于I、Ⅱ、Ⅲ型脊髓灰质炎病毒的检测,检测体系见表5。对三种血清型脊髓灰质炎病毒也可实施同时检测(同一反应管检测),即将三对引物和三条探针同时加入反应管,反应体系见表6。以脊髓灰质炎病毒cDNA或含脊髓灰质炎病毒检测目的片段的质粒标准分子DNA作为阳性对照模板,以不含有脊髓灰质炎病毒cDNA或脊髓灰质炎病毒检测目的片段的质粒标准分子DNA的样品作为阴性对照模板,以水代替模板作为空白对照。表5对三种血清型脊髓灰质炎病毒分别进行实时荧光RT-PCR检测的反应体系2名称
PremixExTaqTM(PerfectReal Time)引物POL-FP1a
引物POL-RP1
探针POL-Probel
ROX荧光校正试剂(50×)b
超纯水(无RNase和DNase污染)储液浓度
10μmol/L
10μmol/L
5μmol/L
反应参数可根据不同型号PCR仪及PCR反应体系作适当调整1)
终浓度
0.2μmol/L
0.2μmol/L
0.2μmol/L
使用量/μL
该反应体系针对PremixExTaqTM(PerfectRealTime)及配套ROX荧光校正试剂(5oX),TaKaRa,Cat.No.2)
DRR039A给出,给出这一信息是为了方便本标准使用者,并不表示只认可该产品,如果其他等效产品具有相同的校果,则可使用等效产品。
htt
总体积
表5(续)
储液浓度
终浓度
SN/T2530—2010
使用量/uL
当对IⅡI型脊髓灰质炎病毒进行检测时引物和探针分别为POL-FP2/POL-RP2,POL-Probe2;当对Ⅲ型脊髓灰质炎病毒进行检测时,引物和探针分别为POL-FP3/POL-RP3,POL-Probe3。b该试剂只在具有ROX荧光通道校正的实时荧光PCR仪上进行扩增时添加,否则用水补齐。5对三种血清型脊髓灰质炎病毒同时进行实时荧光RT-PCR检测的反应体系5)表6
PremixExTaqTM(PerfectReal Time)引物POL-FPI
引物POL-RP1
探针POL-Probel
引物POL-FP2
引物 POL-RP2
探针POL-Probe2
引物POL-FP3
引物POL-RP3
探针POL-Probe3
ROX荧光校正试剂(50X)
超纯水(无RNase和DNase污染)总体积
储液浓度
10μmol/L
10μmol/L
5μmol/L
10μmol/L
10μmol/L
5yμmol/L
10μmol/L
10μmol/L
5μmol/L
终浓度
0.2μmol/L
0.2μmol/L
0.2μmol/L
0.2μmol/L
0.2μmol/L
0.2μmol/L
0.2μmol/L
0.2μmol/L
0.2μmol/L
a该试剂只在具有ROX荧光校正通道的实时荧光PCR仪上进行扩增时添加·否则用水补齐实时荧光RT-PCR反应参数
病毒RNA逆转录为cDNA的反应参数:37℃,20min;85℃,5s;使用量/uL
对三种血清型脊髓灰质炎病毒分别进行实时荧光PCR检测的反应参数:95℃,10s;95℃,5s,60℃,31s45个循环;对三种血清型脊髓灰质炎病毒同时进行实时荧光PCR检测的反应参数:95℃,10s95℃.5s,60℃31s,45个循环7.3.2.3
实时荧光RT-PCR检测下限
对I型、IⅡI型、ⅡⅢ型脊髓灰质炎病毒分别检测的实时荧光RT-PCR体系检测下限均为2拷贝质粒标准分子DNA;对三种血清型脊髓灰质炎病毒同时检测的实时荧光RT-PCR体系检测下限为2拷贝质粒标准分子DNA。
结果判断及表述
结果判定
普通RT-PCR
阴性对照和空白对照未出现条带.阳性对照出现265bp的目的扩增条带则表明反应体系运行反应参数可根据不同型号PCR仪及PCR反应体系作适当调整,1
httr
oodmate:net
SN/T2530-—2010
正常,否则需重新进行普通PCR扩增;对样品进行普通RT-PCR检测,如果阴性对照和空白对照未出现条带,阳性对照出现265bpb)
的扩增条带,而样品未出现扩增条带,则可判定样品脊髓灰质炎病毒阴性;c)如果阴性对照和空白对照未出现条带,阳性对照和样品出现265bp的扩增条带,对PCR产物进行测序分析比对,PCR产物核酸序列与相应的脊髓灰质炎病毒cDNA序列相一致,则可判定样品脊髓灰质炎病毒阳性。也可采用本标准中实时荧光RT-PCR的方法进行确证8.1.2实时荧光RT-PCR
8.1.2.1对三种血清型脊髓灰质炎病毒进行分别检测的结果判定对三种血清型脊髓灰质炎病毒进行分别检测时,阴性对照和空白对照无荧光增幅现象,阳性对照有荧光增幅现象则表明反应体系运行正常,否则需重新进行实时荧光PCR扩增。a)若待检测样品无荧光增幅现象,则判定样品未检出该型脊髓灰质炎病毒;b)若待检测样品有荧光增幅现象,且Ct值≤40时,则判定样品检出该型脊髓灰质炎病毒;c)若待检测样品Ct值介于40和45之间时,应重新进行实时荧光RT-PCR检测。重新检测后设定同一域值条件下,若Ct值≥45时,则判定样品未检出该型脊髓灰质炎病毒。重新检测后的Ct值仍介于40和45之间,则判定样品检出该型脊髓灰质炎病毒。8.1.2.2对三种血清型脊髓灰质炎病毒进行同时扩增的结果判定对三种血清型脊髓灰质炎病毒进行同时扩增时,阴性对照和空白对照无荧光增幅现象,阳性对照有荧光增幅现象则表明反应体系运行正常,否则需重新进行实时荧光PCR扩增。a)若待检测样品无荧光增幅现象,则判定样品未检出脊髓灰质炎病毒;b)若待检测样品有荧光增幅现象,且Ct值≤40时,则判定样品检出脊髓灰质炎病毒;C)若待检测样品Ct值介于40和45之间时,应重新进行实时荧光RT-PCR检测。重新检测后设定同一域值条件下,若Ct值≥45时,则判定样品未检出脊髓灰质炎病毒。重新检测后的Ct值仍介于40和45之间,则判定样品检出脊髓灰质炎病毒8.2结果表述bzxz.net
8.2.1根据8.1描述判定检出脊髓灰质炎病毒,则表述为检出脊髓灰质炎病毒或脊髓灰质炎病毒阳性。
8.2.2根据8.1描述判定未检出脊髓灰质炎病毒,则表述为未检出脊髓灰质炎病毒或脊髓灰质炎病毒阴性。
http
TTTETTETT
A.1普通溶液的配制
附录A
(规范性附录)
溶液的配制
SN/T2530—2010
甘氨酸缓冲液:含0.1mol/L甘氨酸,0.3mol/L氯化钠(NaCI),pH9.5甘氨酸A.1.1
甘氨酸
氯化钠
双蒸水
5mol/L氢氧化钠溶液
加双蒸水至1000mL.121℃,15min灭菌备用7.5g
调pH至9.5
A.1.2PEG8000溶液:含16%(质量浓度)PEG8000.0.525mol/L氯化钠PEG8000
氯化钠
加双蒸水至100mL,121℃,15min灭菌备用。A.1.3PBS缓冲液(20×).pH7.5氯化钠
氯化钾
磷酸氢二钠
磷酸二氢钾
双蒸水
1mol/L盐酸
调pH至7.5
加双蒸水至1000mL,121℃,15min灭菌备用使用时用灭菌双蒸水稀释至1×使用。A.1.450×TAE缓冲液
A.1.4.10.5mol/LEDTA-Na2·2H2O(二水乙二铵四乙酸钠)溶液·pH8.0EDTA-Na2·2H20
灭菌双蒸水
5mol/L氢氧化钠溶液
调pH至8.0
灭菌双蒸水加至1000mL,121℃,15min灭菌备用。A.1.4.2TAE电泳缓冲液(50×)羟基甲基氨基甲烷(Tris)
冰乙酸
0.5mol/LEDTA-Na2溶液,pH 8.0
灭菌双蒸水加至1000mL,121℃,15min灭菌备用。使用时用灭菌双蒸水稀释至1×使用。A.1.5溴化乙锭(EB)溶液(10mg/mL)EB
灭菌双蒸水
A.1.6含0.5μg/mL溴化乙锭(EB)的1.5%琼脂糖凝胶琼脂糖
ht
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
贝类、果蔬和水样中脊髓灰质炎病毒检测方法
普通RT-PCR方法和
实时荧光RT-PCR方法
Determination of polioviruses in shellfish,fruit,vegetable and water-ConventionalRT-PCRandreal-timeRT-PCR2010-03-02发布
中华人民共和国
国家质量监督检验检疫总局
2010-09-16实施
中华人民共和国出人境检验检疫行业标准
贝类、果蔬和水样中脊髓灰质炎病毒检测方法普通RT-PCR方法和
实时荧光RT-PCR方法
SN/T2530—2010
中国标准出版社出版
北京复兴门外三里河北街16号
邮政编码:100045
网址spc.net.cn
电话:6852394668517548
中国标准出版社秦皇岛印刷厂印刷*
开本880×12301/16印张1:字数25千字2010年5月第一版2010年5月第一次印刷印数1—1600
书号:155066·2-20869
定价18.00元
//foodmate.net
http:
本标准中附录A为规范性附录,附录B为资料性附录。本标准由国家认证认可监督管理委员会提出并归口。本标准起草单位:中华人民共和国上海出入境检验检疫局。本标准主要起草人:李想、潘良文、卢钟山、吕蓉、张舒亚、黄一、刘月明、高琴。本标准系首次发布的出入境检验检疫行业标准http://foodmate.netSN/T2530—2010
1范围
贝类、果蔬和水样中脊髓灰质炎病毒检测方法普通RT-PCR方法和
实时荧光RT-PCR方法
SN/T2530—2010
本标准规定了贝类、果蔬和水样中脊髓灰质炎病毒普通RT-PCR方法和实时荧光RT-PCR方法本标准适用于贝类、果蔬和水样中脊髓灰质炎病毒的定性检测。2规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准SN/T1193基因检验实验室技术要求3术语和定义
下列术语和定义适用于本标准。3.1
Ct值cyclethreshold
每个反应管内的荧光信号达到设定的域值时所经历的循环数。3.2
质粒标准分子plasmidreferencemolecule一种包含病毒特异性cDNA片段的重组质粒分子,可作为病毒PCR检测中的阳性对照。4方法提要
用合适的裂解液(如Tri-reagent)提取贝类样品中病毒RNA,并根据脊髓灰质炎病毒RNA3末端含有Poly(A)的结构,用连接Oligo(dT)25的磁珠特异性吸附脊髓灰质炎病毒RNA进行纯化。对水样中的病毒进行富集后,采用合适的方法提取和纯化病毒RNA。用合适的缓冲液洗脱果蔬样品表面病毒后,对病毒进行富集,并采用合适的方法提取纯化病毒RNA。利用普通RT-PCR或实时荧光RT-PCR方法进行检测。本研究通过构建质粒标准分子(每个质粒分子包含1拷贝扩增片段),确定适于I型、Ⅱ型、Ⅱ型脊髓灰质炎病毒检测的普通RT-PCR体系检测下限均为50拷贝,实时荧光RT-PCR体系检测下限均为2拷贝。
5试剂
所有实验用试剂均为分析纯;除特别说明外,实验用水为蒸馏水或去离子水。5.1阳性标本:脊髓灰质炎病毒,一80℃冰箱保存;或含脊髓灰质炎病毒检测目的片段的质粒标准分子,一20℃冰箱保存
5.2甘氨酸缓冲液:见A.1.1。
5.3PEG8000溶液:见A.1.2。
5.4PBS缓冲液:见A.1.3。
雪品伙伴网ht:
SN/T2530—2010
裂解液:Tri-reagent或其他等效裂解液(如:TRIzol)。Oligo(dT)25磁珠:Dynabeads-oligo(dT)25或等效品。超纯水(无RNase和DNase污染):见A.2.3。75%乙醇:见A.2.4。
三氯甲烷。
异丙醇。
1XRNA吸附缓冲液:见A.2.5。
2XRNA吸附缓冲液:见A.2.6。
漂洗缓冲液:见A.2.7。
5.14PrimeScriptTMRT reagentKit,TaKaRa,Cat.No.DRR037S。5.15BlendTa-PlusDNA聚合酶及配套缓冲液和dNTPs,ToYoBo,Cat.No.BTQ-201。5.16PremixExTaqTM(PerfectRealTime)及配套ROX荧光校正试剂(50×).TaKaRa,Cat.No.DRR039A
5.17引物和探针:根据表1和表2的序列合成引物和探针,引物和探针加超纯水(无RNase和DNase污染)分别配制成10umol/L和5umol/L储备液表1三种血清型脊髓灰质炎病毒普通RT-PCR检测引物目标
I型、I型、
皿型病毒
上游引物
下游引物
Polio-265-1F
Polio-265-2R
注: Y.T/C,R.A/G;K.GT.
5-CAGTGAACGTCATGTGGAATAGAG-35'-GTGAGYRTCATGTGGAAYAGAGA-35'-CCGTGKTGACAT CTGAGTATGC-3*5-CCATGT TGA CACCTAAGGATAC-3表2
三种血清型脊髓灰质炎病毒实时荧光RT-PCR检测引物和探针目标
I型病毒
Ⅱ型病毒
Ⅲ型病毒
引物和探针
上游引物
下游引物
上游引物
下游引物
上游引物
下游引物
注1:R:A/G。
POL-FP1
POL-RP1
POL-Probel
POL-FP2
POL-RP2
POL-Probe2
POL-FP3
POL-RP3
POL-Probe3
5'-CAT ATG GAT TCG GAC ACCAAA AC-3'5CTG AGT GGC CAA RTG GTA GTT G-3\5-FAM-TGTACACTGCAGGTTAC-MGB-3'5-CGACTTATGGATTTGGACACCA-3'
5'-CGGCAT TTT GCA AGT CTT CTT-3'5°-FAM TGT ACA CAG CTG GCT AC-MGB-3'5'-ATGGTTTTGGGCATCAGAATAAAG-3*5'-CGGCAT TTTGTA AAT CCT CCT T-3*5'-FAM-ACA CTG CTG GTT ACA AG-MGB-3\扩增片段大小
扩增片段大小/
注2:探针也可选用具有与FAM和MGB荧光基团相同检测效果的其他合适的荧光报告基团和荧光淬灭基团组合。
5.18DNA分子量标记:DL2000(显示条带范围100bp~2000bp)或其他具有相近DNA条带显示范围的分子量标记。
http:
950XTAE缓冲液:见A.1.4。
溴化乙锭(EB)溶液(10mg/mL):见A.1.5。含0.5ug/mL漠化乙锭(EB)的1.5%琼脂糖凝胶:见A.1.6。5.21
5.2210×加样缓冲液:见A.1.7。5.23QIAampViralRNAMiniKit.Qiagen,Cat.No.52904:见A.2.8。6仪器
实时荧光PCR仪。
6.2PCR仪。
6.3电泳仪。
凝胶成像分析系统
6.5冷冻离心机。
6.6勾浆器。
6.7恒温孵育器。
6.8振荡器。
6.9微量加样器:2.5μ、10μL、100μL、200μL和1mL。6.10
高压灭菌锅。
生物安全柜。
-80℃冰箱,-20℃冰箱。
6.13无RNase和DNase污染的玻璃容器:见附录A.2.1。SN/T2530—2010
6.14无RNase和DNase污染的离心管(1.5mL、15mL,50mL).无RNase和DNase污染的移液器吸嘴(10μL、200μL、1mL)无RNase和DNase污染的药匙、无RNase和DNase污染的0.2mLPCR扩增反应管,无RNase和DNase污染聚乙烯薄膜袋:见附录A.2.26.15磁性抽提架。
6.16已灭菌直径为47mm,孔径为0.45um的乙酸/硝酸混合纤维素滤膜[密理博(上海)贸易有限公司,Cat.No.R7SN20186]及配套过滤器。6.17无菌一次性50mL针管
6.18乙烯薄膜袋:50mm×70mm自封袋,使用前紫外杀菌20min。7检测方法
7.1实验室要求
实验室设施应达到SN/T1193实验室技术要求7.2样品制备和脊髓灰质炎病毒RNA提取7.2.1贝类样品中脊髓灰质炎病毒RNA提取7.2.1.1小心切开贝类样品组织,解剖取下贝类的肠腺组织。7.2.1.2取5g左右肠腺组织加入35mL甘氨酸缓冲液7.2.1.3使用匀浆器高速匀浆3min~5min,使肠腺组织完全被打碎并与缓冲液混合均匀,将匀浆液装人50mL离心管,250r/min37℃或室温振荡30min。7.2.1.4将样品匀浆液于4℃,10000g离心30min。7.2.1.5移取上清液至一新的50mL离心管,加人等体积的PEG8000溶液,颠倒混匀5次。冰上放置至少1h后,4℃,10000g离心5min,弃尽上清液,保留沉淀。7.2.1.6向沉淀中加入5mL裂解液,剧烈振荡30s.室温放置5min转移溶液至一15mL离心管,加人1.2mL三氯甲烷,剧烈振荡30s,室温放置5min,7. 2. 1. 7
12000g离心5min,吸取上清液至另一15mL离心管。3
雪品伙伴双ht
SN/T2530-—2010
7.2.1.8向上清液中加人0.5倍体积(约2.5mL)异丙醇,颠倒混匀后,室温放置5min,4℃,5000g离心5min
7.2.1.9弃尽上清液,用5mL,4℃预冷的75%乙醇洗涤沉淀。7.2.1.10重复步骤7.2.1.9两次,最后一次弃尽上清液。7.2.1.11沉淀重悬于300μL超纯水(无RNase和DNase污染)中,将悬液转移至一1.5mL离心管中。
2加人400μL1×RNA吸附缓冲液,振荡30s,60℃放置3min7.2.1.12
7. 2. 1. 13
加人100uLOligo(dT)25磁珠,轻柔混合,磁性抽提架上放置1min。4弃尽上清液,加入500μL2XRNA吸附缓冲液,室温下晃动5min洗涤。7.2.1.14
5离心管在磁性抽提架上放置1min,弃尽上清液。加人500μL漂洗缓冲液,颠倒混匀5次,7.2.1.15
离心管在磁性抽提架上放置1min,弃去上清液。7.2.1.16重复步骤7.2.1.15三次。7.2.1.17沉淀用100μL超纯水(无RNase和DNase污染)悬浮,90℃放置2min释放RNA。离心管在磁性抽提架上放置1min将上清液移至另一1.5mL离心管中,可即吸取5μL进行RT-PCR检测7.2.2水样中脊髓灰质炎病毒RNA提取(使用Qiagen公司QIAampViralRNAMiniKit)7.2.2.1用50mL针管分次取100mL~200mL水样过一直径为47mm,孔径为0.45um的乙酸/硝酸混合纤维素滤膜,小心取出滤膜,平整放于聚乙烯薄膜袋中。7.2.2.2向薄膜袋中加入1130μLBufferAVL-carrierRNA混合液,使滤膜充分浸于缓冲液中。剧烈振荡15s~30s,室温浸泡滤膜20min~30min后,小心将液体完全转移到15mL离心管中。7.2.2.3(可选步骤)若回收液体中存在明显可见的固体物质,4000g离心3min,转移上清液至一新15mL离心管中。
7.2.2.4加人1120uL无水乙醇,剧烈振荡15s,5000g离心15s收集液体。7.2.2.5将上述液体630μL转移至带有2mL收集管的离心柱中,6000g离心1min.弃收集管中液体。
7.2.2.6重复步骤7.2.2.5,直至所有混合液均通过离心柱,最后一次离心后将离心柱放入一新2mL收集管中。
7.2.2.7加人500μLBufferAW1,6000g离心1min,将离心柱放入一新2mL收集管中。7.2.2.8加人500μLBufferAW2,20000g离心3min。7.2.2.9将离心柱放入一新2mL收集管中,20000g离心1min以彻底除去残余在离心柱膜上液体7.2.2.10将离心柱放入一新1.5mL离心管中,小心的在离心柱膜中央加入60μLBufferAVE,室温放置1min~2min,6000g离心1min。1.5mL离心管中的液体即为提取的病毒RNA样品,可即吸取5μL进行RT-PCR检测
7.2.3蔬菜和水果样品中脊髓灰质炎病毒RNA提取1>(使用Qiagen公司QIAampViralRNAMiniKit)
7.2.3.1取15g左右水果或蔬菜样品装人50mL离心管中,加人35mL甘氨酸缓冲液(pH9.5),250r/min37℃或室温振荡30min
7.2.3.2将装有水果或蔬菜样品的混合液于4℃,12000g离心30min。7.2.3.3转移上清液至一新50mL离心管,加人等体积PEG8000溶液,颠倒混匀5次。4℃放置过夜,4℃,12000g离心30min,弃尽上清液,保留沉淀。1)水样和果蔬样品中病毒RNA的提取方法是针对QIAampViralRNAMiniKit,Qiagen,Cat.No.52904给出的给出这一信息是为了方便本标准使用者,并不表示只认可该产品,如果其他等效产品具有相同的效果,则可使用等效产品。
雪品伙伴欧ht
SN/T2530—2010
7.2.3.4向沉淀中加人140μLPBS缓冲液使沉淀完全悬浮,加人565μLBufferAVL-carrierRNA混合液,剧烈振荡15s~30s,室温放置10min。7.2.3.5加人560uL无水乙醇,剧烈振荡15s,5000g离心15s收集液体。将上述液体630μL转移至带有2mL收集管的离心柱中,6000g离心1min,弃收集管中7.2.3.6
液体。
重复步骤7.2.3.6,将离心柱放人一新2mL收集管中。7.2.3.8
加人500μLBufferAW1,6000g离心1min,将离心柱放入一新的2mL收集管中。7.2.3.9
液体。
加人500uLBufferAW2.20000g离心3min。将离心柱放入一新2mL收集管中,20000g离心1min以彻底除去残余在离心柱膜上7.2.3.11将离心柱放人一新1.5mL离心管中,小心的在离心柱膜中央加人60μLBufferAVE,室温放置1min~2min,6000g离心1min。1.5mL离心管中的液体即为提取的病毒RNA样品,可即吸取5μL进行RT-PCR检测。
7.3RT-PCR检测
7.3.1普通RT-PCR
7.3.1.1普通RT-PCR反应体系
病毒RNA逆转录为cDNA的反应体系见表3,PCR反应体系见表4。反应体系中各试剂的量可根据不同试剂盒进行适当调整。每个反应体系设置两个平行反应。以脊髓灰质炎病毒cDNA或含脊髓灰质炎病毒检测目的片段的质粒标准分子DNA作为阳性对照模板,以不含有脊髓灰质炎病毒cDNA或脊髓灰质炎病毒检测目的片段质粒标准分子DNA的样品作为阴性对照模板,以水代替模板作为空白对照。
病毒RNA逆转录反应体系1)
逆转录反应缓冲液
转录酶
Oligo dTPrimer
Random 6 mers
模板RNA
超纯水(无RNase和DNase污染)总体积
储液浓度
50μmol/L
100μmol/L
终浓度
2.5μmol/L
5μmol/L
表4三种血清型脊髓灰质炎病毒普通PCR反应体系2名
PCR反应缓冲液
引物Polio-265-1F
储液浓度
10mmol/L
10μmol/L
终浓度
0.2mmol/L
0.4μmol/L
使用量/μL
使用量/μL
该反应体系针对PrimeScriptRTreagentKit,TaKaRa,Cat.No.DRRo37S给出,给出这一信息是为了方便本标准使用者,并不表示只认可该产品,如果其他等效产品具有相同的效果,则可使用等效产品该反应体系针对BlendTag-PlusDNA聚合酶及配套缓冲液和dNTPs:ToYoBo,Cat.No.BTQ-2o1给出·给出2)
这一信息是为了方便本标准使用者,并不表示只认可该产品,如果其他等效产品具有相同的效果,则可使用等效产品。
btt
SN/T2530—2010
引物Polio-265-2R
BlendTaq-plusDNA聚合酶
超纯水(无RNase和DNase污染)总体积
7.3.1.2普通RT-PCR反应参数!
表4(续)
储液浓度
10μmol/L
终浓度
0.4μmol/L
0.05U/μL
病毒RNA逆转录为cDNA的反应参数:37℃,20min;85℃,5s;使用量/uL
普通PCR反应参数:94℃.2min;94℃.30s58℃.30s,72℃.30s,40个循环。72℃.5min。7.3.1.3PCR产物的琼脂糖凝胶电泳检测将适量50XTAE稀释成1×TAE溶液,配制溴化乙锭含量为0.5μg/mL的1.5%琼脂糖凝胶。取PCR产物15μL,加1.5μL上样缓冲液点样进行电泳,并在其中一孔道加人DNA分子量标记以判断PCR产物的片段大小。电压大小根据电泳槽长度来确定,一般控制在3V/cm~5V/cm,当溴酚蓝移动到凝胶边缘时关闭电源,电泳检测结果用凝胶成像分析系统记录。7.3.1.4普通RT-PCR检测下限
I型、Ⅱ型、Ⅱ型脊髓灰质炎病毒普通RT-PCR体系检测下限均为50拷贝质粒标准分子DNA。7.3.2实时荧光RT-PCR
7.3.2.1实时荧光RT-PCR反应体系病毒RNA逆转录为cDNA的反应体系见表3.PCR反应体系见表5,表6。每个反应体系设置两个平行反应。其中POL-FP1/RP1/Probel用于I型脊髓灰质炎病毒的实时荧光RT-PCR检测;POLFP2/RP2/Probe2用于Ⅱ型脊髓灰质炎病毒的实时荧光RT-PCR检测;POL-FP3/RP3/Probe3用于Ⅲ型脊髓灰质炎病毒的实时荧光RT-PCR检测。三对引物和探针可分别用于I、Ⅱ、Ⅲ型脊髓灰质炎病毒的检测,检测体系见表5。对三种血清型脊髓灰质炎病毒也可实施同时检测(同一反应管检测),即将三对引物和三条探针同时加入反应管,反应体系见表6。以脊髓灰质炎病毒cDNA或含脊髓灰质炎病毒检测目的片段的质粒标准分子DNA作为阳性对照模板,以不含有脊髓灰质炎病毒cDNA或脊髓灰质炎病毒检测目的片段的质粒标准分子DNA的样品作为阴性对照模板,以水代替模板作为空白对照。表5对三种血清型脊髓灰质炎病毒分别进行实时荧光RT-PCR检测的反应体系2名称
PremixExTaqTM(PerfectReal Time)引物POL-FP1a
引物POL-RP1
探针POL-Probel
ROX荧光校正试剂(50×)b
超纯水(无RNase和DNase污染)储液浓度
10μmol/L
10μmol/L
5μmol/L
反应参数可根据不同型号PCR仪及PCR反应体系作适当调整1)
终浓度
0.2μmol/L
0.2μmol/L
0.2μmol/L
使用量/μL
该反应体系针对PremixExTaqTM(PerfectRealTime)及配套ROX荧光校正试剂(5oX),TaKaRa,Cat.No.2)
DRR039A给出,给出这一信息是为了方便本标准使用者,并不表示只认可该产品,如果其他等效产品具有相同的校果,则可使用等效产品。
htt
总体积
表5(续)
储液浓度
终浓度
SN/T2530—2010
使用量/uL
当对IⅡI型脊髓灰质炎病毒进行检测时引物和探针分别为POL-FP2/POL-RP2,POL-Probe2;当对Ⅲ型脊髓灰质炎病毒进行检测时,引物和探针分别为POL-FP3/POL-RP3,POL-Probe3。b该试剂只在具有ROX荧光通道校正的实时荧光PCR仪上进行扩增时添加,否则用水补齐。5对三种血清型脊髓灰质炎病毒同时进行实时荧光RT-PCR检测的反应体系5)表6
PremixExTaqTM(PerfectReal Time)引物POL-FPI
引物POL-RP1
探针POL-Probel
引物POL-FP2
引物 POL-RP2
探针POL-Probe2
引物POL-FP3
引物POL-RP3
探针POL-Probe3
ROX荧光校正试剂(50X)
超纯水(无RNase和DNase污染)总体积
储液浓度
10μmol/L
10μmol/L
5μmol/L
10μmol/L
10μmol/L
5yμmol/L
10μmol/L
10μmol/L
5μmol/L
终浓度
0.2μmol/L
0.2μmol/L
0.2μmol/L
0.2μmol/L
0.2μmol/L
0.2μmol/L
0.2μmol/L
0.2μmol/L
0.2μmol/L
a该试剂只在具有ROX荧光校正通道的实时荧光PCR仪上进行扩增时添加·否则用水补齐实时荧光RT-PCR反应参数
病毒RNA逆转录为cDNA的反应参数:37℃,20min;85℃,5s;使用量/uL
对三种血清型脊髓灰质炎病毒分别进行实时荧光PCR检测的反应参数:95℃,10s;95℃,5s,60℃,31s45个循环;对三种血清型脊髓灰质炎病毒同时进行实时荧光PCR检测的反应参数:95℃,10s95℃.5s,60℃31s,45个循环7.3.2.3
实时荧光RT-PCR检测下限
对I型、IⅡI型、ⅡⅢ型脊髓灰质炎病毒分别检测的实时荧光RT-PCR体系检测下限均为2拷贝质粒标准分子DNA;对三种血清型脊髓灰质炎病毒同时检测的实时荧光RT-PCR体系检测下限为2拷贝质粒标准分子DNA。
结果判断及表述
结果判定
普通RT-PCR
阴性对照和空白对照未出现条带.阳性对照出现265bp的目的扩增条带则表明反应体系运行反应参数可根据不同型号PCR仪及PCR反应体系作适当调整,1
httr
oodmate:net
SN/T2530-—2010
正常,否则需重新进行普通PCR扩增;对样品进行普通RT-PCR检测,如果阴性对照和空白对照未出现条带,阳性对照出现265bpb)
的扩增条带,而样品未出现扩增条带,则可判定样品脊髓灰质炎病毒阴性;c)如果阴性对照和空白对照未出现条带,阳性对照和样品出现265bp的扩增条带,对PCR产物进行测序分析比对,PCR产物核酸序列与相应的脊髓灰质炎病毒cDNA序列相一致,则可判定样品脊髓灰质炎病毒阳性。也可采用本标准中实时荧光RT-PCR的方法进行确证8.1.2实时荧光RT-PCR
8.1.2.1对三种血清型脊髓灰质炎病毒进行分别检测的结果判定对三种血清型脊髓灰质炎病毒进行分别检测时,阴性对照和空白对照无荧光增幅现象,阳性对照有荧光增幅现象则表明反应体系运行正常,否则需重新进行实时荧光PCR扩增。a)若待检测样品无荧光增幅现象,则判定样品未检出该型脊髓灰质炎病毒;b)若待检测样品有荧光增幅现象,且Ct值≤40时,则判定样品检出该型脊髓灰质炎病毒;c)若待检测样品Ct值介于40和45之间时,应重新进行实时荧光RT-PCR检测。重新检测后设定同一域值条件下,若Ct值≥45时,则判定样品未检出该型脊髓灰质炎病毒。重新检测后的Ct值仍介于40和45之间,则判定样品检出该型脊髓灰质炎病毒。8.1.2.2对三种血清型脊髓灰质炎病毒进行同时扩增的结果判定对三种血清型脊髓灰质炎病毒进行同时扩增时,阴性对照和空白对照无荧光增幅现象,阳性对照有荧光增幅现象则表明反应体系运行正常,否则需重新进行实时荧光PCR扩增。a)若待检测样品无荧光增幅现象,则判定样品未检出脊髓灰质炎病毒;b)若待检测样品有荧光增幅现象,且Ct值≤40时,则判定样品检出脊髓灰质炎病毒;C)若待检测样品Ct值介于40和45之间时,应重新进行实时荧光RT-PCR检测。重新检测后设定同一域值条件下,若Ct值≥45时,则判定样品未检出脊髓灰质炎病毒。重新检测后的Ct值仍介于40和45之间,则判定样品检出脊髓灰质炎病毒8.2结果表述bzxz.net
8.2.1根据8.1描述判定检出脊髓灰质炎病毒,则表述为检出脊髓灰质炎病毒或脊髓灰质炎病毒阳性。
8.2.2根据8.1描述判定未检出脊髓灰质炎病毒,则表述为未检出脊髓灰质炎病毒或脊髓灰质炎病毒阴性。
http
TTTETTETT
A.1普通溶液的配制
附录A
(规范性附录)
溶液的配制
SN/T2530—2010
甘氨酸缓冲液:含0.1mol/L甘氨酸,0.3mol/L氯化钠(NaCI),pH9.5甘氨酸A.1.1
甘氨酸
氯化钠
双蒸水
5mol/L氢氧化钠溶液
加双蒸水至1000mL.121℃,15min灭菌备用7.5g
调pH至9.5
A.1.2PEG8000溶液:含16%(质量浓度)PEG8000.0.525mol/L氯化钠PEG8000
氯化钠
加双蒸水至100mL,121℃,15min灭菌备用。A.1.3PBS缓冲液(20×).pH7.5氯化钠
氯化钾
磷酸氢二钠
磷酸二氢钾
双蒸水
1mol/L盐酸
调pH至7.5
加双蒸水至1000mL,121℃,15min灭菌备用使用时用灭菌双蒸水稀释至1×使用。A.1.450×TAE缓冲液
A.1.4.10.5mol/LEDTA-Na2·2H2O(二水乙二铵四乙酸钠)溶液·pH8.0EDTA-Na2·2H20
灭菌双蒸水
5mol/L氢氧化钠溶液
调pH至8.0
灭菌双蒸水加至1000mL,121℃,15min灭菌备用。A.1.4.2TAE电泳缓冲液(50×)羟基甲基氨基甲烷(Tris)
冰乙酸
0.5mol/LEDTA-Na2溶液,pH 8.0
灭菌双蒸水加至1000mL,121℃,15min灭菌备用。使用时用灭菌双蒸水稀释至1×使用。A.1.5溴化乙锭(EB)溶液(10mg/mL)EB
灭菌双蒸水
A.1.6含0.5μg/mL溴化乙锭(EB)的1.5%琼脂糖凝胶琼脂糖
ht
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。