SN/T 2800-2011
基本信息
标准号: SN/T 2800-2011
中文名称:进出口蜂王浆中四环素类兽药残留量检测方法 液相色谱-质谱/质谱法
标准类别:商检行业标准(SN)
标准状态:现行
出版语种:简体中文
下载格式:.rar .pdf
下载大小:1768KB
相关标签: 进出口 蜂王浆 四环素 兽药 残留量 检测 方法 色谱 质谱 质谱法

标准分类号
关联标准
出版信息
相关单位信息
标准简介
SN/T 2800-2011 进出口蜂王浆中四环素类兽药残留量检测方法 液相色谱-质谱/质谱法
SN/T2800-2011
标准下载解压密码:www.bzxz.net
标准图片预览




标准内容
中华人民共和国出入境检验检疫行业标准SN/T2800—2011
进出口蜂王浆中四环素类兽药残留量检测方法
液相色谱-质谱/质谱法
Determination of tetracyclines residues in royal jelly for import andexport-HPLC-MS/MSmethod
2011-02-25发布
中华人民共和国
国家质量监督检验检疫总局
2011-07-01实施
本标准按照GB/T1.1—2009给出的规则起草。本标准由国家认证认可监督管理委员会提出并归口。本标准起草单位:中华人民共和国浙江出人境检验检疫局,本标准主要起草人:陈笑梅、黄超群、谢文、丰金平、刘海山。SN/T2800—2011
1范围
进出口蜂王浆中四环素类兽药残留量检测方法液相色谱-质谱/质谱法
SN/T2800—2011
本标准规定了蜂王浆中土霉素(oxytetracycline,OTC)、四环素(tetracycline,TC)、去甲金霉素(demethylchlortetracycline,DMCTC),金霉素(chlorotetracycline,CTC)和强力霉素(doxycycline,DC)残留量的液相色谱-串联质谱测定方法。本标准适用于蜂王浆中土霉素、四环素、去甲金霉素、金霉素和强力霉素残留量的测定。2方法提要
试样中的待测抗生素用EDTA-Mcllvaine缓冲液提取,甲醇沉淀样品中的蛋白质,清液过HLB固相萃取柱和COOH型离子交换柱净化。液相色谱-串联质谱法测定样品中的待测物,外标法定量。3试剂和材料
除另有规定外,试剂均为分析纯,水为超纯水。3.1甲醇:液相色谱级试剂。
3.2乙睛:液相色谱级试剂。
3.3乙酸乙酯:液相色谱级试剂。3.4草酸(C,H,O4·2H,O0)。
3.5磷酸氢二钠。
3.6柠檬酸(C,HgOHO)。
3.7乙二胺四乙酸二钠(Naz·EDTA)。3.8氢氧化钠
3.90.2mol/L磷酸氢二钠溶液:称取28.41g磷酸氢二钠溶于适量水,再定容至1000mL。3.100.1mol/L柠檬酸溶液:称取21.01g柠檬酸溶于适量水,再定容至1000mL。3.11McIlvaine缓冲溶液:将625mL0.2mol/L磷酸氢二钠溶液(3.9)与1000mL0.1mol/L柠檬酸溶液(3.10)混合,用磷酸调节pH=4.0。3.12EDTA-McIlvaine缓冲溶液:称取60.5g乙二胺四乙酸二钠,加人1625mLMcIlvaine缓冲溶液(3.11)中,使其溶解摇匀。
3.13氢氧化钠溶液:1mol/L。
3.145%(体积分数)甲醇水溶液,将5mL甲醇与95mL水混合摇匀。甲醇-乙酸乙酯混合液:将10mL甲醇与90mL乙酸乙酯混合摇匀3.15
3.160.01mol/L草酸溶液:称取1.26g草酸溶于适量水,再定容至1000mL。草酸-乙睛混合液(80十20,体积比):将80mL草酸溶液(3.16)与20mL乙睛混合摇勾。3.17
四环素族抗生素标准品:土霉素盐酸盐(OTC·HCI)纯度大于等于97.9%,四环素盐酸盐(TC·HCI)纯度大于等于97.0%,去甲金霉素盐酸盐(DMCTC·HCI)纯度大于等于99.0%,金霉素盐酸盐(CTC·HC1)纯度大于等于99.0%.强力霉素(DC)纯度大于等于96.5%。1
SN/T2800—2011
3.19标准储备液:分别称取OTC·HC10.8mg,TC·HCl11.0mg,DMCTC:HCI10.8mgCTC.HCl10.8mg.DC10.4mg,用甲醇溶解并定容到100mL容量瓶中,溶液浓度为0.1mg/mL,一18℃保存,有效期6个月。
3.20混合标准中间液:分别准确移取适量0.1mg/mLOTC、TC、DMCTC、CTC、DC储备液(3.19),用甲醇稀释定容为20ng/mL,0℃~4℃保存,有效期1个月。3.21混合标准工作溶液:根据需要,将中间液(3.20)用阴性样品处理液稀释至适当浓度的工作溶液。3.22HLB固相萃取柱:500mg,6mL。使用前分别用5mL甲醇和10mL水预洗并保持柱体湿润。3.23离子交换柱:COOH型固相萃取柱,500mg,3mL。使用前用5mL乙酸乙酯预洗并保持柱体湿润。
4仪器和设备
4.1液相色谱-质谱/质谱联用仪:配有电喷雾离子源(ESI)。4.2离心机(2500g)。
4.3混匀器。
4.4真空固相萃取装置。
4.5pH计。
4.6具盖塑料离心管:50mL。
4.7电子天平。
5制样
5.1试样的制备
将抽取的样品充分混匀,均分成两份,分别装入洁净容器内,一份作为留样保存,另一份作为试样供检测用。在制样的操作过程中,应防止样品受到污染或发生含量的变化,5.2试样的保存
试样宜及时检测,在不能及时检测的情况下,应置于一18℃以下冷冻保存。6
测定步骤
6.1提取
称取蜂王浆2g(精确至0.01g),置于50mL离心管中,加人5mLEDTA-McIlvaine缓冲溶液,在混匀器上混匀1min,再加入5mL甲醇混匀,离心(2500g)10min,上层清液转移到50mL容量瓶中。下层沉淀加10mLEDTA-McIlvaine缓冲溶液,混勾1min,离心(2500g)5min后,把上层清液转移到50mL容量瓶中。重复操作一次。用EDTA-Mcllvaine缓冲溶液把提取液定容至50mL。取25mL~50mL移入离心管中,用1mol/L氢氧化钠溶液调节pH为6.0,待净化用。6.2HLB固相萃取柱净化
将上述提取液过预先淋洗好的HILB固相萃取柱,再用5mL甲醇水溶液(3.14)淋洗,减压抽干20min,弃去全部淋出液。加10mL甲醇-乙酸乙酯混合液(3.15)以1mL/min的流速洗脱.收集洗脱液,摇匀。
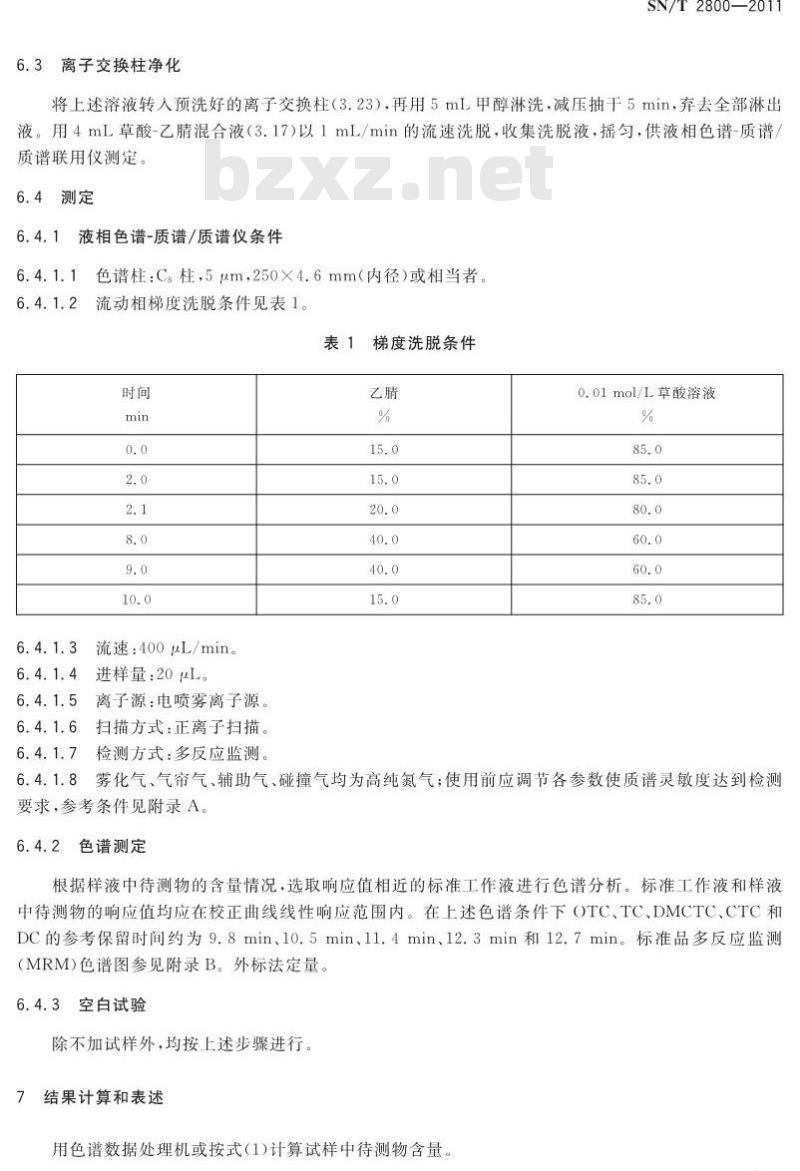
6.3离子交换柱净化
SN/T2800—2011
将上述溶液转人预洗好的离子交换柱(3.23),再用5mL甲醇淋洗,减压抽干5min,弃去全部淋出液。用4mL草酸-乙睛混合液(3.17)以1mL/min的流速洗脱,收集洗脱液,摇匀,供液相色谱-质谱质谱联用仪测定。
6.4测定
6.4.1液相色谱-质谱/质谱仪条件6.4.1.1
色谱柱:Cg柱,5um,250X4.6mm(内径)或相当者流动相梯度洗脱条件见表1。
表1梯度洗脱条件
流速:400μL/min。
进样量:20μL
离子源:电喷雾离子源。
扫描方式:正离子扫描。
检测方式:多反应监测。
0.01mol/L草酸溶液
雾化气、气帘气、辅助气、碰撞气均为高纯氮气:使用前应调节各参数使质谱灵敏度达到检测要求,参考条件见附录A。
色谱测定
根据样液中待测物的含量情况,选取响应值相近的标准工作液进行色谱分析。标准工作液和样液中待测物的响应值均应在校正曲线线性响应范围内。在上述色谱条件下OTC、TC、DMCTC、CTC和DC的参考保留时间约为9.8min、10.5min、11.4min、12.3min和12.7min。标准品多反应监测(MRM)色谱图参见附录B。外标法定量。6.4.3空白试验
除不加试样外,均按上述步骤进行。结果计算和表述
用色谱数据处理机或按式(1)计算试样中待测物含量。3
SN/T2800—2011
式中:
试样中待测物的残留量,单位为微克每千克(ug/kg);样液中待测物的峰面积;
标准工作液中待测物的浓度,单位为纳克每毫升(ng/mL);样液最终体积,单位为毫升(mL):标准工作液中待测物的峰面积;最终样液所代表的试样量,单位为克(g)。测定低限和回收率
测定低限
本方法对蜂王浆中土霉素、四环素、去甲金霉素、金霉素、强力霉素的测定低限均为2.0ug/kg回收率
添加浓度在2.0ug/kg、5.0ug/kg、10.0ug/kg时,五种抗生素残留量测定的回收率如表2。五种抗生素残留量测定的回收率表2
被测物
2.0μg/kg
72.5%~97.5%
72.5%~104.0%
70.5%~93.0%
71.5%~106.0%
74.0%~87.0%
添加浓度
5.0μg/kg
81.2%~97.6%
75.2%~108.6%
71.8%~89.2%
77.6%~109.8%
76.8%~94.4%
10.0μg/kg
70.2%~84.3%
72.9%~102.0%
72.5%~94.3%
83.9%108.0%
73.1%~84.4%
气帘气压力(CUR):25psi。
雾化气压力(GS1):35psi。
辅助气压力(GS2):45psi。
电喷雾电压(IS):5500V。
离子源温度(TEM):500℃。
碰撞气压力(CAD):6.00psi。
人口电压(EP):10.00V。
碰撞室出口电压(CXP):16.00V质谱条件见表A.1。
定量离子对
土霉素
四环素
去甲金霉素
金霉素
强力霉素
461.1/426.2
445.1/410.3
465.2/448.2
479.1/462.2
445.1/428.3
附录A
(资料性附录)
优化后的质谱条件1
质谱条件
定性离子对
461.1/426.2
461.1/443.1
445.1/410.3
445.1/427.3
465.2/448.2
465.2/430.3
479.1/462.2
479.1/154.1
445.1/428.3
445.1/154.1
保留时间
SN/T2800—2011
去簇电压下载标准就来标准下载网
碰撞气能量(CE)
非商业性声明:附录A所列参数是在API4000质谱仪完成的,此处列出试验用仪器型号仅是为了提供参考.并1)
不涉及商业目的.鼓励标准使用者尝试不同厂家和型号的仪器。5
SN/T 2800—2011
附录B
(资料性附录)
五种四环素族抗生素标准品多反应监测(MRM)色谱图9.84
461.1/426.2
126689a13
445.1/410.3
678910111213
465.2/44R.2
(4) 12.42
479. 1/154. 1
415.1/428.3
土霉素;
四环素;
去甲金霉素;
金霉素;
强力霉素。
9 10 11 12 13
910111213
la/susueu
.5000.00
161.1/443.1
567R910112
415.1/427.3
2346189623
465.2/430.3
479.1/462.2
891011 1213
567810 11 1213
445.1/154. 1
234567801011123
五种四环素族抗生素标准品多反应监测(MRM)色谱图图B.1
Foreword
ThisstandardwasdraftedinaccordancewiththeGB/T1.12009SN/T2800—2011
This standard was proposed by and is under the charge of Certification and Accreditation administrationof thePeople'sRepublicof China.This standard was drafted by Zhejiang Entry-Exit Inspection and Quarantine Bureau of the People'sRepublicofChina
The main drafters of this standard are Chen Xiaomei,Huang Chaoqun,Xie Wen,Feng JinpingLiu Haishan
SN/T2800—2011
DeterminationoftetracyclinesresiduesinroyaljellyforimportandexportHPLC-MS/MS method1
This standard specifies the determination of oxytetracycline (OTC),tetracycline(TC),demethylchlortetracycline(DMCTC),chlorotetracycline(CTC)anddoxycycline(DC)residuesinroyaljellybyhigh-performanceliquidchromatography-tandemmassspectrometry.This standard is applicabletothe inspectionof Oxytetracycline,Tetracycline,Demeclocycline,ChlorotetracyclineandDoxycyclineresiduesinroyal jerry2Principle
Tetracyclinesresiduesintest sample is extracted withEDTA-Mcllvainebuffer solution.Precipitatetheprotein insamplebymethanol and purifythefilterbyHLB solid phaseextraction cartridge and ionexchangecolumn.DeterminationthetetracyclinesbyHPLCwithTandemMassSpectrometry,usingexternalstandardmethod.
3Reagentsandmaterials
Unless otherwise specified,all reagents should be analytically pure.water used should be ultrapure water3.1Methanol:HPLCgrade
Acetonitrile:HPLCgrade
Ethylacetate:HPLCgrade
Oxalicacid(C,H,O4:2H,O)
Sodiumhydrogenphosphate
Citricacid(CHgO,·H2O)
3.7Disodium ethylenediamine tetraacetic acid(Naz·EDTA).3.8 Sodium hydroxide.
SN/T2800—2011
3.90.2mol/LSodiumhydrogenphosphatesolution:Dissolve28.41gsodiumhydrogenphosphateinwateranddiluteto1o00mLwithwater.3.100.1mol/LCitric acid solution:Dissolve21.01g citricacid in water and diluteto 1000 mL.3.11Mcllvaine buffer solution:Mix 625 mL 0.2 mol/L sodium hydrogen phosphate solution (3.9)and1000mL0.1mol/Lcitricacid solution(3.10),adjustpH=4.0withphosphoricacid.3.12
EDTA-Mcllvaine buffer solution:Weigh 60.5g disodium ethylenediamine tetraacetic acid,addedinto1625mLMcllvainebuffersolution(3.11).3.13Sodiumhydroxidesolution:1mol/L3.145%(V/V)Methanolaqueoussolution.Mix5mLmethanoland95mLwater.3.15Methanol-Ethyl acetate mixed solution:Mix 10 mL methanol and 90 mL ethyl acetate.3.160.01mol/LOxalic acid solution:Dissolve1.26 g 0xalic acid inwater and diluted to1000 mL3.17Oxalicacid-Acetonitrilemixture(80+20,V/V):Mix80mLoxalicacidsolution(3.16)and20mLacetonitrile
3.18Tetracyclineantibioticsstandard:OTC·HClpurity ≥97.9%,TCHClpurity ≥97.0%DMCTC.HCIpurity≥99.0%,CTC·HCIpurity≥99.0%,DCpurity≥96.5%3.19Standardstocksolution:AccuratelyweighOTC.HCI10.8mg,TC·HCI11.0mg.DMCTC·HC10.8mg,CTC·HCl10.8mg.DC10.4mg,dissolvedwithmethanolanddiluteto50mL,storedat-18℃.
3.20Mixedstandard interimsolutionPipetteadequate0.1mg/mLOTC、TC·HCI、DMCTC.CTC.DCstandard stock solution(3.19), diluted with methanol to prepare a standard interim solution of20 ng/mL.This standard interim solution should be stored at o ℃ ~4 ℃3.21Mixedstandardwork solution:Accordingto the requirement,diluted the mixed standard inter-imsolution(3.20)withnegativesamplepreparedsolutiontosuitableconcentrations.3.22HLBSolidphaseextraction(SPE)Cartridge:500mg.6mL.ConditionHLBSPEcartridgewith5mLmethanoland1omLwaterbeforeusing3.23lonexchangecolumn:carboxylicacidsolidphaseextraction(SPE)cartridge.500mg.3mL9
SN/T2800—2011
Condition carboxylic acid SPE cartridge with5mL ethyl acetate before using4
Apparatusandequipment
4.1High-performanceliquid chromatography-tandemmassspectrometer,equippedwithEsl.4.2
Centrifuge(2500g).
Vortexmixer.
Solidphaseextractionwithvacuumpump4.5 pH measurer.
4.6Plasticcentrifugetubewithcap:50mL.4.7
Electronicbalance.
Samplepreparation
5.1Preparationoftestsample
Mixthe sample,divideintotwo equal portions,and thenplace in clean containers separately.Oneuses as apreservedsampleand the other usesas atest sample.Inthecourse of samplepreparation,precautionmust betakento avoid the contaminationorany factors whichmay causethe changes ofresiduecontent.
5.2 Storage of sample
Thetestsamples shouldbedetected intime,iftheycan'ttheyshouldbe storedbelow-18℃DeterminationProcedure
Extraction
The sampleof royal jellywasweighed(accuratelyto2g)intoapolypropylene tubeanddissolved in5mLofNa,EDTA-Mcllvainebuffersolution,then5mLof methanolwasaddedasaprecipitatorforprotein.After violent shaking for1min.the sample solutionwas centrifuged at2500g for10 min.Theupper solutionwastransferred intoa50mLvolumetricflask.20mLof NazEDTA-Mcllvainebuff-ersolutionwasusedtoextractthetetracyclinesremaininginthedepositagain,andtransferred into10
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
进出口蜂王浆中四环素类兽药残留量检测方法
液相色谱-质谱/质谱法
Determination of tetracyclines residues in royal jelly for import andexport-HPLC-MS/MSmethod
2011-02-25发布
中华人民共和国
国家质量监督检验检疫总局
2011-07-01实施
本标准按照GB/T1.1—2009给出的规则起草。本标准由国家认证认可监督管理委员会提出并归口。本标准起草单位:中华人民共和国浙江出人境检验检疫局,本标准主要起草人:陈笑梅、黄超群、谢文、丰金平、刘海山。SN/T2800—2011
1范围
进出口蜂王浆中四环素类兽药残留量检测方法液相色谱-质谱/质谱法
SN/T2800—2011
本标准规定了蜂王浆中土霉素(oxytetracycline,OTC)、四环素(tetracycline,TC)、去甲金霉素(demethylchlortetracycline,DMCTC),金霉素(chlorotetracycline,CTC)和强力霉素(doxycycline,DC)残留量的液相色谱-串联质谱测定方法。本标准适用于蜂王浆中土霉素、四环素、去甲金霉素、金霉素和强力霉素残留量的测定。2方法提要
试样中的待测抗生素用EDTA-Mcllvaine缓冲液提取,甲醇沉淀样品中的蛋白质,清液过HLB固相萃取柱和COOH型离子交换柱净化。液相色谱-串联质谱法测定样品中的待测物,外标法定量。3试剂和材料
除另有规定外,试剂均为分析纯,水为超纯水。3.1甲醇:液相色谱级试剂。
3.2乙睛:液相色谱级试剂。
3.3乙酸乙酯:液相色谱级试剂。3.4草酸(C,H,O4·2H,O0)。
3.5磷酸氢二钠。
3.6柠檬酸(C,HgOHO)。
3.7乙二胺四乙酸二钠(Naz·EDTA)。3.8氢氧化钠
3.90.2mol/L磷酸氢二钠溶液:称取28.41g磷酸氢二钠溶于适量水,再定容至1000mL。3.100.1mol/L柠檬酸溶液:称取21.01g柠檬酸溶于适量水,再定容至1000mL。3.11McIlvaine缓冲溶液:将625mL0.2mol/L磷酸氢二钠溶液(3.9)与1000mL0.1mol/L柠檬酸溶液(3.10)混合,用磷酸调节pH=4.0。3.12EDTA-McIlvaine缓冲溶液:称取60.5g乙二胺四乙酸二钠,加人1625mLMcIlvaine缓冲溶液(3.11)中,使其溶解摇匀。
3.13氢氧化钠溶液:1mol/L。
3.145%(体积分数)甲醇水溶液,将5mL甲醇与95mL水混合摇匀。甲醇-乙酸乙酯混合液:将10mL甲醇与90mL乙酸乙酯混合摇匀3.15
3.160.01mol/L草酸溶液:称取1.26g草酸溶于适量水,再定容至1000mL。草酸-乙睛混合液(80十20,体积比):将80mL草酸溶液(3.16)与20mL乙睛混合摇勾。3.17
四环素族抗生素标准品:土霉素盐酸盐(OTC·HCI)纯度大于等于97.9%,四环素盐酸盐(TC·HCI)纯度大于等于97.0%,去甲金霉素盐酸盐(DMCTC·HCI)纯度大于等于99.0%,金霉素盐酸盐(CTC·HC1)纯度大于等于99.0%.强力霉素(DC)纯度大于等于96.5%。1
SN/T2800—2011
3.19标准储备液:分别称取OTC·HC10.8mg,TC·HCl11.0mg,DMCTC:HCI10.8mgCTC.HCl10.8mg.DC10.4mg,用甲醇溶解并定容到100mL容量瓶中,溶液浓度为0.1mg/mL,一18℃保存,有效期6个月。
3.20混合标准中间液:分别准确移取适量0.1mg/mLOTC、TC、DMCTC、CTC、DC储备液(3.19),用甲醇稀释定容为20ng/mL,0℃~4℃保存,有效期1个月。3.21混合标准工作溶液:根据需要,将中间液(3.20)用阴性样品处理液稀释至适当浓度的工作溶液。3.22HLB固相萃取柱:500mg,6mL。使用前分别用5mL甲醇和10mL水预洗并保持柱体湿润。3.23离子交换柱:COOH型固相萃取柱,500mg,3mL。使用前用5mL乙酸乙酯预洗并保持柱体湿润。
4仪器和设备
4.1液相色谱-质谱/质谱联用仪:配有电喷雾离子源(ESI)。4.2离心机(2500g)。
4.3混匀器。
4.4真空固相萃取装置。
4.5pH计。
4.6具盖塑料离心管:50mL。
4.7电子天平。
5制样
5.1试样的制备
将抽取的样品充分混匀,均分成两份,分别装入洁净容器内,一份作为留样保存,另一份作为试样供检测用。在制样的操作过程中,应防止样品受到污染或发生含量的变化,5.2试样的保存
试样宜及时检测,在不能及时检测的情况下,应置于一18℃以下冷冻保存。6
测定步骤
6.1提取
称取蜂王浆2g(精确至0.01g),置于50mL离心管中,加人5mLEDTA-McIlvaine缓冲溶液,在混匀器上混匀1min,再加入5mL甲醇混匀,离心(2500g)10min,上层清液转移到50mL容量瓶中。下层沉淀加10mLEDTA-McIlvaine缓冲溶液,混勾1min,离心(2500g)5min后,把上层清液转移到50mL容量瓶中。重复操作一次。用EDTA-Mcllvaine缓冲溶液把提取液定容至50mL。取25mL~50mL移入离心管中,用1mol/L氢氧化钠溶液调节pH为6.0,待净化用。6.2HLB固相萃取柱净化
将上述提取液过预先淋洗好的HILB固相萃取柱,再用5mL甲醇水溶液(3.14)淋洗,减压抽干20min,弃去全部淋出液。加10mL甲醇-乙酸乙酯混合液(3.15)以1mL/min的流速洗脱.收集洗脱液,摇匀。
6.3离子交换柱净化
SN/T2800—2011
将上述溶液转人预洗好的离子交换柱(3.23),再用5mL甲醇淋洗,减压抽干5min,弃去全部淋出液。用4mL草酸-乙睛混合液(3.17)以1mL/min的流速洗脱,收集洗脱液,摇匀,供液相色谱-质谱质谱联用仪测定。
6.4测定
6.4.1液相色谱-质谱/质谱仪条件6.4.1.1
色谱柱:Cg柱,5um,250X4.6mm(内径)或相当者流动相梯度洗脱条件见表1。
表1梯度洗脱条件
流速:400μL/min。
进样量:20μL
离子源:电喷雾离子源。
扫描方式:正离子扫描。
检测方式:多反应监测。
0.01mol/L草酸溶液
雾化气、气帘气、辅助气、碰撞气均为高纯氮气:使用前应调节各参数使质谱灵敏度达到检测要求,参考条件见附录A。
色谱测定
根据样液中待测物的含量情况,选取响应值相近的标准工作液进行色谱分析。标准工作液和样液中待测物的响应值均应在校正曲线线性响应范围内。在上述色谱条件下OTC、TC、DMCTC、CTC和DC的参考保留时间约为9.8min、10.5min、11.4min、12.3min和12.7min。标准品多反应监测(MRM)色谱图参见附录B。外标法定量。6.4.3空白试验
除不加试样外,均按上述步骤进行。结果计算和表述
用色谱数据处理机或按式(1)计算试样中待测物含量。3
SN/T2800—2011
式中:
试样中待测物的残留量,单位为微克每千克(ug/kg);样液中待测物的峰面积;
标准工作液中待测物的浓度,单位为纳克每毫升(ng/mL);样液最终体积,单位为毫升(mL):标准工作液中待测物的峰面积;最终样液所代表的试样量,单位为克(g)。测定低限和回收率
测定低限
本方法对蜂王浆中土霉素、四环素、去甲金霉素、金霉素、强力霉素的测定低限均为2.0ug/kg回收率
添加浓度在2.0ug/kg、5.0ug/kg、10.0ug/kg时,五种抗生素残留量测定的回收率如表2。五种抗生素残留量测定的回收率表2
被测物
2.0μg/kg
72.5%~97.5%
72.5%~104.0%
70.5%~93.0%
71.5%~106.0%
74.0%~87.0%
添加浓度
5.0μg/kg
81.2%~97.6%
75.2%~108.6%
71.8%~89.2%
77.6%~109.8%
76.8%~94.4%
10.0μg/kg
70.2%~84.3%
72.9%~102.0%
72.5%~94.3%
83.9%108.0%
73.1%~84.4%
气帘气压力(CUR):25psi。
雾化气压力(GS1):35psi。
辅助气压力(GS2):45psi。
电喷雾电压(IS):5500V。
离子源温度(TEM):500℃。
碰撞气压力(CAD):6.00psi。
人口电压(EP):10.00V。
碰撞室出口电压(CXP):16.00V质谱条件见表A.1。
定量离子对
土霉素
四环素
去甲金霉素
金霉素
强力霉素
461.1/426.2
445.1/410.3
465.2/448.2
479.1/462.2
445.1/428.3
附录A
(资料性附录)
优化后的质谱条件1
质谱条件
定性离子对
461.1/426.2
461.1/443.1
445.1/410.3
445.1/427.3
465.2/448.2
465.2/430.3
479.1/462.2
479.1/154.1
445.1/428.3
445.1/154.1
保留时间
SN/T2800—2011
去簇电压下载标准就来标准下载网
碰撞气能量(CE)
非商业性声明:附录A所列参数是在API4000质谱仪完成的,此处列出试验用仪器型号仅是为了提供参考.并1)
不涉及商业目的.鼓励标准使用者尝试不同厂家和型号的仪器。5
SN/T 2800—2011
附录B
(资料性附录)
五种四环素族抗生素标准品多反应监测(MRM)色谱图9.84
461.1/426.2
126689a13
445.1/410.3
678910111213
465.2/44R.2
(4) 12.42
479. 1/154. 1
415.1/428.3
土霉素;
四环素;
去甲金霉素;
金霉素;
强力霉素。
9 10 11 12 13
910111213
la/susueu
.5000.00
161.1/443.1
567R910112
415.1/427.3
2346189623
465.2/430.3
479.1/462.2
891011 1213
567810 11 1213
445.1/154. 1
234567801011123
五种四环素族抗生素标准品多反应监测(MRM)色谱图图B.1
Foreword
ThisstandardwasdraftedinaccordancewiththeGB/T1.12009SN/T2800—2011
This standard was proposed by and is under the charge of Certification and Accreditation administrationof thePeople'sRepublicof China.This standard was drafted by Zhejiang Entry-Exit Inspection and Quarantine Bureau of the People'sRepublicofChina
The main drafters of this standard are Chen Xiaomei,Huang Chaoqun,Xie Wen,Feng JinpingLiu Haishan
SN/T2800—2011
DeterminationoftetracyclinesresiduesinroyaljellyforimportandexportHPLC-MS/MS method1
This standard specifies the determination of oxytetracycline (OTC),tetracycline(TC),demethylchlortetracycline(DMCTC),chlorotetracycline(CTC)anddoxycycline(DC)residuesinroyaljellybyhigh-performanceliquidchromatography-tandemmassspectrometry.This standard is applicabletothe inspectionof Oxytetracycline,Tetracycline,Demeclocycline,ChlorotetracyclineandDoxycyclineresiduesinroyal jerry2Principle
Tetracyclinesresiduesintest sample is extracted withEDTA-Mcllvainebuffer solution.Precipitatetheprotein insamplebymethanol and purifythefilterbyHLB solid phaseextraction cartridge and ionexchangecolumn.DeterminationthetetracyclinesbyHPLCwithTandemMassSpectrometry,usingexternalstandardmethod.
3Reagentsandmaterials
Unless otherwise specified,all reagents should be analytically pure.water used should be ultrapure water3.1Methanol:HPLCgrade
Acetonitrile:HPLCgrade
Ethylacetate:HPLCgrade
Oxalicacid(C,H,O4:2H,O)
Sodiumhydrogenphosphate
Citricacid(CHgO,·H2O)
3.7Disodium ethylenediamine tetraacetic acid(Naz·EDTA).3.8 Sodium hydroxide.
SN/T2800—2011
3.90.2mol/LSodiumhydrogenphosphatesolution:Dissolve28.41gsodiumhydrogenphosphateinwateranddiluteto1o00mLwithwater.3.100.1mol/LCitric acid solution:Dissolve21.01g citricacid in water and diluteto 1000 mL.3.11Mcllvaine buffer solution:Mix 625 mL 0.2 mol/L sodium hydrogen phosphate solution (3.9)and1000mL0.1mol/Lcitricacid solution(3.10),adjustpH=4.0withphosphoricacid.3.12
EDTA-Mcllvaine buffer solution:Weigh 60.5g disodium ethylenediamine tetraacetic acid,addedinto1625mLMcllvainebuffersolution(3.11).3.13Sodiumhydroxidesolution:1mol/L3.145%(V/V)Methanolaqueoussolution.Mix5mLmethanoland95mLwater.3.15Methanol-Ethyl acetate mixed solution:Mix 10 mL methanol and 90 mL ethyl acetate.3.160.01mol/LOxalic acid solution:Dissolve1.26 g 0xalic acid inwater and diluted to1000 mL3.17Oxalicacid-Acetonitrilemixture(80+20,V/V):Mix80mLoxalicacidsolution(3.16)and20mLacetonitrile
3.18Tetracyclineantibioticsstandard:OTC·HClpurity ≥97.9%,TCHClpurity ≥97.0%DMCTC.HCIpurity≥99.0%,CTC·HCIpurity≥99.0%,DCpurity≥96.5%3.19Standardstocksolution:AccuratelyweighOTC.HCI10.8mg,TC·HCI11.0mg.DMCTC·HC10.8mg,CTC·HCl10.8mg.DC10.4mg,dissolvedwithmethanolanddiluteto50mL,storedat-18℃.
3.20Mixedstandard interimsolutionPipetteadequate0.1mg/mLOTC、TC·HCI、DMCTC.CTC.DCstandard stock solution(3.19), diluted with methanol to prepare a standard interim solution of20 ng/mL.This standard interim solution should be stored at o ℃ ~4 ℃3.21Mixedstandardwork solution:Accordingto the requirement,diluted the mixed standard inter-imsolution(3.20)withnegativesamplepreparedsolutiontosuitableconcentrations.3.22HLBSolidphaseextraction(SPE)Cartridge:500mg.6mL.ConditionHLBSPEcartridgewith5mLmethanoland1omLwaterbeforeusing3.23lonexchangecolumn:carboxylicacidsolidphaseextraction(SPE)cartridge.500mg.3mL9
SN/T2800—2011
Condition carboxylic acid SPE cartridge with5mL ethyl acetate before using4
Apparatusandequipment
4.1High-performanceliquid chromatography-tandemmassspectrometer,equippedwithEsl.4.2
Centrifuge(2500g).
Vortexmixer.
Solidphaseextractionwithvacuumpump4.5 pH measurer.
4.6Plasticcentrifugetubewithcap:50mL.4.7
Electronicbalance.
Samplepreparation
5.1Preparationoftestsample
Mixthe sample,divideintotwo equal portions,and thenplace in clean containers separately.Oneuses as apreservedsampleand the other usesas atest sample.Inthecourse of samplepreparation,precautionmust betakento avoid the contaminationorany factors whichmay causethe changes ofresiduecontent.
5.2 Storage of sample
Thetestsamples shouldbedetected intime,iftheycan'ttheyshouldbe storedbelow-18℃DeterminationProcedure
Extraction
The sampleof royal jellywasweighed(accuratelyto2g)intoapolypropylene tubeanddissolved in5mLofNa,EDTA-Mcllvainebuffersolution,then5mLof methanolwasaddedasaprecipitatorforprotein.After violent shaking for1min.the sample solutionwas centrifuged at2500g for10 min.Theupper solutionwastransferred intoa50mLvolumetricflask.20mLof NazEDTA-Mcllvainebuff-ersolutionwasusedtoextractthetetracyclinesremaininginthedepositagain,andtransferred into10
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。