SN/T 3715-2013
基本信息
标准号: SN/T 3715-2013
中文名称:化妆品 体外发育毒性试验 大鼠全胚胎试验法
标准类别:商检行业标准(SN)
标准状态:现行
出版语种:简体中文
下载格式:.rar .pdf
下载大小:2414KB

标准分类号
关联标准
出版信息
相关单位信息
标准简介
SN/T 3715-2013 化妆品 体外发育毒性试验 大鼠全胚胎试验法
SN/T3715-2013
标准压缩包解压密码:www.bzxz.net
标准图片预览




标准内容
中华人民共和国出入境检验检疫行业标准SN/T3715—2013
化妆品
体外发育毒性试验
大鼠全胚胎试验法
Cosmetics-In vitro test method for embryotoxicity-Ratwholeembryoculturetest
2013-11-06发布
中华人民共和国
国家质量监督检验检疫总局
甜后蛋五伪
2014-06-01实施
本标准按照GB/T1.1-—2009给出的规则起草本标准由国家认证认可监督管理委员会提出并归口。SN/T3715—2013
本标准起草单位:中华人民共和国上海出人境检验检疫局、上海国家新药安全评价中心、上海市质量监督检验技术研究院。
标准主要起草人:李小林、杨捷琳、邱璐、蒋静、王艳、常艳、段文锋、林海霞、周耀斌、宁哺骏1范围
化妆品体外发育毒性试验
大鼠全胚胎试验法
本标准规定了化妆品及化妆品成分发育毒性试验大鼠全胚胎试验方法。本标准适用于化妆品及化妆品成分体外发育毒性检测。2规范性引用文件
SN/T3715—2013
下列文件对于本文件的应用是必不可少的凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注目期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB14925实验动物环境及设施
3术语和定义
下刻术语和定义适用手本文件
最大无效应浓度ICNOKCTMS
对形态学评分无影响的最大剂量3.2
最大抑制浓度ICmx
引起胚胎出现最大畸形的最低浓度。4基本原理
植入后大鼠全胚胎培养法可用于评价受试物是否引起胚胎发育毒性从而导致胚胎畸形。本方法使用的大鼠胚胎具有1~5个体节。通常情况下,这些胚胎与日龄更长的胚胎相比,其在心脏发育、神经管闭合、耳和眼的发育、臂杆和肢芽等方面对外来化合物更为敏感。对该阶段的干预可能引起生长迟缓、一个或多个器官原基的特定畸形。胚胎培养于旋转培养箱中有利于培养基与上方气相的气体交换。后者随着胚胎对氧气的需要量不断增加,应对培养基充氧。对培养的胚胎的形态进行评价。通过将暴露组的胚胎与对照组胚胎进行比较从面判断受试物是否具有胚胎毒性。5试验准备
5.1实验动物
5.1.1大鼠品系
任何经过阳性和阴性对照化合物的质量检测且具有大量胚胎/仔鼠的大鼠品系均可用于本试验。选用7~10周龄雕性大鼠,动物交配前适应2周。雄性大鼠至少10周龄以上。制备血清的大鼠体重至1
SN/T3715--2013
少要250g
2饲养条件
实验动物饲养条件应符合GB14925的要求。大鼠伺养于SPF级动物伺养室,环境温度为20℃~24℃,相对湿度50%~70%.自由摄食和饮水:每天通过动物一般行为观察动物健康状态材料和设备
解剖显微镜。
无菌手术剪刀、镊子。
100mm培养Ⅲl。
37℃旋转培养装置及转瓶(10mL以上)。5.2.4
多功能酶标仪
二氧化碳培养箱。
真空采血管。
BALB/c小鼠成纤维细胞3T3。
试剂。
DMEM培养基。
Hanks平衡盐溶液。
MTT。
0.25%胰蛋白酶。
二甲基亚砜。
乙醇。
5-氟尿嘧啶。
青霉素G。
6试验步骤
动物饲养
动物至少适应2周.由兽医完成全面的体格检查,包括:头、颈、胸、腹、外生殖器、皮肤和四肢等。饲料.垫料,水等均无影响本试验结果的已知污染物。12h明暗交替照明,自由摄食,饮水。动物交配前雄雄动物分笼饲养:交配后受孕按1~2只/笼饲养。6.2血清准备
雄性大鼠经CO,麻醉后经腹位固定,打开腹腔,暴露主动脉,用真空采血管采血,采血1min后将血液按1800rpm离心5min,收集血清并放于冰上。待所有血清收集完成后,将收集的血清再次以1800rpm离心3min。将血清置于56℃灭活30min.然后置于-20℃保存,血清使用前37C预热。6.3受试物准备
每个胚胎培养管加人2mL大鼠血清。受试物溶解于适当的溶剂.如HBSS.DMSO或甲醇,标准体积的受试物溶液在放人动物胚胎之前加到动物血清中。相同体积的溶剂对照加人到对照组中,之前的试验表明该体积的溶剂对照不会干扰胚胎的器官发育。溶剂的最大剂量为1%培养基(HBSS、水):0.125%DMSO和0.2%甲醇溶液。培养管经充气后加人胚胎。每组胚胎随机分配到不同剂量的实验2
SN/T3715—2013
组及对照组,从而保证各个剂量组胚胎的平均初始体节数较为一致。受试物组的胚胎数量与对照组相同。
6.4动物交配
雕性动物12h明暗交替照明,将6am~6pm作为暗期。在4pm~6pm之间将性成熟未经产且处于动情期的唯性动物与雄性动物1:1合宠交配,次日晨检查阴栓及阴道涂片,查到阴栓或阴道涂片发现精子的为交配成功,交配成功当日定为怀孕第0d。6.5胚胎分离
孕鼠在怀孕第10d上午进行胚胎分离。将孕鼠实行安乐处死,打开腹腔,暴露子宫,将怀孕子宫取下,放在无菌滤纸上,按子宫卵巢端向宫颈端方向将子宫壁开,用无菌弯头镊子分离蜕膜团,迅速将分离下的蜕膜团放人含有足量无菌平衡盐溶液的培养皿中,用显微外科镊子在体视显微镜下剥离蜕膜,并打开Richard's膜至外胎盘圆锥处。去除发育过小、弯曲或受损的胚胎,将卵黄囊完整的胚胎移入含有培养基的培养瓶中。含有1~5个体节的胚胎可用于培养。6.6胚胎培养
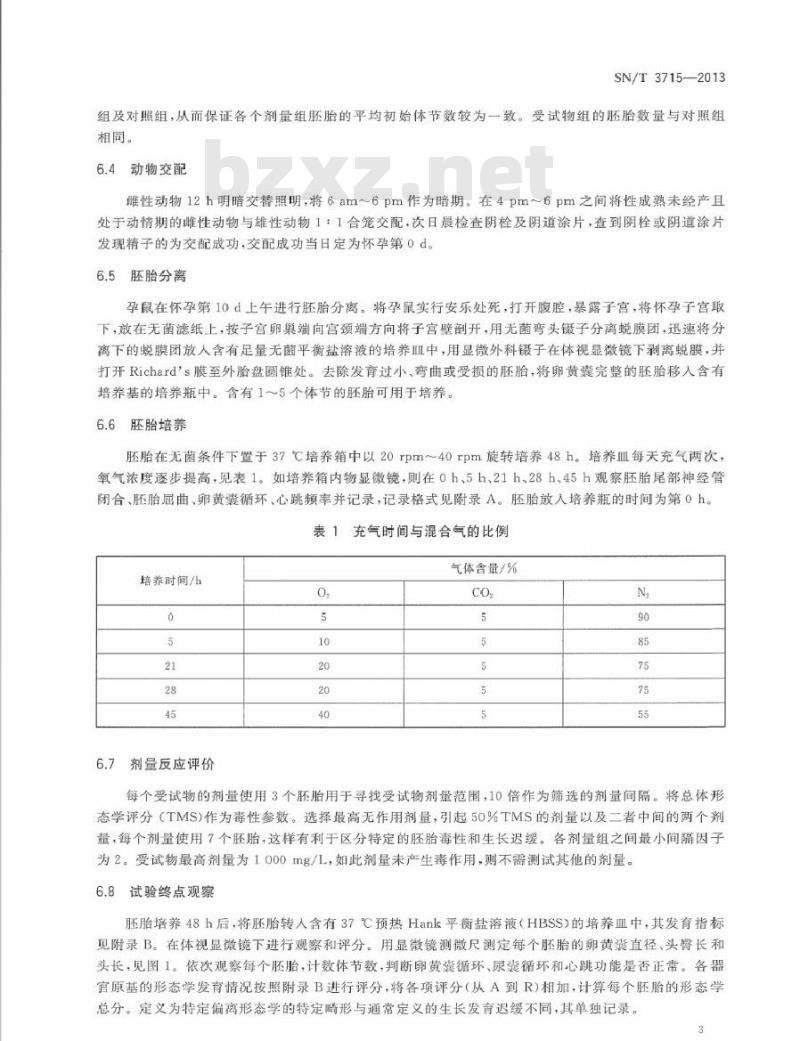
胚胎在无菌条件下置于37℃培养箱中以20rpm~40rpm旋转培养48h。培养血每天充气两次,氧气浓度逐步提高,见表1。如培养箱内物显微镜:则在0h、5h、21h、28h、45h观繁胚胎尾部神经管闭合、胚胎屈画、卵黄囊循环、心跳频率并记录,记录格式见附录A。胚胎人培养瓶的时间为第0h,表1充气时间与混合气的比例
培养时间/h
6.7剂量反应评价
气体含量/%
每个受试物的剂量使用3个胚胎用于寻找受试物剂量范围,10倍作为筛选的剂量间隔。将总体形态学评分TMS)作为毒性参数。选择最高无作用剂量,引起50%TMS的剂量以及一者中间的两个剂量,每个剂量使用7个胚胎,这样有利于区分特定的胚胎毒性和生长退缓。各剂量组之间最小间隔因子为2。受试物最高剂量为1000mg/L,如此剂量未产生毒作用,则不需测试其他的剂量。6.8试验终点观察
胚胎培养48h后,将胚胎转入含有37℃预热Hank平衡盐溶液(HBSS)的培养皿中,其发育指标见附录B。在体视显微镜下进行观察和评分。用显微镜测微尺测定每个胚胎的卵黄囊直径、头臀长和头长,见图1。依次观察每个胚胎,计数体节数,判断卵黄囊循环、尿囊循环和心跳功能是否正常。各器官原基的形态学发育情况按照附录B进行评分,将各项评分(从A到R)相加,计算每个胚胎的形态学总分。定义为特定偏离形态学的特定畸形与通常定义的生长发育迟缓不同,其单独记录。3
SN/T3715—2013
上额突
视觉系续
听力系统
6.9胚胎质量检查
散肢募
图1大鼠胚胎形态
后肢势
澳觉系统
体节形成
在培养前,应仔细检查胚胎卵黄囊内脏是否完整以及胚胎的形态,为确证胚胎培养正常发育,要评价只有溶剂无受试物的并行对照组的胚胎发育情况。对照组胚胎是否正常可通过同一实验室的历史对照数据获得。对照组胚胎最高可接受畸形率为15%1存)6.10试验质量检查
在受试物测试前,试验以5-氟尿嘧啶(0.03mg/t0.3mg/L和1mg/L)为阳性对照,青霉素G(1000mg/L)为阴性对照对试验进行质量检查,6.11BALB/c小鼠胚胎成纤维细胞3T3细胞培养BALB/c小鼠胚胎成纤维细胞3T3置于含有10%新生牛血清的DMEM培养液,在37℃,5%的二氧化碳(CO,)培养箱中培养。每周传代2~3次,或根据细胞生长的实际情况进行传代。试验开始前复苏细胞,待细胞处于对数生长期后开始试验。6.123T3组胞毒性测定
取处于对数生长期的3T3细胞,以5×10个/mL的密度接种于96孔版中,100uL/孔,培养24h后+加入不同浓度受试物溶液100L/孔,每个浓度组平行6-孔,继续培养48h。在培养结束前4h,每孔加人5mg/mL的MTT溶液20μl,继续培养4h。培养结束后,小心地将每孔中含3-(4,5-二甲基唑-2)-2.5-二苯基四氮唑漠盐(MTT)的培养液吸去,每孔加人150μL的DMSO,震动混句10min,在测定波长550nm,参考波长630nm条件下进行测定,求出IC。3T3细胞毒性的最高受试浓度为1 000mg/mL.
7发育毒性评价
7.1、数据收集
初始资料输人EXCEL电子表格,每个受试物形成单独文件,并进行独立统计。7.2观察终点
全胚胎观察终点分为4组(见附录B),生长参数包括卵黄囊直径,顶臂长和头长。功能参数包括心SN/T3715—2013
跳,卵黄囊循环和尿雾循环。大体形态参数包括最后减少的初始体节数和形态学参数A-尺。所有形态学参数均可能出现特定畸形,必须分开记录,记录格式见附录C。根据观察的终点将胚胎分为生长迟缓和特定胚胎毒性两类,即:生长迟缓指的是对胚胎的普遍效应引起与其他比例正常的胚胎相比,体积相对较小和/或多数或所有器官原基分化普遍迟缓;特定胚胎毒性指一个或多个器官原基(畸形)的特定效应,可能取决于受试物对胚胎的选择性作用。7.3预测模型
7.3.1预测模型1
本标准方法提供7种不同试验终点,分别根据式(1)计算功能I值,式(2)计算功能I值,根据式(3)计算功能Ⅲ值
功能1=18.08×log(IC50a)-11.56×log(ICxoecms)—10.19功能=21.55×log(IC50mal)-15.31×log(ICNoxs)-10.65功能=8.70xlog(IC50mal)—8.53×log(ICxocTms)—2.53式中:
IC50Mal
ICNX:TMS
引起50%胚胎出现畸形的半数抑制浓度:对形态学评分无影响的最大剂量。7.3.2预测模型2
(1)
(2)
由于预测模型1只考虑胚胎的分化和发育参数·并没有考虑受试物细胞毒性参数,模型2综合3T3细胞毒性试验参数,包括ICmx和IC5OsTs:分别采用式(4)计算功能1值,式(5)计算功能Ⅱ值根据式(6)计算功能Ⅲ值。
功能1=0.21×(IC50m-ICkopMs/IC50sa)×100+15.37×Ig(ICmx)-23.58功能=0.27X(IC50ms-ICNocTMs/IC50%m)×100+17.71XIg(ICmx)—32.37..功能Ⅲ=0.093×(IC50smaICNo此内容来自标准下载网
式中:
IC50sT%
ICNOFPA:TMS
7.4结果评价
T/1C50sm×100+4.21×Ig@ICax)—4.23引起50%的3T3细胞抑制的浓度
引起胚胎出现畸形的最低浓度,对形态学评分无影响的最大剂量·(4)
·(5)
...(6)
根据7.3中预测模型1或预测模型2的结果,将功能工、功能Ⅱ和功能Ⅲ进行分别比较,从面判断受试物是否具有胚胎毒性及胚胎毒性的强弱。如>Ⅱ,川则受试物判定为非胚胎毒性物质:如工Ⅲ则为判定受试物为弱胚胎毒性物质:如Ⅲ>工,Ⅱ则判定受试物为强胚胎毒性物质。SN/T3715—2013
项目编号
试验编号
血清批次
受试物
胚胎编号
初始体节数
培养等级
神经管
卵黄森循环
神经管
卵黄滋插环
附录A
(规范性附录)
培养胚胎发育记录
大鼠全胚胎培养试验胚胎发育记录表oh
温度和氧浓度检查表
氟气%
SN/T3715-—2013
SN/T3715—2013
项目编号:
试验编号:
胚胎编号:
初始体节数:
生长参数
卵黄囊直径/mm
头长/mm
尾长/mm
功能参数(1
卵黄聋循环
尿囊循环
体节发育
最终体节数
正常,0-
最终初始体节数
形态学积分
卵黄磷血管
力系统
上额突
异常)
形态学总分ETMS-S(A.·R)
畸形(正常为0,畸形为1)
脉管缺失
尿囊与外胎盘锥未融合
大体积尿裳
弯闻缺失
心包增大,充满液体
心脏前侧转动
后侧神经孔打开
背侧中线不规则
前脑打开
中脑打开
附录B
(规范性附录)
胚胎形态学评分表
大鼠全胚胎试验胚胎形态学评分记录表受试物
受试物浓度,
血清批庆
尾神经管
菱脑打开
前脑狭窄
喂觉系统
听力系统
腮条畸形
上颌突肿胀
顾神经翟缝合线不规则
头小且向后弯曲
面异常
神经管出血
菱脑偏大,透明
菱脑狭案
听能畸形
视池畸形
下颌突未到位置
小体节
体节不规则
尾扭结
短尾,偏细
皮下气泡
胚胎数
受试物
初始体节数
终体节数
印黄囊直径
畸形胚胎数
卵黄囊
神经管
后、中、前脑
视泡系统
畸形胚胎数
附录C
(规范性附录)
受试物测试记录
大鼠全胚胎培养试验受试物测试记录表培养液中受试物浓液度/(mg/L)
SN/T3715—2013
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
化妆品
体外发育毒性试验
大鼠全胚胎试验法
Cosmetics-In vitro test method for embryotoxicity-Ratwholeembryoculturetest
2013-11-06发布
中华人民共和国
国家质量监督检验检疫总局
甜后蛋五伪
2014-06-01实施
本标准按照GB/T1.1-—2009给出的规则起草本标准由国家认证认可监督管理委员会提出并归口。SN/T3715—2013
本标准起草单位:中华人民共和国上海出人境检验检疫局、上海国家新药安全评价中心、上海市质量监督检验技术研究院。
标准主要起草人:李小林、杨捷琳、邱璐、蒋静、王艳、常艳、段文锋、林海霞、周耀斌、宁哺骏1范围
化妆品体外发育毒性试验
大鼠全胚胎试验法
本标准规定了化妆品及化妆品成分发育毒性试验大鼠全胚胎试验方法。本标准适用于化妆品及化妆品成分体外发育毒性检测。2规范性引用文件
SN/T3715—2013
下列文件对于本文件的应用是必不可少的凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注目期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB14925实验动物环境及设施
3术语和定义
下刻术语和定义适用手本文件
最大无效应浓度ICNOKCTMS
对形态学评分无影响的最大剂量3.2
最大抑制浓度ICmx
引起胚胎出现最大畸形的最低浓度。4基本原理
植入后大鼠全胚胎培养法可用于评价受试物是否引起胚胎发育毒性从而导致胚胎畸形。本方法使用的大鼠胚胎具有1~5个体节。通常情况下,这些胚胎与日龄更长的胚胎相比,其在心脏发育、神经管闭合、耳和眼的发育、臂杆和肢芽等方面对外来化合物更为敏感。对该阶段的干预可能引起生长迟缓、一个或多个器官原基的特定畸形。胚胎培养于旋转培养箱中有利于培养基与上方气相的气体交换。后者随着胚胎对氧气的需要量不断增加,应对培养基充氧。对培养的胚胎的形态进行评价。通过将暴露组的胚胎与对照组胚胎进行比较从面判断受试物是否具有胚胎毒性。5试验准备
5.1实验动物
5.1.1大鼠品系
任何经过阳性和阴性对照化合物的质量检测且具有大量胚胎/仔鼠的大鼠品系均可用于本试验。选用7~10周龄雕性大鼠,动物交配前适应2周。雄性大鼠至少10周龄以上。制备血清的大鼠体重至1
SN/T3715--2013
少要250g
2饲养条件
实验动物饲养条件应符合GB14925的要求。大鼠伺养于SPF级动物伺养室,环境温度为20℃~24℃,相对湿度50%~70%.自由摄食和饮水:每天通过动物一般行为观察动物健康状态材料和设备
解剖显微镜。
无菌手术剪刀、镊子。
100mm培养Ⅲl。
37℃旋转培养装置及转瓶(10mL以上)。5.2.4
多功能酶标仪
二氧化碳培养箱。
真空采血管。
BALB/c小鼠成纤维细胞3T3。
试剂。
DMEM培养基。
Hanks平衡盐溶液。
MTT。
0.25%胰蛋白酶。
二甲基亚砜。
乙醇。
5-氟尿嘧啶。
青霉素G。
6试验步骤
动物饲养
动物至少适应2周.由兽医完成全面的体格检查,包括:头、颈、胸、腹、外生殖器、皮肤和四肢等。饲料.垫料,水等均无影响本试验结果的已知污染物。12h明暗交替照明,自由摄食,饮水。动物交配前雄雄动物分笼饲养:交配后受孕按1~2只/笼饲养。6.2血清准备
雄性大鼠经CO,麻醉后经腹位固定,打开腹腔,暴露主动脉,用真空采血管采血,采血1min后将血液按1800rpm离心5min,收集血清并放于冰上。待所有血清收集完成后,将收集的血清再次以1800rpm离心3min。将血清置于56℃灭活30min.然后置于-20℃保存,血清使用前37C预热。6.3受试物准备
每个胚胎培养管加人2mL大鼠血清。受试物溶解于适当的溶剂.如HBSS.DMSO或甲醇,标准体积的受试物溶液在放人动物胚胎之前加到动物血清中。相同体积的溶剂对照加人到对照组中,之前的试验表明该体积的溶剂对照不会干扰胚胎的器官发育。溶剂的最大剂量为1%培养基(HBSS、水):0.125%DMSO和0.2%甲醇溶液。培养管经充气后加人胚胎。每组胚胎随机分配到不同剂量的实验2
SN/T3715—2013
组及对照组,从而保证各个剂量组胚胎的平均初始体节数较为一致。受试物组的胚胎数量与对照组相同。
6.4动物交配
雕性动物12h明暗交替照明,将6am~6pm作为暗期。在4pm~6pm之间将性成熟未经产且处于动情期的唯性动物与雄性动物1:1合宠交配,次日晨检查阴栓及阴道涂片,查到阴栓或阴道涂片发现精子的为交配成功,交配成功当日定为怀孕第0d。6.5胚胎分离
孕鼠在怀孕第10d上午进行胚胎分离。将孕鼠实行安乐处死,打开腹腔,暴露子宫,将怀孕子宫取下,放在无菌滤纸上,按子宫卵巢端向宫颈端方向将子宫壁开,用无菌弯头镊子分离蜕膜团,迅速将分离下的蜕膜团放人含有足量无菌平衡盐溶液的培养皿中,用显微外科镊子在体视显微镜下剥离蜕膜,并打开Richard's膜至外胎盘圆锥处。去除发育过小、弯曲或受损的胚胎,将卵黄囊完整的胚胎移入含有培养基的培养瓶中。含有1~5个体节的胚胎可用于培养。6.6胚胎培养
胚胎在无菌条件下置于37℃培养箱中以20rpm~40rpm旋转培养48h。培养血每天充气两次,氧气浓度逐步提高,见表1。如培养箱内物显微镜:则在0h、5h、21h、28h、45h观繁胚胎尾部神经管闭合、胚胎屈画、卵黄囊循环、心跳频率并记录,记录格式见附录A。胚胎人培养瓶的时间为第0h,表1充气时间与混合气的比例
培养时间/h
6.7剂量反应评价
气体含量/%
每个受试物的剂量使用3个胚胎用于寻找受试物剂量范围,10倍作为筛选的剂量间隔。将总体形态学评分TMS)作为毒性参数。选择最高无作用剂量,引起50%TMS的剂量以及一者中间的两个剂量,每个剂量使用7个胚胎,这样有利于区分特定的胚胎毒性和生长退缓。各剂量组之间最小间隔因子为2。受试物最高剂量为1000mg/L,如此剂量未产生毒作用,则不需测试其他的剂量。6.8试验终点观察
胚胎培养48h后,将胚胎转入含有37℃预热Hank平衡盐溶液(HBSS)的培养皿中,其发育指标见附录B。在体视显微镜下进行观察和评分。用显微镜测微尺测定每个胚胎的卵黄囊直径、头臀长和头长,见图1。依次观察每个胚胎,计数体节数,判断卵黄囊循环、尿囊循环和心跳功能是否正常。各器官原基的形态学发育情况按照附录B进行评分,将各项评分(从A到R)相加,计算每个胚胎的形态学总分。定义为特定偏离形态学的特定畸形与通常定义的生长发育迟缓不同,其单独记录。3
SN/T3715—2013
上额突
视觉系续
听力系统
6.9胚胎质量检查
散肢募
图1大鼠胚胎形态
后肢势
澳觉系统
体节形成
在培养前,应仔细检查胚胎卵黄囊内脏是否完整以及胚胎的形态,为确证胚胎培养正常发育,要评价只有溶剂无受试物的并行对照组的胚胎发育情况。对照组胚胎是否正常可通过同一实验室的历史对照数据获得。对照组胚胎最高可接受畸形率为15%1存)6.10试验质量检查
在受试物测试前,试验以5-氟尿嘧啶(0.03mg/t0.3mg/L和1mg/L)为阳性对照,青霉素G(1000mg/L)为阴性对照对试验进行质量检查,6.11BALB/c小鼠胚胎成纤维细胞3T3细胞培养BALB/c小鼠胚胎成纤维细胞3T3置于含有10%新生牛血清的DMEM培养液,在37℃,5%的二氧化碳(CO,)培养箱中培养。每周传代2~3次,或根据细胞生长的实际情况进行传代。试验开始前复苏细胞,待细胞处于对数生长期后开始试验。6.123T3组胞毒性测定
取处于对数生长期的3T3细胞,以5×10个/mL的密度接种于96孔版中,100uL/孔,培养24h后+加入不同浓度受试物溶液100L/孔,每个浓度组平行6-孔,继续培养48h。在培养结束前4h,每孔加人5mg/mL的MTT溶液20μl,继续培养4h。培养结束后,小心地将每孔中含3-(4,5-二甲基唑-2)-2.5-二苯基四氮唑漠盐(MTT)的培养液吸去,每孔加人150μL的DMSO,震动混句10min,在测定波长550nm,参考波长630nm条件下进行测定,求出IC。3T3细胞毒性的最高受试浓度为1 000mg/mL.
7发育毒性评价
7.1、数据收集
初始资料输人EXCEL电子表格,每个受试物形成单独文件,并进行独立统计。7.2观察终点
全胚胎观察终点分为4组(见附录B),生长参数包括卵黄囊直径,顶臂长和头长。功能参数包括心SN/T3715—2013
跳,卵黄囊循环和尿雾循环。大体形态参数包括最后减少的初始体节数和形态学参数A-尺。所有形态学参数均可能出现特定畸形,必须分开记录,记录格式见附录C。根据观察的终点将胚胎分为生长迟缓和特定胚胎毒性两类,即:生长迟缓指的是对胚胎的普遍效应引起与其他比例正常的胚胎相比,体积相对较小和/或多数或所有器官原基分化普遍迟缓;特定胚胎毒性指一个或多个器官原基(畸形)的特定效应,可能取决于受试物对胚胎的选择性作用。7.3预测模型
7.3.1预测模型1
本标准方法提供7种不同试验终点,分别根据式(1)计算功能I值,式(2)计算功能I值,根据式(3)计算功能Ⅲ值
功能1=18.08×log(IC50a)-11.56×log(ICxoecms)—10.19功能=21.55×log(IC50mal)-15.31×log(ICNoxs)-10.65功能=8.70xlog(IC50mal)—8.53×log(ICxocTms)—2.53式中:
IC50Mal
ICNX:TMS
引起50%胚胎出现畸形的半数抑制浓度:对形态学评分无影响的最大剂量。7.3.2预测模型2
(1)
(2)
由于预测模型1只考虑胚胎的分化和发育参数·并没有考虑受试物细胞毒性参数,模型2综合3T3细胞毒性试验参数,包括ICmx和IC5OsTs:分别采用式(4)计算功能1值,式(5)计算功能Ⅱ值根据式(6)计算功能Ⅲ值。
功能1=0.21×(IC50m-ICkopMs/IC50sa)×100+15.37×Ig(ICmx)-23.58功能=0.27X(IC50ms-ICNocTMs/IC50%m)×100+17.71XIg(ICmx)—32.37..功能Ⅲ=0.093×(IC50smaICNo此内容来自标准下载网
式中:
IC50sT%
ICNOFPA:TMS
7.4结果评价
T/1C50sm×100+4.21×Ig@ICax)—4.23引起50%的3T3细胞抑制的浓度
引起胚胎出现畸形的最低浓度,对形态学评分无影响的最大剂量·(4)
·(5)
...(6)
根据7.3中预测模型1或预测模型2的结果,将功能工、功能Ⅱ和功能Ⅲ进行分别比较,从面判断受试物是否具有胚胎毒性及胚胎毒性的强弱。如>Ⅱ,川则受试物判定为非胚胎毒性物质:如工Ⅲ则为判定受试物为弱胚胎毒性物质:如Ⅲ>工,Ⅱ则判定受试物为强胚胎毒性物质。SN/T3715—2013
项目编号
试验编号
血清批次
受试物
胚胎编号
初始体节数
培养等级
神经管
卵黄森循环
神经管
卵黄滋插环
附录A
(规范性附录)
培养胚胎发育记录
大鼠全胚胎培养试验胚胎发育记录表oh
温度和氧浓度检查表
氟气%
SN/T3715-—2013
SN/T3715—2013
项目编号:
试验编号:
胚胎编号:
初始体节数:
生长参数
卵黄囊直径/mm
头长/mm
尾长/mm
功能参数(1
卵黄聋循环
尿囊循环
体节发育
最终体节数
正常,0-
最终初始体节数
形态学积分
卵黄磷血管
力系统
上额突
异常)
形态学总分ETMS-S(A.·R)
畸形(正常为0,畸形为1)
脉管缺失
尿囊与外胎盘锥未融合
大体积尿裳
弯闻缺失
心包增大,充满液体
心脏前侧转动
后侧神经孔打开
背侧中线不规则
前脑打开
中脑打开
附录B
(规范性附录)
胚胎形态学评分表
大鼠全胚胎试验胚胎形态学评分记录表受试物
受试物浓度,
血清批庆
尾神经管
菱脑打开
前脑狭窄
喂觉系统
听力系统
腮条畸形
上颌突肿胀
顾神经翟缝合线不规则
头小且向后弯曲
面异常
神经管出血
菱脑偏大,透明
菱脑狭案
听能畸形
视池畸形
下颌突未到位置
小体节
体节不规则
尾扭结
短尾,偏细
皮下气泡
胚胎数
受试物
初始体节数
终体节数
印黄囊直径
畸形胚胎数
卵黄囊
神经管
后、中、前脑
视泡系统
畸形胚胎数
附录C
(规范性附录)
受试物测试记录
大鼠全胚胎培养试验受试物测试记录表培养液中受试物浓液度/(mg/L)
SN/T3715—2013
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。