SN/T 5099-2019
基本信息
标准号: SN/T 5099-2019
中文名称:国境口岸亨德拉病毒实时荧光RT-PCR检测方法
标准类别:商检行业标准(SN)
标准状态:现行
出版语种:简体中文
下载格式:.zip .pdf
下载大小:3383496
相关标签: 国境 口岸 德拉 病毒 实时 荧光 PCR 检测 方法

标准分类号
关联标准
出版信息
相关单位信息
标准简介
标准号:SN/T 5099-2019
标准名称:国境口岸亨德拉病毒实时荧光RT-PCR检测方法
英文名称:Detection method for Hendra Virus by real-time fluorescence Rt-Pcr at frontier ports
标准格式:PDF
发布时间:2019-09-03
实施时间:2020-03-01
标准大小:3621K
标准介绍:本标准规定了国境口岸享德拉病毒检测的生物安全要求、标本的采集、运输和保存、标本的处理,亨德拉病毒实时荧光RT-PCR检测方法
本标准适用于国境口岸入出境人员携带亨德拉病毒的核酸检测
2规范性引用文件
列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件
GB19489实验室生物安全通用要求
WS/T230临床诊断中聚合酶链反应(PCR)技术的应用
S233病原微生物实验室生物安全通用准则
可感染人类的高致病性病原微生物菌(毒)种或样本运输管理规定(原中华人民共和国卫生部令第间传染的病原微生物菌(毒)种保藏机构管理办法(原中华人民共和国卫生部)
司传染的病原微生物名录(原中华人民共和国卫生部)
标准名称:国境口岸亨德拉病毒实时荧光RT-PCR检测方法
英文名称:Detection method for Hendra Virus by real-time fluorescence Rt-Pcr at frontier ports
标准格式:PDF
发布时间:2019-09-03
实施时间:2020-03-01
标准大小:3621K
标准介绍:本标准规定了国境口岸享德拉病毒检测的生物安全要求、标本的采集、运输和保存、标本的处理,亨德拉病毒实时荧光RT-PCR检测方法
本标准适用于国境口岸入出境人员携带亨德拉病毒的核酸检测
2规范性引用文件
列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件
GB19489实验室生物安全通用要求
WS/T230临床诊断中聚合酶链反应(PCR)技术的应用
S233病原微生物实验室生物安全通用准则
可感染人类的高致病性病原微生物菌(毒)种或样本运输管理规定(原中华人民共和国卫生部令第间传染的病原微生物菌(毒)种保藏机构管理办法(原中华人民共和国卫生部)
司传染的病原微生物名录(原中华人民共和国卫生部)
标准图片预览




标准内容
ICS11.020
中华人民共和国出入境检验检疫行业标准SN/T5099—2019
国境口岸德拉病毒实时荧光
RT-PCR检测方法
Detection method for Hendra Virus by real-time fluorescence RT-PCR atfrontier ports
行业标准信息服务平台
2019-09-03发布
中华人民共和国海关总署
2020-03-01实施
本标准根据GB/T1.1—2009给出的规则起草。本标准由中华人民共和国海关总署提出并归口。SN/T5099—2019
本标准起草单位:中国检验检疫科学研究院、新疆国际旅行卫生保健中心、深圳市检验检疫科学研究院、中华人民共和国广州海关。本标准主要起草人:马雪征、杨烨、林燕如、张丽萍、胡孔新、史蕾、孙肖红行业标准信息服务平台
1范围
国境口岸亨德拉病毒实时荧光
RT-PCR检测方法
SN/T5099—2019
本标准规定国境口岸亨德拉病毒检测的生物安全要求、标本的采集、运输和保存、标本的处理,享德拉病毒实时荧光RT-PCR检测方法。本标准适用于国境口岸人出境人员携带亨德拉病毒的核酸检测。2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB19489实验室生物安全通用要求WS/T230临床诊断中聚合酶链反应(PCR)技术的应用WS233病原微生物实验室生物安全通用准则可感染人类的高致病性病原微生物菌(毒)种或样本运输管理规定(原中华人民共和国卫生部令第45号)
人间传染的病原微生物菌(毒)种保藏机构管理办法(原中华人民共和国卫生部人间传染的病原微生物名录(原中华人民共和国卫生部)行业标准信
3术语和定义
下列术语和定义适用于本文件
亨德拉病毒(Hendravirus,Hev)亨德拉病毒属于亨德拉尼帕属(Henipavirus),是副粘病每科(aramyrouiridae)的一个新病毒类别。亨德拉病毒是一种人畜共患病病毒,于1994年在澳大利亚昆士兰州有斯班郊区的亨德拉首次被发现,能引起严重的呼吸道疾病。到目前为止HeV感染的人类病例均是悠染马有密切接触的人,因此密切接触是HeV的传播途径之一。HeV病毒造成的疾病的典型特征是严重时平吸难和高死亡率,还表现为人接触性感染。人感染后发病初期有显著的呼吸道症状,伴有发热和肌痛;有的出现神经症状,常表现中度脑炎。
实时荧光RT-PCRreal-timefluorescenceRT-PCR实时荧光RT-PCR方法是在常规RT-PCR的基础上,加入一条特异性的实时荧光探针。该探针为一段寡核苷酸,两端分别标记一个报告基团和一个淬灭实时荧光基团。探针完整时,报告基团发射的实时荧光信号被淬灭基团吸收:PCR扩增时,利用Taq酶的5'-3'外切酶活性将探针酶切降解,使报告实时荧光基团和率灭基团分离,从而实时荧光监测系统可以接受到实时荧光信号。每个反应管内的实时荧光信号达到设定的阈值时所经历的循环数,用Ct值表示。1
SN/T 5099—2019
Ct值是每个反应管内的荧光信号达到设定的阅值时所经历的循环数。4
缩略语
下列缩略语适用于本文件。
DEPC:焦碳酸乙二酯(diethylpyrocarbonate)FAM:6-羧基-荧光素(6-carboxy-fluorescein)BHQl:黑洞淬灭基团(blackholequencherl)5检测对象
出入境口岸发现的可疑病例。
实验室生物安全和PCR防污染要求6
按照GB19489、《人间传染的病原微生物名录》和《可感染人类的高致病性病原微生物菌(毒)种或样本运输管理规定》的要求,相关材料的生物安全要求如下:亨德拉病毒危害程度分类为第一类;个人防护遵循GB19489;
实验室应遵循GB19489和WS233,未经培养的感染性材料的操作应在生物安全Ⅲ级(BSL-3或ABSL-3)实验室内进行,灭活材料在生物安全IⅡ级(BSL-2)实验室内进行;亨德拉病毒感染性材料运输包装分类为A类,UN编号为UN2814;使用过的实验用品应遵照GB19189对废弃物的处理要求进行无害化处理;疑似亨德拉病毒材料的包装卫转运应符合原中华人民共和国卫生部第45号令;PCR防污染措施按照WS/T230的规能执行准信息服务平台
7仪器
本标准使用的主要仪器如下:
实时荧光PCR仪;
超净工作台;
二级生物安全柜;
高压灭菌锅;
低温高速离心机:最大离心力20000g;漩涡振荡器;
冰箱:4℃-20℃和-70℃;
移液器:10μL、20μL、100μL、200μL和1mL;恒温水浴锅;免费标准下载网bzxz
无菌注射器。
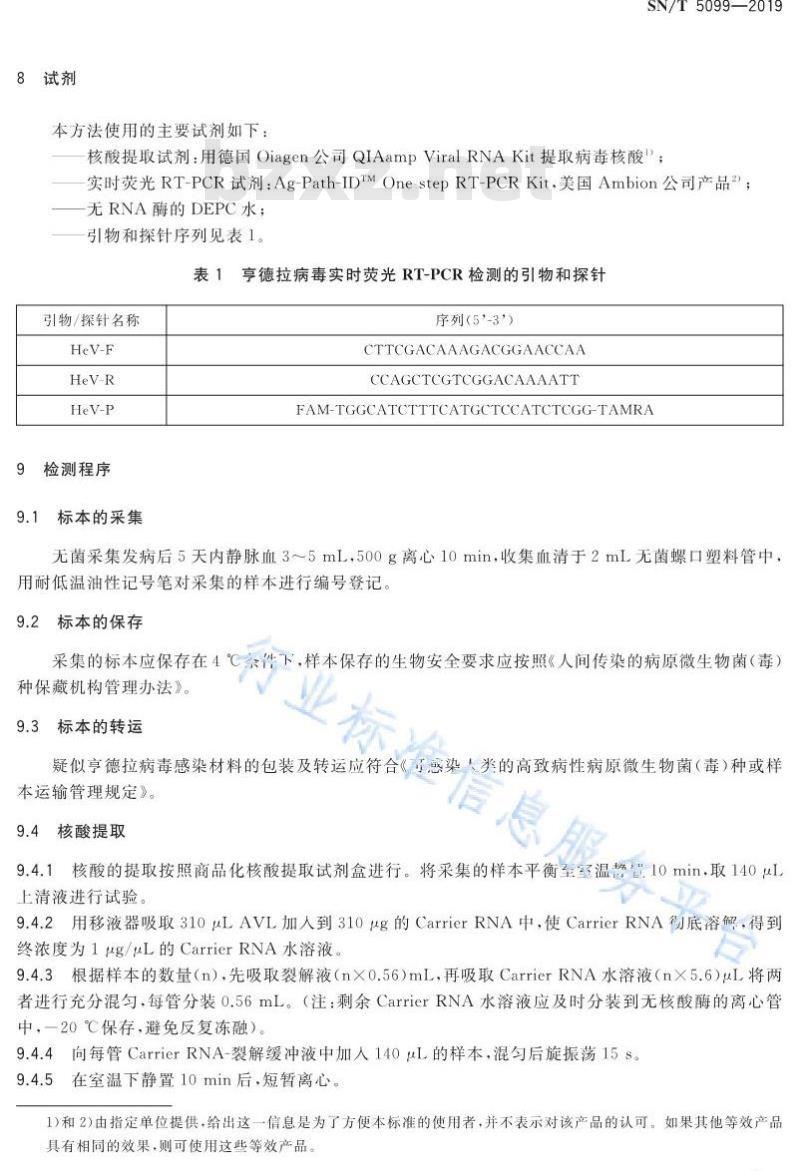
8试剂
本方法使用的主要试剂如下:
SN/T5099—2019
核酸提取试剂:用德国Oiagen公司QIAampViralRNAKit提取病毒核酸:实时荧光RT-PCR试剂:Ag-Path-IDTMOnestepRT-PCRKit.美国Ambion公司产品2:一无RNA酶的DEPC水;
引物和探针序列见表1。
表1亨德拉病毒实时荧光RT-PCR检测的引物和探针引物/探针名称
9检测程序
9.1标本的采集
序列(5°-3\)
CTTCGACAAAGACGGAACCAA
CCAGCTCGTCGGACAAAATT
FAM-TGGCATCTTTCATGCTCCATCTCGG-TAMRA无菌采集发病后5天内静脉血3~5mL,500g离心10min,收集血清于2mL无菌螺口塑料管中用耐低温油性记号笔对采集的样本进行编号登记,9.2标本的保存
采集的标本应保存在4℃余件下,样本保存的生物安全要求应按照《人间传染的病原微生物菌(毒)种保藏机构管理办法》。
9.3标本的转运
疑似亨德拉病毒感染材料的包装及转运应符合《感染类的高致病性病原微生物菌(毒)种或样本运输管理规定》。
9.4核酸提取
9.4.1核酸的提取按照商品化核酸提取试剂盒进行。将采集的样本平衡至室温量10min,取140uL上清液进行试验。
9.4.2用移液器吸取310μLAVL加人到310uμg的CarrierRNA中,使CarrierRNA彻底容解,得到终浓度为1μg/uL的CarrierRNA水溶液。9.4.3根据样本的数量(n),先吸取裂解液(nX0.56)mL,再吸取CarrierRNA水溶液(nX5.6)uL将两者进行充分混匀,每管分装0.56mL。(注:剩余CarrierRNA水溶液应及时分装到无核酸酶的离心管中,一20℃保存,避免反复冻融)。9.4.4向每管CarrierRNA-裂解缓冲液中加人140uL的样本,混勾后旋振荡15s。9.4.5
在室温下静置10min后,短暂离心。1)和2)由指定单位提供,给出这一信息是为了方便本标准的使用者,并不表示对该产品的认可。如果其他等效产品具有相同的效果,则可使用这些等效产品。3
SN/T5099—2019
9.4.6加人560L的无水乙醇,并涡旋振荡15s。9.4.7短暂离心后,吸取离心管中的630uL混合液(包括CarrierRNA裂解缓冲液、采集液及无水乙醇),转移到带有离心管的吸附柱内,以6000g离心1min。9.4.8弃掉废液,将吸附柱放回收集管,将剩余的630uL混合液转移至带有离心管的吸附柱内,以6000g离心1min。
9.4.9弃掉废液,将吸附柱放回收集管并向吸附柱内加人缓冲液AW1(使用前检查是否已加入无水乙醇)500μL.盖上盖子,6000g离心1min。9.4.10弃掉废液,将吸附柱放回收集管并向吸附柱内加人漂洗液AW2(使用前检查是否已加入无水乙醇)500μL,13400g离心1min。9.4.11弃掉废液,将吸附柱放回收集管,13400g离心30s,弃掉废液。9.4.12将吸附柱放置在一支无核酸酶的离心管上,并向离心柱内加入60μL的无核酸酶的水,室温静置2min。
9.4.13以13400g,离心2min,弃掉吸附柱,离心管内的液体即为病毒的核酸水溶液,做好标记一80℃保存待用。
9.5实时荧光RT-PGR检测体系
实时荧光RT-PCR反应体系配置(在体系配置区),按表2中的顺序,依次加人:表2亨德拉病毒核酸实时荧光定量RT-PGR检测试剂反应液各成分名称
无RNA酶水
2XRT-PCRBuffer
Hev-F(10 μM)
业标准信
Hev-R(10)
Hev-P(10μM)
25×RT-PCREnzyme
模板RNA
用量(μL)
同时设立阴性对照和阳性对照,阳性对照模板可为亨德拉病每核酸,也可为根据病毒核苷酸序列体外合成的RNA片段,阴性对照模板为不含亨德拉病毒核酸的标本或无IN海的水。务平
9.6实时荧光RT-PGR扩增反应
实时荧光PCR反应(在核酸扩增区):将加好样的PCR反应管分别转移到实时荧光PCR检测仪上进行扩增反应,程序设置为以ABIPrism7500型全自动实时荧光PCR检测仪为例说明,将实时表光信号设置为:ReporterDyel:FAM,QuencherDyel:TAM,PassiveReference:ROX(视所选用的实时荧光PCR反应试剂而定)。实时荧光PCR扩增程序为:48℃30min,95℃10min;95℃15s.60℃1min(收集荧光信号),45个循环。如使用其它仪器,应根据其它仪器的要求设置具体的反应条件。9.7结果分析
阀值确定
阈值确定的方法对所有的标本都是统一的,一般是以实时荧光PCR反应的前3~15个循环的荧光4
SN/T5099—2019
信号作为荧光本底信号,以本底信号标准差的10倍作为荧光阈值,以标本扩增产生的实时荧光信号达到荧光阈值时所对应的循环数为循环阈值(Ct值)。9.7.2质量控制
反应结果应同时符合以下两个条件:阴性对照无扩增曲线,Ct值应显示无扩增曲线或40阳性对照Ct值<35并有明显的扩增曲线:如不满足以上两个条件,此次检测结果无效,需重做。9.8结果判定
在满足以上两个质量控制的条件下,根据以下条件进行结果判定:Ct值应显示无扩增曲线或≥40,且无明显扩增曲线,判断为亨德拉病毒实时荧光RT-PCR检测阴性;
Ct值≤36.并有明显扩增曲线,初步判断为亨德拉病毒实时荧光RT-PCR检测阳性:一检测样品36小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国出入境检验检疫行业标准SN/T5099—2019
国境口岸德拉病毒实时荧光
RT-PCR检测方法
Detection method for Hendra Virus by real-time fluorescence RT-PCR atfrontier ports
行业标准信息服务平台
2019-09-03发布
中华人民共和国海关总署
2020-03-01实施
本标准根据GB/T1.1—2009给出的规则起草。本标准由中华人民共和国海关总署提出并归口。SN/T5099—2019
本标准起草单位:中国检验检疫科学研究院、新疆国际旅行卫生保健中心、深圳市检验检疫科学研究院、中华人民共和国广州海关。本标准主要起草人:马雪征、杨烨、林燕如、张丽萍、胡孔新、史蕾、孙肖红行业标准信息服务平台
1范围
国境口岸亨德拉病毒实时荧光
RT-PCR检测方法
SN/T5099—2019
本标准规定国境口岸亨德拉病毒检测的生物安全要求、标本的采集、运输和保存、标本的处理,享德拉病毒实时荧光RT-PCR检测方法。本标准适用于国境口岸人出境人员携带亨德拉病毒的核酸检测。2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB19489实验室生物安全通用要求WS/T230临床诊断中聚合酶链反应(PCR)技术的应用WS233病原微生物实验室生物安全通用准则可感染人类的高致病性病原微生物菌(毒)种或样本运输管理规定(原中华人民共和国卫生部令第45号)
人间传染的病原微生物菌(毒)种保藏机构管理办法(原中华人民共和国卫生部人间传染的病原微生物名录(原中华人民共和国卫生部)行业标准信
3术语和定义
下列术语和定义适用于本文件
亨德拉病毒(Hendravirus,Hev)亨德拉病毒属于亨德拉尼帕属(Henipavirus),是副粘病每科(aramyrouiridae)的一个新病毒类别。亨德拉病毒是一种人畜共患病病毒,于1994年在澳大利亚昆士兰州有斯班郊区的亨德拉首次被发现,能引起严重的呼吸道疾病。到目前为止HeV感染的人类病例均是悠染马有密切接触的人,因此密切接触是HeV的传播途径之一。HeV病毒造成的疾病的典型特征是严重时平吸难和高死亡率,还表现为人接触性感染。人感染后发病初期有显著的呼吸道症状,伴有发热和肌痛;有的出现神经症状,常表现中度脑炎。
实时荧光RT-PCRreal-timefluorescenceRT-PCR实时荧光RT-PCR方法是在常规RT-PCR的基础上,加入一条特异性的实时荧光探针。该探针为一段寡核苷酸,两端分别标记一个报告基团和一个淬灭实时荧光基团。探针完整时,报告基团发射的实时荧光信号被淬灭基团吸收:PCR扩增时,利用Taq酶的5'-3'外切酶活性将探针酶切降解,使报告实时荧光基团和率灭基团分离,从而实时荧光监测系统可以接受到实时荧光信号。每个反应管内的实时荧光信号达到设定的阈值时所经历的循环数,用Ct值表示。1
SN/T 5099—2019
Ct值是每个反应管内的荧光信号达到设定的阅值时所经历的循环数。4
缩略语
下列缩略语适用于本文件。
DEPC:焦碳酸乙二酯(diethylpyrocarbonate)FAM:6-羧基-荧光素(6-carboxy-fluorescein)BHQl:黑洞淬灭基团(blackholequencherl)5检测对象
出入境口岸发现的可疑病例。
实验室生物安全和PCR防污染要求6
按照GB19489、《人间传染的病原微生物名录》和《可感染人类的高致病性病原微生物菌(毒)种或样本运输管理规定》的要求,相关材料的生物安全要求如下:亨德拉病毒危害程度分类为第一类;个人防护遵循GB19489;
实验室应遵循GB19489和WS233,未经培养的感染性材料的操作应在生物安全Ⅲ级(BSL-3或ABSL-3)实验室内进行,灭活材料在生物安全IⅡ级(BSL-2)实验室内进行;亨德拉病毒感染性材料运输包装分类为A类,UN编号为UN2814;使用过的实验用品应遵照GB19189对废弃物的处理要求进行无害化处理;疑似亨德拉病毒材料的包装卫转运应符合原中华人民共和国卫生部第45号令;PCR防污染措施按照WS/T230的规能执行准信息服务平台
7仪器
本标准使用的主要仪器如下:
实时荧光PCR仪;
超净工作台;
二级生物安全柜;
高压灭菌锅;
低温高速离心机:最大离心力20000g;漩涡振荡器;
冰箱:4℃-20℃和-70℃;
移液器:10μL、20μL、100μL、200μL和1mL;恒温水浴锅;免费标准下载网bzxz
无菌注射器。
8试剂
本方法使用的主要试剂如下:
SN/T5099—2019
核酸提取试剂:用德国Oiagen公司QIAampViralRNAKit提取病毒核酸:实时荧光RT-PCR试剂:Ag-Path-IDTMOnestepRT-PCRKit.美国Ambion公司产品2:一无RNA酶的DEPC水;
引物和探针序列见表1。
表1亨德拉病毒实时荧光RT-PCR检测的引物和探针引物/探针名称
9检测程序
9.1标本的采集
序列(5°-3\)
CTTCGACAAAGACGGAACCAA
CCAGCTCGTCGGACAAAATT
FAM-TGGCATCTTTCATGCTCCATCTCGG-TAMRA无菌采集发病后5天内静脉血3~5mL,500g离心10min,收集血清于2mL无菌螺口塑料管中用耐低温油性记号笔对采集的样本进行编号登记,9.2标本的保存
采集的标本应保存在4℃余件下,样本保存的生物安全要求应按照《人间传染的病原微生物菌(毒)种保藏机构管理办法》。
9.3标本的转运
疑似亨德拉病毒感染材料的包装及转运应符合《感染类的高致病性病原微生物菌(毒)种或样本运输管理规定》。
9.4核酸提取
9.4.1核酸的提取按照商品化核酸提取试剂盒进行。将采集的样本平衡至室温量10min,取140uL上清液进行试验。
9.4.2用移液器吸取310μLAVL加人到310uμg的CarrierRNA中,使CarrierRNA彻底容解,得到终浓度为1μg/uL的CarrierRNA水溶液。9.4.3根据样本的数量(n),先吸取裂解液(nX0.56)mL,再吸取CarrierRNA水溶液(nX5.6)uL将两者进行充分混匀,每管分装0.56mL。(注:剩余CarrierRNA水溶液应及时分装到无核酸酶的离心管中,一20℃保存,避免反复冻融)。9.4.4向每管CarrierRNA-裂解缓冲液中加人140uL的样本,混勾后旋振荡15s。9.4.5
在室温下静置10min后,短暂离心。1)和2)由指定单位提供,给出这一信息是为了方便本标准的使用者,并不表示对该产品的认可。如果其他等效产品具有相同的效果,则可使用这些等效产品。3
SN/T5099—2019
9.4.6加人560L的无水乙醇,并涡旋振荡15s。9.4.7短暂离心后,吸取离心管中的630uL混合液(包括CarrierRNA裂解缓冲液、采集液及无水乙醇),转移到带有离心管的吸附柱内,以6000g离心1min。9.4.8弃掉废液,将吸附柱放回收集管,将剩余的630uL混合液转移至带有离心管的吸附柱内,以6000g离心1min。
9.4.9弃掉废液,将吸附柱放回收集管并向吸附柱内加人缓冲液AW1(使用前检查是否已加入无水乙醇)500μL.盖上盖子,6000g离心1min。9.4.10弃掉废液,将吸附柱放回收集管并向吸附柱内加人漂洗液AW2(使用前检查是否已加入无水乙醇)500μL,13400g离心1min。9.4.11弃掉废液,将吸附柱放回收集管,13400g离心30s,弃掉废液。9.4.12将吸附柱放置在一支无核酸酶的离心管上,并向离心柱内加入60μL的无核酸酶的水,室温静置2min。
9.4.13以13400g,离心2min,弃掉吸附柱,离心管内的液体即为病毒的核酸水溶液,做好标记一80℃保存待用。
9.5实时荧光RT-PGR检测体系
实时荧光RT-PCR反应体系配置(在体系配置区),按表2中的顺序,依次加人:表2亨德拉病毒核酸实时荧光定量RT-PGR检测试剂反应液各成分名称
无RNA酶水
2XRT-PCRBuffer
Hev-F(10 μM)
业标准信
Hev-R(10)
Hev-P(10μM)
25×RT-PCREnzyme
模板RNA
用量(μL)
同时设立阴性对照和阳性对照,阳性对照模板可为亨德拉病每核酸,也可为根据病毒核苷酸序列体外合成的RNA片段,阴性对照模板为不含亨德拉病毒核酸的标本或无IN海的水。务平
9.6实时荧光RT-PGR扩增反应
实时荧光PCR反应(在核酸扩增区):将加好样的PCR反应管分别转移到实时荧光PCR检测仪上进行扩增反应,程序设置为以ABIPrism7500型全自动实时荧光PCR检测仪为例说明,将实时表光信号设置为:ReporterDyel:FAM,QuencherDyel:TAM,PassiveReference:ROX(视所选用的实时荧光PCR反应试剂而定)。实时荧光PCR扩增程序为:48℃30min,95℃10min;95℃15s.60℃1min(收集荧光信号),45个循环。如使用其它仪器,应根据其它仪器的要求设置具体的反应条件。9.7结果分析
阀值确定
阈值确定的方法对所有的标本都是统一的,一般是以实时荧光PCR反应的前3~15个循环的荧光4
SN/T5099—2019
信号作为荧光本底信号,以本底信号标准差的10倍作为荧光阈值,以标本扩增产生的实时荧光信号达到荧光阈值时所对应的循环数为循环阈值(Ct值)。9.7.2质量控制
反应结果应同时符合以下两个条件:阴性对照无扩增曲线,Ct值应显示无扩增曲线或40阳性对照Ct值<35并有明显的扩增曲线:如不满足以上两个条件,此次检测结果无效,需重做。9.8结果判定
在满足以上两个质量控制的条件下,根据以下条件进行结果判定:Ct值应显示无扩增曲线或≥40,且无明显扩增曲线,判断为亨德拉病毒实时荧光RT-PCR检测阴性;
Ct值≤36.并有明显扩增曲线,初步判断为亨德拉病毒实时荧光RT-PCR检测阳性:一检测样品36