SN/T 3306.11-2017
基本信息
标准号: SN/T 3306.11-2017
中文名称:国境口岸环介导恒温扩增(LAMP)检测方法第11部分:副溶血性弧菌
标准类别:商检行业标准(SN)
标准状态:现行
出版语种:简体中文
下载格式:.zip .pdf
下载大小:5338789
相关标签: 国境 口岸 介导 恒温 扩增 检测 方法 溶血性 弧菌

标准分类号
关联标准
出版信息
相关单位信息
标准简介
SN/T 3306.11-2017.Loop-mediated isothermal amplification detection method at frontier port- Part 1 1:Vibrio parahaemolyticus.
1范围
SN/T 3306.11规定了在国境口岸利用环介导恒温核酸扩增(LAMP)法检测副溶血性弧菌的检测对象、检测程序及检测结果的报告。
SN/T 3306.11适用于国境口岸副溶血性弧菌菌株的筛选检测。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB4789.7食品安全国家标准食品微生物学检验副溶血性弧菌检验
GB/T 6682分析实验室用水规格和试验方法
GB 19489实验室生物安 全通用要求
WS/T230临床诊断中聚合酶链反应(PCR)技术的应用
WS271感染性腹泻诊断标准
人间传染的病原微生物名录(卫科教发[2006]15号)
4生物安全及 防污染措施
实验生物安全要求、操作及处理按照GB19489和《人间传染的病原微生物名录》的规定执行,由通过生物安全培训并具备资质的工作人员进行。防止污染措施应符合WS/T 230的规定。
5技术概要
根据副溶血性弧菌的特异性毒力基因序列设计特异性内外引物及环状引物各一对,共三对引物,特异性识别靶序列上的M36437基因,利用Bst酶启动循环链置换反应,在特异性基因序列启动互补链合成,在同一链上互补序列周而复始形成有很多环的花椰菜结构的茎环DNA混合物;从dNTP析出的焦磷酸根离子与反应溶液中的Mg2+结合,产生副产物(焦磷酸镁)形成乳白色沉淀,即可通过反应液中的浑浊程度判定结果。亦可加人显色液,通过观察颜色变化判定结果。
1范围
SN/T 3306.11规定了在国境口岸利用环介导恒温核酸扩增(LAMP)法检测副溶血性弧菌的检测对象、检测程序及检测结果的报告。
SN/T 3306.11适用于国境口岸副溶血性弧菌菌株的筛选检测。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB4789.7食品安全国家标准食品微生物学检验副溶血性弧菌检验
GB/T 6682分析实验室用水规格和试验方法
GB 19489实验室生物安 全通用要求
WS/T230临床诊断中聚合酶链反应(PCR)技术的应用
WS271感染性腹泻诊断标准
人间传染的病原微生物名录(卫科教发[2006]15号)
4生物安全及 防污染措施
实验生物安全要求、操作及处理按照GB19489和《人间传染的病原微生物名录》的规定执行,由通过生物安全培训并具备资质的工作人员进行。防止污染措施应符合WS/T 230的规定。
5技术概要
根据副溶血性弧菌的特异性毒力基因序列设计特异性内外引物及环状引物各一对,共三对引物,特异性识别靶序列上的M36437基因,利用Bst酶启动循环链置换反应,在特异性基因序列启动互补链合成,在同一链上互补序列周而复始形成有很多环的花椰菜结构的茎环DNA混合物;从dNTP析出的焦磷酸根离子与反应溶液中的Mg2+结合,产生副产物(焦磷酸镁)形成乳白色沉淀,即可通过反应液中的浑浊程度判定结果。亦可加人显色液,通过观察颜色变化判定结果。
标准图片预览




标准内容
中华人民共和国出入境检验检疫行业标准SN/T3306.11—2017
国境口岸环介导恒温扩增
(LAMP)检测方法
第11部分:副溶血性弧菌
Loop-mediated isothermal amplification detection methodat frontier portPart 11:Vibrio parahaemolyticus2017-05-12发布
中华人民共和国
国家质量监督检验检疫总局
2017-12-01实施
SN/T3306《国境口岸环介导恒温扩增(LAMP)检测方法》分为14个部分:第1部分:鼠疫杆菌;
第2部分:产毒素霍乱弧菌;
第3部分:志贺氏菌;
第4部分:嗜肺军团菌;
第5部分:布鲁氏菌;
第6部分:黄热病毒:
第7部分:猴痘病毒;
第8部分:基孔肯雅病毒;
第9部分:结核分枝杆菌;
第10部分:炭疽芽孢杆菌;
第11部分:副溶血性弧菌;
第12部分:空肠弯曲菌:
第13部分:疟原虫;
第14部分:大肠杆菌0157:H7。本部分为SN/T3306的第11部分。本部分按照GB/T1.1-2009给出的规则起草SN/T3306.11—2017
请注意本文件的某些内容可能涉及专利。本文件的发布机构不承担识别这些专利的责任。本部分由国家认证认可监督管理委员会提出并归口。本部分起草单位:中华人民共和国天津出入境检验检疫局、中华人民共和国北京出入境检验检疫局、中华人民共和国河北出人境检验检疫局。本部分主要起草人:李智慧、王飞、闫冀焕、潘娟、柴宏森、祁军。1范围
国境口岸环介导恒温扩增
(LAMP)检测方法
第11部分:副溶血性弧菌
SN/T3306的本部分规定了在国境的检测对象、检测程序及检测结果的报告本部分适用于国境口岸副溶血性弧菌菌株的筛选检测2规范性引用文件
SN/T3306.11—2017
(LAMP)法检测副溶血性弧菌
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB4789.7
食品安全国家标准
食品微生物学检验副溶血性弧菌检验分析实验室用水规格和试验方法GB/T6682
实验室生物安全通用要求
GB19489
WS/T230
临床诊断中聚合酶链反应(PCR)技术的应用WS271
感染性腹泻诊断标准
人间传染的病原微生物名录(卫科教发【200615号3缩略语
下列缩略语适用于本文件。
Betaine:甜菜碱。
Bst酶:BstDNA聚合酶(大片段[BstDNApolymerase(largefragment)]DNA:脱氧核糖核酸(deoxyribonucleicacid)dNTP:脱氧核苷三磷酸(deoxyribonucleosidetriphosphate)EDTA:乙二胺四乙酸(ethylenediaminetetraaceticacid)LAMP:环介导恒温扩增(loop-mediatedisothermalamplification)TritonX-1o0:聚乙二醇辛基苯基醚4生物安全及防污染措施
实验生物安全要求、操作及处理按照GB19489和《人间传染的病原微生物名录》的规定执行,由通过生物安全培训并具备资质的工作人员进行。防止污染措施应符合WS/T230的规定。5技术概要
根据副溶血性弧菌的特异性毒力基因序列设计特异性内外引物及环状引物各一对,共三对引物,特1
SN/T3306.11—2017
异性识别靶序列上的M36437基因,利用Bst酶启动循环链置换反应,在特异性基因序列启动互补链合成,在同一链上互补序列周而复始形成有很多环的花椰菜结构的茎-环DNA混合物;从dNTP析出的焦磷酸根离子与反应溶液中的Mg2+结合,产生副产物(焦磷酸镁)形成乳白色沉淀,即可通过反应液中的浑浊程度判定结果。亦可加人显色液,通过观察颜色变化判定结果。6试剂和材料
除有特殊说明外,所有实验用试剂均为分析纯;实验用水符合GB/T6682中一级水的要求。6.1引物。
根据副溶血性弧菌特有的靶序列基因设计一套特异性引物,包括外引物1,外引物2,内引物1.内引物2和环状引物1,环状引物2。外引物1(F3.5-3):AGCTACTCGAAAGATGATCC外引物2(B3.5*-3):GGTTGTATGAGAAGCGATTG内引物1(FIP,5\-3):ATGTTTTTAAATGAAACGGAGCTCCGGCAAAAAACGAAGATGGT内引物2(BIP,5-3):ACGTCGCAAAACGTTATCCGGCGAAGAACGTAATGTCTG环状引物1(LF,5-3”):ACCAGTAGCCGTCAATG环状引I物2(LB.5-3):TTAGATTTGGCGAACGAGA6.2DNA提取液:含20mmol/LTris-HCl(pH8.0)、2mmol/LEDTA和1.2%TritonX-100。6.3dNTPs:每种核苷酸浓度10mmol/L6.4BstDNA聚合酶:8U/μL。
10XThermoPol缓冲液:含200mmol/LTris-HCl(pH8.8)、100mmol/L(NH)2SO、100mmol/LKCl.20mmol/LMgSO,.1%TritonX-100。6.6
MgSO,溶液:25mmol/L。
甜菜碱:5mol/L
显色液:浓度为1000XSYBRGreenI。阳性对照:可溯源的标准菌株,或含目的片段的DNA亦可。6.9
6.103%氯化钠碱性蛋白陈水。
0.2mL、1.5mL和10mL塑料离心管吸头,配套移液器使用。
无菌匀质袋(带滤网)。
仪器和设备
移液器:量程0.1μ~2μ,0.5μL~10μL,量程10μ~100μL,量程100μL~1000μ。7.1
高速台式离心机:≥7000g。
7.3水浴锅或加热模块:65℃土1℃和100℃士1℃。恒温培养箱:36℃土1℃和42℃士1℃。7.4
7.5拍打式匀质器。
6计时器。
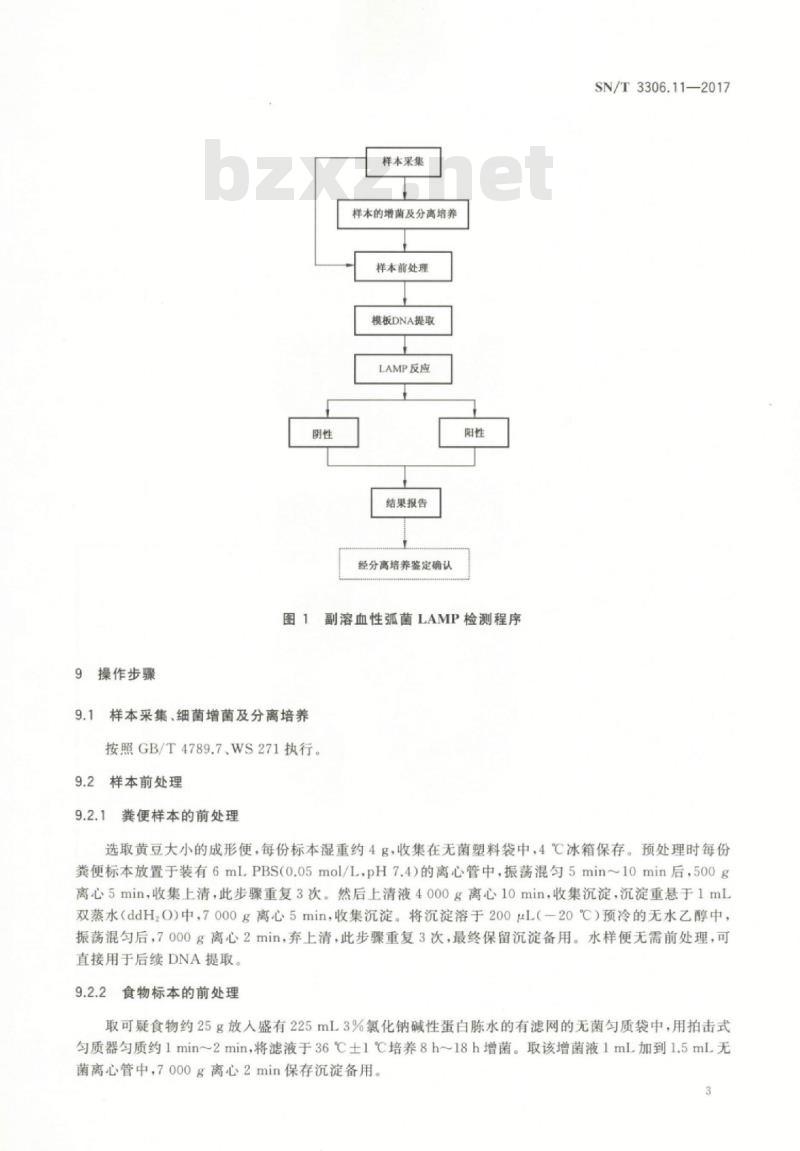
8检测程序
副溶血性弧菌LAMP检测程序见图1。2
9操作步骤
样本采集
样本的增菌及分离培养
样本前处理
模板DNA提取
LAMP反应
结果报告
经分离培养鉴定确认
副溶血性弧菌LAMP检测程序
样本采集、细菌增菌及分离培养9.1
按照GB/T4789.7、WS271执行。
9.2样本前处理
9.2.1粪便样本的前处理
SN/T3306.11—2017
选取黄豆大小的成形便,每份标本湿重约4g,收集在无菌塑料袋中,4℃冰箱保存。预处理时每份粪便标本放置于装有6mLPBS(0.05mol/L,pH7.4)的离心管中,振荡混勾5min~10min后,500g离心5min,收集上清,此步骤重复3次。然后上清液4000g离心10min,收集沉淀,沉淀重悬于1mL双蒸水(ddHzO)中,7000g离心5min,收集沉淀。将沉淀溶于200μL(一20℃)预冷的无水乙醇中,振荡混匀后,7000g离心2min,弃上清,此步骤重复3次,最终保留沉淀备用。水样便无需前处理,可直接用于后续DNA提取。
9.2.2食物标本的前处理
取可疑食物约25g放人盛有225mL3%氯化钠碱性蛋白陈水的有滤网的无菌匀质袋中,用拍击式匀质器匀质约1min~2min,将滤液于36℃土1℃培养8h~18h增菌。取该增菌液1mL加到1.5mL无菌离心管中,7000g离心2min保存沉淀备用。3
SN/T3306.11—2017
可疑菌落的前处理
分离培养后得到的可疑菌落直接用于提取DNA模板,无需前处理。9.3
模板DNA的提取
9.3.1加热煮沸法
向前处理后得到的沉淀中加人100μLDNA提取液;水样便直接取100μL加人100μLDNA提取液;可疑菌落直接挑取1个~2个可疑菌落加人80μLDNA提取液。之后将上述提取混合液其置于沸水浴10min,7000g离心2min,收集上清作为扩增模板,于一20℃保存备用9.3.2试剂盒提取
按适用于细菌基因组提取的试剂盒说明书操作9.4环介导恒温核酸扩增
反应体系
副溶血性弧菌的环介导引物恒温扩增反应体系见表1。表1
副溶血性弧菌的环介导引物恒温扩增反应体系试剂名称
10xThermoPol缓冲液
F3引物
B3引物
FIP引物此内容来自标准下载网
BIP引物
LF引物
LB引物
甜菜碱
硫酸镁溶液
BstDNA聚合酶
9.4.2反应过程
储备液浓度
1oμmol/L
40mmal/L
100mol/L
μmol/L
10mmol/L
5mol/L
150mmol/L
8U/μL
体系加样量
按照表1所述配制反应体系,上述组分加人后,轻柔混勾并短暂离心后加人10L的凡士林(密封液),最后将1μL的显色液加入反应管顶端。盖上管盖后,置于65℃恒温扩增60min,观察结果。4
9.4.3空白对照、阴性对照、阳性对照设置每次反应应设置空白对照、阴性对照和阳性对照。空白对照采用无菌水作为扩增模板。阴性对照以DNA提取液代替DNA模板。阳性对照以含检测序列的质粒DNA作为扩增模板,9.5结果观察
SN/T3306.11-2017
取出反应管,短暂离心使反应管盖中显色液进人反应体系,3min后根据管内反应液颜色变化,判断结果。
9.6结果判定
在空白对照和阴性对照反应管液体为橙色,阳任对照反应管液体呈绿色的条件下:阳性结果:待检样品反应管液体呈绿色,则报告为LAMP检测阳性。如需通过分离培养鉴定a
WS271执行。
对上述检测结果进行确认,可按GB/T4789.7b)
阴性结果:待检样品反应管液体呈橙色,则报告LAMP检测阴性。S
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
国境口岸环介导恒温扩增
(LAMP)检测方法
第11部分:副溶血性弧菌
Loop-mediated isothermal amplification detection methodat frontier portPart 11:Vibrio parahaemolyticus2017-05-12发布
中华人民共和国
国家质量监督检验检疫总局
2017-12-01实施
SN/T3306《国境口岸环介导恒温扩增(LAMP)检测方法》分为14个部分:第1部分:鼠疫杆菌;
第2部分:产毒素霍乱弧菌;
第3部分:志贺氏菌;
第4部分:嗜肺军团菌;
第5部分:布鲁氏菌;
第6部分:黄热病毒:
第7部分:猴痘病毒;
第8部分:基孔肯雅病毒;
第9部分:结核分枝杆菌;
第10部分:炭疽芽孢杆菌;
第11部分:副溶血性弧菌;
第12部分:空肠弯曲菌:
第13部分:疟原虫;
第14部分:大肠杆菌0157:H7。本部分为SN/T3306的第11部分。本部分按照GB/T1.1-2009给出的规则起草SN/T3306.11—2017
请注意本文件的某些内容可能涉及专利。本文件的发布机构不承担识别这些专利的责任。本部分由国家认证认可监督管理委员会提出并归口。本部分起草单位:中华人民共和国天津出入境检验检疫局、中华人民共和国北京出入境检验检疫局、中华人民共和国河北出人境检验检疫局。本部分主要起草人:李智慧、王飞、闫冀焕、潘娟、柴宏森、祁军。1范围
国境口岸环介导恒温扩增
(LAMP)检测方法
第11部分:副溶血性弧菌
SN/T3306的本部分规定了在国境的检测对象、检测程序及检测结果的报告本部分适用于国境口岸副溶血性弧菌菌株的筛选检测2规范性引用文件
SN/T3306.11—2017
(LAMP)法检测副溶血性弧菌
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB4789.7
食品安全国家标准
食品微生物学检验副溶血性弧菌检验分析实验室用水规格和试验方法GB/T6682
实验室生物安全通用要求
GB19489
WS/T230
临床诊断中聚合酶链反应(PCR)技术的应用WS271
感染性腹泻诊断标准
人间传染的病原微生物名录(卫科教发【200615号3缩略语
下列缩略语适用于本文件。
Betaine:甜菜碱。
Bst酶:BstDNA聚合酶(大片段[BstDNApolymerase(largefragment)]DNA:脱氧核糖核酸(deoxyribonucleicacid)dNTP:脱氧核苷三磷酸(deoxyribonucleosidetriphosphate)EDTA:乙二胺四乙酸(ethylenediaminetetraaceticacid)LAMP:环介导恒温扩增(loop-mediatedisothermalamplification)TritonX-1o0:聚乙二醇辛基苯基醚4生物安全及防污染措施
实验生物安全要求、操作及处理按照GB19489和《人间传染的病原微生物名录》的规定执行,由通过生物安全培训并具备资质的工作人员进行。防止污染措施应符合WS/T230的规定。5技术概要
根据副溶血性弧菌的特异性毒力基因序列设计特异性内外引物及环状引物各一对,共三对引物,特1
SN/T3306.11—2017
异性识别靶序列上的M36437基因,利用Bst酶启动循环链置换反应,在特异性基因序列启动互补链合成,在同一链上互补序列周而复始形成有很多环的花椰菜结构的茎-环DNA混合物;从dNTP析出的焦磷酸根离子与反应溶液中的Mg2+结合,产生副产物(焦磷酸镁)形成乳白色沉淀,即可通过反应液中的浑浊程度判定结果。亦可加人显色液,通过观察颜色变化判定结果。6试剂和材料
除有特殊说明外,所有实验用试剂均为分析纯;实验用水符合GB/T6682中一级水的要求。6.1引物。
根据副溶血性弧菌特有的靶序列基因设计一套特异性引物,包括外引物1,外引物2,内引物1.内引物2和环状引物1,环状引物2。外引物1(F3.5-3):AGCTACTCGAAAGATGATCC外引物2(B3.5*-3):GGTTGTATGAGAAGCGATTG内引物1(FIP,5\-3):ATGTTTTTAAATGAAACGGAGCTCCGGCAAAAAACGAAGATGGT内引物2(BIP,5-3):ACGTCGCAAAACGTTATCCGGCGAAGAACGTAATGTCTG环状引物1(LF,5-3”):ACCAGTAGCCGTCAATG环状引I物2(LB.5-3):TTAGATTTGGCGAACGAGA6.2DNA提取液:含20mmol/LTris-HCl(pH8.0)、2mmol/LEDTA和1.2%TritonX-100。6.3dNTPs:每种核苷酸浓度10mmol/L6.4BstDNA聚合酶:8U/μL。
10XThermoPol缓冲液:含200mmol/LTris-HCl(pH8.8)、100mmol/L(NH)2SO、100mmol/LKCl.20mmol/LMgSO,.1%TritonX-100。6.6
MgSO,溶液:25mmol/L。
甜菜碱:5mol/L
显色液:浓度为1000XSYBRGreenI。阳性对照:可溯源的标准菌株,或含目的片段的DNA亦可。6.9
6.103%氯化钠碱性蛋白陈水。
0.2mL、1.5mL和10mL塑料离心管吸头,配套移液器使用。
无菌匀质袋(带滤网)。
仪器和设备
移液器:量程0.1μ~2μ,0.5μL~10μL,量程10μ~100μL,量程100μL~1000μ。7.1
高速台式离心机:≥7000g。
7.3水浴锅或加热模块:65℃土1℃和100℃士1℃。恒温培养箱:36℃土1℃和42℃士1℃。7.4
7.5拍打式匀质器。
6计时器。
8检测程序
副溶血性弧菌LAMP检测程序见图1。2
9操作步骤
样本采集
样本的增菌及分离培养
样本前处理
模板DNA提取
LAMP反应
结果报告
经分离培养鉴定确认
副溶血性弧菌LAMP检测程序
样本采集、细菌增菌及分离培养9.1
按照GB/T4789.7、WS271执行。
9.2样本前处理
9.2.1粪便样本的前处理
SN/T3306.11—2017
选取黄豆大小的成形便,每份标本湿重约4g,收集在无菌塑料袋中,4℃冰箱保存。预处理时每份粪便标本放置于装有6mLPBS(0.05mol/L,pH7.4)的离心管中,振荡混勾5min~10min后,500g离心5min,收集上清,此步骤重复3次。然后上清液4000g离心10min,收集沉淀,沉淀重悬于1mL双蒸水(ddHzO)中,7000g离心5min,收集沉淀。将沉淀溶于200μL(一20℃)预冷的无水乙醇中,振荡混匀后,7000g离心2min,弃上清,此步骤重复3次,最终保留沉淀备用。水样便无需前处理,可直接用于后续DNA提取。
9.2.2食物标本的前处理
取可疑食物约25g放人盛有225mL3%氯化钠碱性蛋白陈水的有滤网的无菌匀质袋中,用拍击式匀质器匀质约1min~2min,将滤液于36℃土1℃培养8h~18h增菌。取该增菌液1mL加到1.5mL无菌离心管中,7000g离心2min保存沉淀备用。3
SN/T3306.11—2017
可疑菌落的前处理
分离培养后得到的可疑菌落直接用于提取DNA模板,无需前处理。9.3
模板DNA的提取
9.3.1加热煮沸法
向前处理后得到的沉淀中加人100μLDNA提取液;水样便直接取100μL加人100μLDNA提取液;可疑菌落直接挑取1个~2个可疑菌落加人80μLDNA提取液。之后将上述提取混合液其置于沸水浴10min,7000g离心2min,收集上清作为扩增模板,于一20℃保存备用9.3.2试剂盒提取
按适用于细菌基因组提取的试剂盒说明书操作9.4环介导恒温核酸扩增
反应体系
副溶血性弧菌的环介导引物恒温扩增反应体系见表1。表1
副溶血性弧菌的环介导引物恒温扩增反应体系试剂名称
10xThermoPol缓冲液
F3引物
B3引物
FIP引物此内容来自标准下载网
BIP引物
LF引物
LB引物
甜菜碱
硫酸镁溶液
BstDNA聚合酶
9.4.2反应过程
储备液浓度
1oμmol/L
40mmal/L
100mol/L
μmol/L
10mmol/L
5mol/L
150mmol/L
8U/μL
体系加样量
按照表1所述配制反应体系,上述组分加人后,轻柔混勾并短暂离心后加人10L的凡士林(密封液),最后将1μL的显色液加入反应管顶端。盖上管盖后,置于65℃恒温扩增60min,观察结果。4
9.4.3空白对照、阴性对照、阳性对照设置每次反应应设置空白对照、阴性对照和阳性对照。空白对照采用无菌水作为扩增模板。阴性对照以DNA提取液代替DNA模板。阳性对照以含检测序列的质粒DNA作为扩增模板,9.5结果观察
SN/T3306.11-2017
取出反应管,短暂离心使反应管盖中显色液进人反应体系,3min后根据管内反应液颜色变化,判断结果。
9.6结果判定
在空白对照和阴性对照反应管液体为橙色,阳任对照反应管液体呈绿色的条件下:阳性结果:待检样品反应管液体呈绿色,则报告为LAMP检测阳性。如需通过分离培养鉴定a
WS271执行。
对上述检测结果进行确认,可按GB/T4789.7b)
阴性结果:待检样品反应管液体呈橙色,则报告LAMP检测阴性。S
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。