SN/T 4857-2017
基本信息
标准号: SN/T 4857-2017
中文名称:国境口岸肠出血性大肠埃希菌0104:H4检验方法
标准类别:商检行业标准(SN)
标准状态:现行
出版语种:简体中文
下载格式:.zip .pdf
下载大小:10397178

标准分类号
关联标准
出版信息
相关单位信息
标准简介
SN/T 4857-2017.Method for detection of EHEC O104:H4 at frontier port.
1范围
SN/T 4857规定了国境口岸检验的检测流程、样品采集与运输、样品处理、检验和报告。
SN/T 4857适用于对国境口岸粪便及呕吐物、可疑食品和水样中志贺样毒素的筛查、EHEC O104:H4筛查和分离培养。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB 4789.1食品安全国家标准 食品微生物学检验 总 则
GB/T 4789.6食品卫生 微生物学检验致泻大肠埃 希氏菌检验
GB/T 5750.2生 活饮用水标准检验方法水样的采集和保存
3术语和定义
下列术语和定义适用于本文件。
3.1肠出血性大肠埃希菌Enterohemorrhagic escherichia coli;EHEC
一种能产生志贺样毒素(Shiga toxin,又称维罗毒素.Veto毒素,Verotoxin)的致泻性大肠埃希菌,可引起出血性肠炎( hemorrhagic colitis, HC)和溶血性尿毒症综合征( hemolytic uremic syndrome,HUS)。根据其菌体抗原(O)血清型和鞭毛抗原(H)血清型,可分为O157:H7 .O104:H4等一百余种,详参见附录A。
4对象
4.1EHECO104:H4感染或疑似感染病例的排泄物、呕吐物。
4.2被EHEC O104:H4污染或有EHEC O104:H4污染嫌疑的食品和水样。
1范围
SN/T 4857规定了国境口岸检验的检测流程、样品采集与运输、样品处理、检验和报告。
SN/T 4857适用于对国境口岸粪便及呕吐物、可疑食品和水样中志贺样毒素的筛查、EHEC O104:H4筛查和分离培养。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB 4789.1食品安全国家标准 食品微生物学检验 总 则
GB/T 4789.6食品卫生 微生物学检验致泻大肠埃 希氏菌检验
GB/T 5750.2生 活饮用水标准检验方法水样的采集和保存
3术语和定义
下列术语和定义适用于本文件。
3.1肠出血性大肠埃希菌Enterohemorrhagic escherichia coli;EHEC
一种能产生志贺样毒素(Shiga toxin,又称维罗毒素.Veto毒素,Verotoxin)的致泻性大肠埃希菌,可引起出血性肠炎( hemorrhagic colitis, HC)和溶血性尿毒症综合征( hemolytic uremic syndrome,HUS)。根据其菌体抗原(O)血清型和鞭毛抗原(H)血清型,可分为O157:H7 .O104:H4等一百余种,详参见附录A。
4对象
4.1EHECO104:H4感染或疑似感染病例的排泄物、呕吐物。
4.2被EHEC O104:H4污染或有EHEC O104:H4污染嫌疑的食品和水样。
标准图片预览




标准内容
中华人民共和国出入境检验检疫行业标准SN/T4857—2017
国境口岸肠出血性大肠埃
希菌0104:H4检验方法
Method for detection of EHEC O104:H4 at frontierport2017-07-21发布
中华人民共和国
国家质量监督检验检疫总局
2018-03-01实施
本标准按照GB/T1.1一2009给出的规则起草。本标准由国家认证认可监督管理委员会提出并归口。SN/T4857—2017
本标准起草单位:中华人民共和国珠海出入境检验检疫局、中国疾病预防控制中心传染病控制所。本标准主要起草人:涂承宁、赵俊华、冯子力、熊衍文、闫文莲、莫秋华、谭华、叶立青1范围
国境口岸肠出血性大肠埃
希菌0104:H4检验方法
SN/T4857—2017
本标准规定了国境口岸检验的检测流程、样品采集与运输、样品处理、检验和报告。本标准适用于对国境口岸粪便及呕吐物、可疑食品和水样中志贺样毒素的筛查、EHECO104:H4筛查和分离培养。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB4789.1食品安全国家标准
食品微生物学检验
GB/T4789.6食品卫生微生物学检验致泻大肠埃希氏菌检验生活饮用水标准检验方法水样的采集和保存GB/T5750.2
3术语和定义
下列术语和定义适用于本文件。3.1
肠出血性大肠埃希菌Enterohemorrhagic escherichia coli,EHE称维罗
毒素,Ve
种能产生志贺样毒素(Shigatoxin,又利to毒素
Verotoxin)的致泻性大肠埃希菌,可引起出血性肠炎(hemorrhagiccolitis,HC)和溶血性尿毒症综
征(hemolytic uremic syndrome,O157:H7、O104:H4等一百余种,HUS)。根据其菌体抗原(O)血清型和鞭毛抗原(H)血清型,可分为详参见附录A。
4对象
EHECO104:H4感染或疑似感染病例的排泄物、呕吐物。4.1
被EHECO104:H4污染或有EHECO104:H4污染嫌疑的食品和水样。5检测流程图
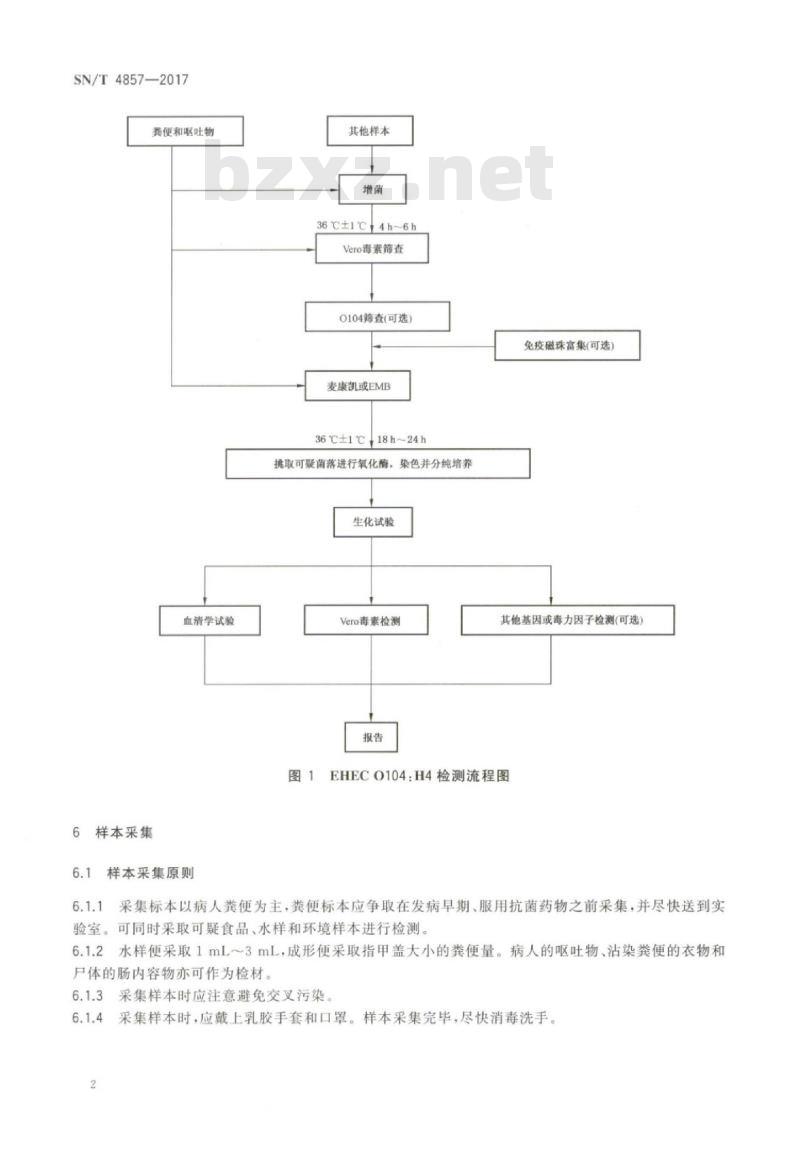
EHECO104:H4检测流程图见图1。SN/T4857—2017
粪便和呕吐物
血清学试验
6样本采集
6.1样本采集原则
其他样本
36℃±1℃
Vero毒素筛查
0104筛查(可选)
麦康凯或EMB
36℃±1℃,18h~24h
挑取可疑菌落进行氧化酶,染色并分纯培养生化试验
Vero毒素检测
免疫磁珠富集(可选)
其他基因或毒力因子检测(可选)图1EHECO104:H4检测流程图
6.1.1采集标本以病人粪便为主,粪便标本应争取在发病早期、服用抗菌药物之前采集,并尽快送到实验室。可同时采取可疑食品、水样和环境样本进行检测。6.1.2水样便采取1mL~3mL,成形便采取指甲盖大小的粪便量。病人的呕吐物、沾染粪便的衣物和户体的肠内容物亦可作为检材。6.1.3采集样本时应注意避免交叉污染采集样本时,应戴上乳胶手套和口罩。样本采集完毕,尽快消毒洗手。6.1.4
6.2粪便的采集
6.2.1拭子采样法
SN/T4857—2017
用直肠棉拭或采便管由肛门插人直肠内3cm~5cm处采取。应注意棉拭大小适宜,避免采便量过少。
座厕采样法
6.2.2.1戴上乳胶手套,取一螺旋式密封、已消毒、干燥的容器并做好唯一性标识;6.2.2.2使用座厕时,指导病人将经消毒的厨用塑料围裙挂在座厕后背上,将围裙体部置于座厕坐板上,使能更方便地获得粪便样本,但应避免尿液混和。尽可能多地将粪便样本采集到上述容器中(推荐采集到10mL以上),置2℃~8℃保存并于2h内送检6.2.2.3如果没有座厕,可使用糖瓷便盆。指导病人将围裙体部置于便盆上(如果便盆经过高压消毒也可不用围裙),使能更方便地获得便样本,但应避免尿液混和。6.2.2.4如果是使用了纸尿布且不会使用座厕的婴幼儿,可将塑料围裙沿着纸尿布边缘放人纸尿布中,如果放置得当,可使粪便和尿液的混合减到最少,从而获得一个较好的样本。6.3呕吐物样本采集
采集自然呕吐的呕吐物于灭菌容器中,水样呕吐物采集1mL3mL,非水样呕吐物采集1g~3g6.4水样采集
按GB/T5750.2要求进行。
可疑食品采集
按GB4789.1要求进行。
7运输与保存
采集的样本应按规定作好标识放专用送样箱中,2℃~8℃保存并于2h内送检。采得的标本不能立即检查的,应接种于保存培养基内(如文腊氏保存液或Cary-Blair二氏半固体保存培养基)尽快送往实验室。送检标本时应填写送检单。8检验程序
8.1准备
8.1.1对检疫查验、卫生监督或疫情监测的记录进行整理8.1.2对所采集的样本应进行唯一性标识。8.1.3
将所采集的样本连同整理的记录一并送实验室检验设备和材料的准备按附录B的规定。8.1.4
样品处理
粪便和呕吐物的处理
粪便和呕吐物应选择其中脓血粘液等病理成分进行检验,如无病理成分,可多部位取材。粪便和呕3
SN/T4857—2017
吐物应直接取样划线接种MAC或EMB琼脂平板。同时进行增菌时,取检样1g/mL,加在9mLEC肉汤中同时进行增菌培养。志贺样毒素筛查按附录C的C.1和附录D的D.1的要求进行8.2.2可疑食品样本的处理
除了易腐食品在检验之前置2℃~8℃预冷藏外,其余食品一般不冷藏。固体样品以乳钵加灭菌砂磨碎,或无菌操作取检样25g,加在225mL营养肉汤中,以均质器打碎1min。液体样品取25mL,加在225mLEC肉汤中直接进行检验。8.2.3水样的处理
污染严重的水样可取25mL,加在225mLEC肉汤中直接进行检验。可取300mL水样用过滤器和0.22μm滤膜过滤,将滤膜剪碎与50mL离心管中用25mL纯净水反复震荡2min洗脱,加入225mLEC肉汤中进行检验。
8.3增菌
粪便样本取1g/mL加人9mLEC肉汤中,其他样本无菌操作取25g/mL加人225mLEC肉汤中,置36℃土1℃温箱内培养4h~6h。如采用ELISA进行Vero毒素筛查,加人丝裂霉素C,使其浓度达到0.5μg/mL,并于36℃±1℃温箱内继续培养16h~20h。8.4Vero毒素筛查
8.4.1聚合酶链反应(PCR)法
按附录C进行。
8.4.2酶联免疫吸附法(ELISA法)检测无条件按附录C进行检测的实验室,可按附录D进行5EHECO104:H4筛查
按附录E进行。
8.6分离培养鉴定
8.6.1分离培养
用增菌液接种MAC或EMB琼脂干板,腹泻便和呕吐物还应直接划线接种MAC或EMB琼脂平板,采用磁珠涂布划线接种时,将磁珠涂布在培养基一半区域,再用接种环划线其余区域。于36℃土1℃温箱内培养18h~24h,观察菌落。采用MAC分离时不但要注意乳糖发酵的菌落,同时也要注意乳糖不发酵和迟缓发酵的菌落。采用EMB分离时,大肠埃希菌表现为黑色菌落,带或不带金属光泽。8.6.2生化试验
于鉴别平板上挑取5个可疑菌落,接种三糖铁琼脂(TSI)。同时将这些培养物分别接种蛋白陈水、半固体、pH7.2尿素琼脂、KCN肉汤和赖氨酸脱羧酶试验培养基,于36℃土1℃温箱内培养18h~24h。TSI斜面产酸或不产酸,底层产酸,H,S阴性,KCN阴性和尿素阴性的培养物为大肠埃希氏菌。TSI底层不产酸,或HS,KCN、尿素有任一项为阳性的培养物,均非大肠埃希氏菌。必要时做氧化酶试验和革兰氏染色
8.6.3血清学试验
SN/T4857—2017
挑取经生化试验符合大肠埃希氏菌的琼脂培养物,用出血性大肠埃希氏菌O104血清和H4血清进行玻片凝集试验。如均出现凝集,可证实为肠出血性大肠埃希菌O0104:H4。如果凝集效果不好,可进行液体培养后再进行血清学试验:用移液器取20μL菌液,接人5mL增菌液中于36℃土1℃、180r/min培养16h,取1mL培养后的菌液,9200g离心,弃上清。取20μLO104血清滴加到洁净的玻片上,取上述菌体与血清进行凝集反应。8.6.4Vero毒素检测
按附录C或附录D进行。
其他基因和毒力因子检测
参照附录F进行。
9报告
9.1Vero毒素筛查、O104筛查结果为阴性,均可报告为未检出肠出血性大肠埃希菌O104:H4”;9.2如果未进行Vero毒素筛查或O104筛查,直接进行分离培养鉴定,生化试验或血清学试验结果不符,报告为“未检出肠出血性大肠埃希菌O104:H4”9.3Vero毒素筛查、O104筛查结果为阳性,分离培养鉴定未检出肠出血性大肠埃希菌O104:H4,需重复检测。如仍未检出,报告为“未检出肠出血性大肠埃希菌O104:H4”。9.4生化试验、血清学试验、Ver毒素检测均符合肠出血性大肠埃希菌O104:H4特征,食品样品报告为“25g/mL样品中检出肠出血性大肠埃希菌O104:H4”.检样不足225g/mL,按实际样本量报告,其余样品报告为“检出肠出血性大肠埃希菌104H4”。5
SN/T4857—2017
(资料性附录)
引起腹泻及肠道感梁的肠出血性大肠埃希氏菌血清型引起腹泻及肠道感梁的肠出血性大肠埃希菌血清型见表A.1。表A1
06:H28
O18:H7
023:H7
023:H16
025:NM
026:NM
026:H2
026:H8
O26:H32
O38:H21
045:NM
045:H2
048:H21
O113H7
引起腹泻及肠道感梁的肠出血性大肠埃希氏菌血清型O50:H7
052:H25
055:NM
055:H7
055:H10
073:H34
075:H5
082:H8
084:H2M
O85:NM
086:H10
O91:NM
O91:H14
O91:H21
O101:H19
O103:H2
0103:H16
O104:NM
O104:H4
O104:H21
O111:H2
O111:H7
O111:H8
O111:H30
O111:H34
O113:H2
O113:H21
O113:H53
O114:H4
O114:H48
O115:H18
O118:H30
O119H5
O119:H6
O120:H19
0121:H8
O121:H19
O125:H8
O126:H21
0126:H8
O126:NM
O128:NM
0128:H2
O133:H53
O145:H25
O146:NM
O146:H21
O153:H25
O157:NM
0157:H7
O163:H19
O165:NM
0165:H19
O165:H25
O166:H15
OroughH20
仪器设备
均质器或乳钵、灭菌砂
温箱:36℃±1℃,41℃±1℃。500mL灭菌广口瓶
显微镜
载玻片
酒精灯
接种环和棒
灭菌的剪刀、镊子、勺子。
菌浓度比浊管:MacFarland3号。各种量程移液器一套
生物安全柜
扩增仪
电泳仪
凝胶成像分析系统
酶标仪
洗板机
过滤器及0.22μm滤膜
普通冰箱
200μL、2mL离心管
25mL试管
1mL、10mL吸管
高速离心机
磁力架
恒温震荡器
EC肉汤
B.2.1.1成分
附录B
(规范性附录)
仪器设备和试剂
SN/T4857—2017
蛋白陈10g、3号胆盐(或混合胆盐)1.5g、乳糖5g、磷酸氢二钾9g、磷酸二氢钾1.5g、氯化钠5g、蒸馏水1000mL。
2制法
将上述成分混合,溶解后,分装有发酵倒管的试管中,121℃灭菌15min,使最终pH6.9士0.2。SN/T4857—2017
B.2.2麦康凯琼脂(Mac)免费标准下载网bzxz
B.2.2.1成分
蛋白陈17g、陈3g、猪胆盐(或牛、羊胆盐)5g、氯化钠5g、琼脂17g、蒸馏水1000mL、乳糖10g、0.01%结晶紫水溶液10mL、0.5%中性红水溶液5mL。B.2.2.2制法
将蛋白陈、陈、胆盐和氯化钠溶解于400mL蒸馏水中,校正pH7.2,将琼脂加人600mL蒸馏水中,加热溶解。将两液合并,121℃灭菌15min备用。临用时加热溶化琼脂,热加人乳糖,冷至50℃~55℃时.加人结晶紫和中性红水溶液,摇匀后倾注平板。
B.2.3伊红美蓝琼脂(EMB)
B.2.3.1成分
蛋白陈10g、乳糖10g、磷酸氢二钾2g.琼脂17g2%伊红Y溶液20mL0.65%美兰溶液10mL蒸馏水1000mL。
B.2.3.2制法
将蛋白、磷酸盐和琼脂容解于蒸馏水中,校正pH7.1.121C灭菌15min备用。
临用时加人乳糖并加热溶化琼脂,冷至50℃~55℃时,加入伊红和美兰溶液,摇匀后倾注平板。B.2.4三糖铁琼脂(TSI)
B.2.4.1成分
蛋白陈20g、牛肉膏5g、乳糖10
g、蔗糖10g、葡萄糖1g、氯化钠5g、硫酸亚铁铵0.2g、硫代硫酸水1000mL
钠0.2g、琼脂12g、酚红0.025g、蒸馅B.2.4.2制法
将除琼脂和酚红以外的各成分法溶解于蒸馏水中,校正pH7.4,加人琼脂,加热煮沸,以溶化琼脂,加人0.2%酚红水溶液12.5mL.摇匀
氧化酶试剂
革兰氏染色液
分装试管。121℃灭菌15min,放置高层斜面备用。肠出血性大肠埃希氏菌O104和H4诊断血清赖氨酸脱羧酶试验培养基
尿素琼脂(pH7.2)
氰化钾(KCN)培养基
蛋白陈水、靛基质试剂
半固体琼脂
B.2.12.1成分
蛋白陈1g、牛肉膏0.3g、氯化钠0.5g、琼脂0.35g、蒸馏水100mL。B.2.12.2制法
按以上成分配好,煮沸使溶解,校正pH7.4,分装小试管,121℃灭菌15min,直立凝固备用。8
DNA提取试剂盒
人大肠杆菌vero毒素PCR检测试剂盒人大肠杆菌vero毒素ELISA检测试剂盒大肠杆菌0104免疫磁珠分离检测试剂盒丝裂霉素C
琼脂糖
TE(pH8.0)
酚/氯仿(1:1)
70%乙醇
冰无水乙醇
SN/T4857-2017
SN/T4857—2017
C.1样本处理
附录C
(规范性附录)
PCR法筛查vero毒素
C.1.1取粪便样本或培养后EC肉汤适量使用专用DNA提取试剂盒提取核酸。如未配备专用DNA提取试剂盒,可按C.1.2~C.1.12进行DNA提取。取1.5mL菌液于1.5mL离心管,6000g离心3min,弃上清。C.1.2
用0.6mLTE悬菌,振荡打开沉淀。加入80μL10%SDS,颠倒数次混匀后,68℃水浴5min8min,至清亮。加人RNase使终浓度为50μg/mL~100μg/mL,混勾后37℃水浴作用0.5h~1h。加人等体积饱和酚,上下颠倒混匀,使其完全乳化,9200g离心10min。将上层液体移入另一离心管,然后加人等体积酚/氯仿(1:1),上下颠倒混勾,至完全乳化后,9200g离心10min。
重复步骤C.1.6,直到不见蛋白层为止。C.1.8
加人等体积氯仿,轻轻混勾后,9200g离心5min。C.1.9
C.1.10将上清液移人另一离心管,加1/10体积NaAc和2倍体积冰无水乙醇,混匀后,一20℃沉淀30min。
C.1.119200g离心10min,弃去管中液体,用1mL70%乙醇洗DNA沉淀,9200g离心10min,再重复一次,尽量弃去管中液体,于室温或37℃烤箱干燥2溶于适量TE(pH8.0),可室温或37℃溶解,一20℃保存备用。C.1.12
聚合酶链反应(PCR)法筛查vero毒素C.2.1
实验原理
在DNA聚合酶催化下,以母链DNA为模板,以特定引物为延伸起点,通过变性、退火、延伸等步骤,体外复制出与母链模板DNA互补的子链DNA的过程。是一项DNA体外合成放大技术,能快速特异地在体外扩增任何目的DNA。2PCR引物序列和产物
slt-l-a
slt-1-b
slt-2-a
slt-2-b
CAGTTAATGTGGTGGCGAAGG
CACCAGACAATGTAA CCG CTG
ATCCTATTCCCGGGAGTTTACG
GCGTCATCGTATACACAGGAGC
C.2.325μL反应体系
在反应管中依次加人模板2μL、引物(10μm)各1μL、dNTP(2.5μm)2μL、MgCl21μL、10×buffer2.5μL、Taq酶0.5μL、ddHzO补充至25μL。10
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
国境口岸肠出血性大肠埃
希菌0104:H4检验方法
Method for detection of EHEC O104:H4 at frontierport2017-07-21发布
中华人民共和国
国家质量监督检验检疫总局
2018-03-01实施
本标准按照GB/T1.1一2009给出的规则起草。本标准由国家认证认可监督管理委员会提出并归口。SN/T4857—2017
本标准起草单位:中华人民共和国珠海出入境检验检疫局、中国疾病预防控制中心传染病控制所。本标准主要起草人:涂承宁、赵俊华、冯子力、熊衍文、闫文莲、莫秋华、谭华、叶立青1范围
国境口岸肠出血性大肠埃
希菌0104:H4检验方法
SN/T4857—2017
本标准规定了国境口岸检验的检测流程、样品采集与运输、样品处理、检验和报告。本标准适用于对国境口岸粪便及呕吐物、可疑食品和水样中志贺样毒素的筛查、EHECO104:H4筛查和分离培养。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB4789.1食品安全国家标准
食品微生物学检验
GB/T4789.6食品卫生微生物学检验致泻大肠埃希氏菌检验生活饮用水标准检验方法水样的采集和保存GB/T5750.2
3术语和定义
下列术语和定义适用于本文件。3.1
肠出血性大肠埃希菌Enterohemorrhagic escherichia coli,EHE称维罗
毒素,Ve
种能产生志贺样毒素(Shigatoxin,又利to毒素
Verotoxin)的致泻性大肠埃希菌,可引起出血性肠炎(hemorrhagiccolitis,HC)和溶血性尿毒症综
征(hemolytic uremic syndrome,O157:H7、O104:H4等一百余种,HUS)。根据其菌体抗原(O)血清型和鞭毛抗原(H)血清型,可分为详参见附录A。
4对象
EHECO104:H4感染或疑似感染病例的排泄物、呕吐物。4.1
被EHECO104:H4污染或有EHECO104:H4污染嫌疑的食品和水样。5检测流程图
EHECO104:H4检测流程图见图1。SN/T4857—2017
粪便和呕吐物
血清学试验
6样本采集
6.1样本采集原则
其他样本
36℃±1℃
Vero毒素筛查
0104筛查(可选)
麦康凯或EMB
36℃±1℃,18h~24h
挑取可疑菌落进行氧化酶,染色并分纯培养生化试验
Vero毒素检测
免疫磁珠富集(可选)
其他基因或毒力因子检测(可选)图1EHECO104:H4检测流程图
6.1.1采集标本以病人粪便为主,粪便标本应争取在发病早期、服用抗菌药物之前采集,并尽快送到实验室。可同时采取可疑食品、水样和环境样本进行检测。6.1.2水样便采取1mL~3mL,成形便采取指甲盖大小的粪便量。病人的呕吐物、沾染粪便的衣物和户体的肠内容物亦可作为检材。6.1.3采集样本时应注意避免交叉污染采集样本时,应戴上乳胶手套和口罩。样本采集完毕,尽快消毒洗手。6.1.4
6.2粪便的采集
6.2.1拭子采样法
SN/T4857—2017
用直肠棉拭或采便管由肛门插人直肠内3cm~5cm处采取。应注意棉拭大小适宜,避免采便量过少。
座厕采样法
6.2.2.1戴上乳胶手套,取一螺旋式密封、已消毒、干燥的容器并做好唯一性标识;6.2.2.2使用座厕时,指导病人将经消毒的厨用塑料围裙挂在座厕后背上,将围裙体部置于座厕坐板上,使能更方便地获得粪便样本,但应避免尿液混和。尽可能多地将粪便样本采集到上述容器中(推荐采集到10mL以上),置2℃~8℃保存并于2h内送检6.2.2.3如果没有座厕,可使用糖瓷便盆。指导病人将围裙体部置于便盆上(如果便盆经过高压消毒也可不用围裙),使能更方便地获得便样本,但应避免尿液混和。6.2.2.4如果是使用了纸尿布且不会使用座厕的婴幼儿,可将塑料围裙沿着纸尿布边缘放人纸尿布中,如果放置得当,可使粪便和尿液的混合减到最少,从而获得一个较好的样本。6.3呕吐物样本采集
采集自然呕吐的呕吐物于灭菌容器中,水样呕吐物采集1mL3mL,非水样呕吐物采集1g~3g6.4水样采集
按GB/T5750.2要求进行。
可疑食品采集
按GB4789.1要求进行。
7运输与保存
采集的样本应按规定作好标识放专用送样箱中,2℃~8℃保存并于2h内送检。采得的标本不能立即检查的,应接种于保存培养基内(如文腊氏保存液或Cary-Blair二氏半固体保存培养基)尽快送往实验室。送检标本时应填写送检单。8检验程序
8.1准备
8.1.1对检疫查验、卫生监督或疫情监测的记录进行整理8.1.2对所采集的样本应进行唯一性标识。8.1.3
将所采集的样本连同整理的记录一并送实验室检验设备和材料的准备按附录B的规定。8.1.4
样品处理
粪便和呕吐物的处理
粪便和呕吐物应选择其中脓血粘液等病理成分进行检验,如无病理成分,可多部位取材。粪便和呕3
SN/T4857—2017
吐物应直接取样划线接种MAC或EMB琼脂平板。同时进行增菌时,取检样1g/mL,加在9mLEC肉汤中同时进行增菌培养。志贺样毒素筛查按附录C的C.1和附录D的D.1的要求进行8.2.2可疑食品样本的处理
除了易腐食品在检验之前置2℃~8℃预冷藏外,其余食品一般不冷藏。固体样品以乳钵加灭菌砂磨碎,或无菌操作取检样25g,加在225mL营养肉汤中,以均质器打碎1min。液体样品取25mL,加在225mLEC肉汤中直接进行检验。8.2.3水样的处理
污染严重的水样可取25mL,加在225mLEC肉汤中直接进行检验。可取300mL水样用过滤器和0.22μm滤膜过滤,将滤膜剪碎与50mL离心管中用25mL纯净水反复震荡2min洗脱,加入225mLEC肉汤中进行检验。
8.3增菌
粪便样本取1g/mL加人9mLEC肉汤中,其他样本无菌操作取25g/mL加人225mLEC肉汤中,置36℃土1℃温箱内培养4h~6h。如采用ELISA进行Vero毒素筛查,加人丝裂霉素C,使其浓度达到0.5μg/mL,并于36℃±1℃温箱内继续培养16h~20h。8.4Vero毒素筛查
8.4.1聚合酶链反应(PCR)法
按附录C进行。
8.4.2酶联免疫吸附法(ELISA法)检测无条件按附录C进行检测的实验室,可按附录D进行5EHECO104:H4筛查
按附录E进行。
8.6分离培养鉴定
8.6.1分离培养
用增菌液接种MAC或EMB琼脂干板,腹泻便和呕吐物还应直接划线接种MAC或EMB琼脂平板,采用磁珠涂布划线接种时,将磁珠涂布在培养基一半区域,再用接种环划线其余区域。于36℃土1℃温箱内培养18h~24h,观察菌落。采用MAC分离时不但要注意乳糖发酵的菌落,同时也要注意乳糖不发酵和迟缓发酵的菌落。采用EMB分离时,大肠埃希菌表现为黑色菌落,带或不带金属光泽。8.6.2生化试验
于鉴别平板上挑取5个可疑菌落,接种三糖铁琼脂(TSI)。同时将这些培养物分别接种蛋白陈水、半固体、pH7.2尿素琼脂、KCN肉汤和赖氨酸脱羧酶试验培养基,于36℃土1℃温箱内培养18h~24h。TSI斜面产酸或不产酸,底层产酸,H,S阴性,KCN阴性和尿素阴性的培养物为大肠埃希氏菌。TSI底层不产酸,或HS,KCN、尿素有任一项为阳性的培养物,均非大肠埃希氏菌。必要时做氧化酶试验和革兰氏染色
8.6.3血清学试验
SN/T4857—2017
挑取经生化试验符合大肠埃希氏菌的琼脂培养物,用出血性大肠埃希氏菌O104血清和H4血清进行玻片凝集试验。如均出现凝集,可证实为肠出血性大肠埃希菌O0104:H4。如果凝集效果不好,可进行液体培养后再进行血清学试验:用移液器取20μL菌液,接人5mL增菌液中于36℃土1℃、180r/min培养16h,取1mL培养后的菌液,9200g离心,弃上清。取20μLO104血清滴加到洁净的玻片上,取上述菌体与血清进行凝集反应。8.6.4Vero毒素检测
按附录C或附录D进行。
其他基因和毒力因子检测
参照附录F进行。
9报告
9.1Vero毒素筛查、O104筛查结果为阴性,均可报告为未检出肠出血性大肠埃希菌O104:H4”;9.2如果未进行Vero毒素筛查或O104筛查,直接进行分离培养鉴定,生化试验或血清学试验结果不符,报告为“未检出肠出血性大肠埃希菌O104:H4”9.3Vero毒素筛查、O104筛查结果为阳性,分离培养鉴定未检出肠出血性大肠埃希菌O104:H4,需重复检测。如仍未检出,报告为“未检出肠出血性大肠埃希菌O104:H4”。9.4生化试验、血清学试验、Ver毒素检测均符合肠出血性大肠埃希菌O104:H4特征,食品样品报告为“25g/mL样品中检出肠出血性大肠埃希菌O104:H4”.检样不足225g/mL,按实际样本量报告,其余样品报告为“检出肠出血性大肠埃希菌104H4”。5
SN/T4857—2017
(资料性附录)
引起腹泻及肠道感梁的肠出血性大肠埃希氏菌血清型引起腹泻及肠道感梁的肠出血性大肠埃希菌血清型见表A.1。表A1
06:H28
O18:H7
023:H7
023:H16
025:NM
026:NM
026:H2
026:H8
O26:H32
O38:H21
045:NM
045:H2
048:H21
O113H7
引起腹泻及肠道感梁的肠出血性大肠埃希氏菌血清型O50:H7
052:H25
055:NM
055:H7
055:H10
073:H34
075:H5
082:H8
084:H2M
O85:NM
086:H10
O91:NM
O91:H14
O91:H21
O101:H19
O103:H2
0103:H16
O104:NM
O104:H4
O104:H21
O111:H2
O111:H7
O111:H8
O111:H30
O111:H34
O113:H2
O113:H21
O113:H53
O114:H4
O114:H48
O115:H18
O118:H30
O119H5
O119:H6
O120:H19
0121:H8
O121:H19
O125:H8
O126:H21
0126:H8
O126:NM
O128:NM
0128:H2
O133:H53
O145:H25
O146:NM
O146:H21
O153:H25
O157:NM
0157:H7
O163:H19
O165:NM
0165:H19
O165:H25
O166:H15
OroughH20
仪器设备
均质器或乳钵、灭菌砂
温箱:36℃±1℃,41℃±1℃。500mL灭菌广口瓶
显微镜
载玻片
酒精灯
接种环和棒
灭菌的剪刀、镊子、勺子。
菌浓度比浊管:MacFarland3号。各种量程移液器一套
生物安全柜
扩增仪
电泳仪
凝胶成像分析系统
酶标仪
洗板机
过滤器及0.22μm滤膜
普通冰箱
200μL、2mL离心管
25mL试管
1mL、10mL吸管
高速离心机
磁力架
恒温震荡器
EC肉汤
B.2.1.1成分
附录B
(规范性附录)
仪器设备和试剂
SN/T4857—2017
蛋白陈10g、3号胆盐(或混合胆盐)1.5g、乳糖5g、磷酸氢二钾9g、磷酸二氢钾1.5g、氯化钠5g、蒸馏水1000mL。
2制法
将上述成分混合,溶解后,分装有发酵倒管的试管中,121℃灭菌15min,使最终pH6.9士0.2。SN/T4857—2017
B.2.2麦康凯琼脂(Mac)免费标准下载网bzxz
B.2.2.1成分
蛋白陈17g、陈3g、猪胆盐(或牛、羊胆盐)5g、氯化钠5g、琼脂17g、蒸馏水1000mL、乳糖10g、0.01%结晶紫水溶液10mL、0.5%中性红水溶液5mL。B.2.2.2制法
将蛋白陈、陈、胆盐和氯化钠溶解于400mL蒸馏水中,校正pH7.2,将琼脂加人600mL蒸馏水中,加热溶解。将两液合并,121℃灭菌15min备用。临用时加热溶化琼脂,热加人乳糖,冷至50℃~55℃时.加人结晶紫和中性红水溶液,摇匀后倾注平板。
B.2.3伊红美蓝琼脂(EMB)
B.2.3.1成分
蛋白陈10g、乳糖10g、磷酸氢二钾2g.琼脂17g2%伊红Y溶液20mL0.65%美兰溶液10mL蒸馏水1000mL。
B.2.3.2制法
将蛋白、磷酸盐和琼脂容解于蒸馏水中,校正pH7.1.121C灭菌15min备用。
临用时加人乳糖并加热溶化琼脂,冷至50℃~55℃时,加入伊红和美兰溶液,摇匀后倾注平板。B.2.4三糖铁琼脂(TSI)
B.2.4.1成分
蛋白陈20g、牛肉膏5g、乳糖10
g、蔗糖10g、葡萄糖1g、氯化钠5g、硫酸亚铁铵0.2g、硫代硫酸水1000mL
钠0.2g、琼脂12g、酚红0.025g、蒸馅B.2.4.2制法
将除琼脂和酚红以外的各成分法溶解于蒸馏水中,校正pH7.4,加人琼脂,加热煮沸,以溶化琼脂,加人0.2%酚红水溶液12.5mL.摇匀
氧化酶试剂
革兰氏染色液
分装试管。121℃灭菌15min,放置高层斜面备用。肠出血性大肠埃希氏菌O104和H4诊断血清赖氨酸脱羧酶试验培养基
尿素琼脂(pH7.2)
氰化钾(KCN)培养基
蛋白陈水、靛基质试剂
半固体琼脂
B.2.12.1成分
蛋白陈1g、牛肉膏0.3g、氯化钠0.5g、琼脂0.35g、蒸馏水100mL。B.2.12.2制法
按以上成分配好,煮沸使溶解,校正pH7.4,分装小试管,121℃灭菌15min,直立凝固备用。8
DNA提取试剂盒
人大肠杆菌vero毒素PCR检测试剂盒人大肠杆菌vero毒素ELISA检测试剂盒大肠杆菌0104免疫磁珠分离检测试剂盒丝裂霉素C
琼脂糖
TE(pH8.0)
酚/氯仿(1:1)
70%乙醇
冰无水乙醇
SN/T4857-2017
SN/T4857—2017
C.1样本处理
附录C
(规范性附录)
PCR法筛查vero毒素
C.1.1取粪便样本或培养后EC肉汤适量使用专用DNA提取试剂盒提取核酸。如未配备专用DNA提取试剂盒,可按C.1.2~C.1.12进行DNA提取。取1.5mL菌液于1.5mL离心管,6000g离心3min,弃上清。C.1.2
用0.6mLTE悬菌,振荡打开沉淀。加入80μL10%SDS,颠倒数次混匀后,68℃水浴5min8min,至清亮。加人RNase使终浓度为50μg/mL~100μg/mL,混勾后37℃水浴作用0.5h~1h。加人等体积饱和酚,上下颠倒混匀,使其完全乳化,9200g离心10min。将上层液体移入另一离心管,然后加人等体积酚/氯仿(1:1),上下颠倒混勾,至完全乳化后,9200g离心10min。
重复步骤C.1.6,直到不见蛋白层为止。C.1.8
加人等体积氯仿,轻轻混勾后,9200g离心5min。C.1.9
C.1.10将上清液移人另一离心管,加1/10体积NaAc和2倍体积冰无水乙醇,混匀后,一20℃沉淀30min。
C.1.119200g离心10min,弃去管中液体,用1mL70%乙醇洗DNA沉淀,9200g离心10min,再重复一次,尽量弃去管中液体,于室温或37℃烤箱干燥2溶于适量TE(pH8.0),可室温或37℃溶解,一20℃保存备用。C.1.12
聚合酶链反应(PCR)法筛查vero毒素C.2.1
实验原理
在DNA聚合酶催化下,以母链DNA为模板,以特定引物为延伸起点,通过变性、退火、延伸等步骤,体外复制出与母链模板DNA互补的子链DNA的过程。是一项DNA体外合成放大技术,能快速特异地在体外扩增任何目的DNA。2PCR引物序列和产物
slt-l-a
slt-1-b
slt-2-a
slt-2-b
CAGTTAATGTGGTGGCGAAGG
CACCAGACAATGTAA CCG CTG
ATCCTATTCCCGGGAGTTTACG
GCGTCATCGTATACACAGGAGC
C.2.325μL反应体系
在反应管中依次加人模板2μL、引物(10μm)各1μL、dNTP(2.5μm)2μL、MgCl21μL、10×buffer2.5μL、Taq酶0.5μL、ddHzO补充至25μL。10
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。