SN/T 4781-2017
基本信息
标准号: SN/T 4781-2017
中文名称:出口食品和饲料中产志贺毒素大肠埃希氏菌检测方法实时荧光PCR法
标准类别:商检行业标准(SN)
标准状态:现行
出版语种:简体中文
下载格式:.zip .pdf
下载大小:6958832
相关标签: 出口 食品 饲料 中产 毒素 大肠 埃希氏 检测 方法 实时 荧光 PCR

标准分类号
关联标准
出版信息
相关单位信息
标准简介
SN/T 4781-2017.Detection of Shiga toxin-producing Escherichia coli in food and animal feed for exports-Real-time PCR method.
1范围
SN/T 4781规定了出口食品和饲料中产志贺毒素大肠埃希氏菌的实时荧光PCR快速检测方法。
SN/T 4781适用于出口食品和饲料中产志贺毒素大肠埃希氏菌(O157、0104、0111、O26、O145和0103)的检测。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 6682分 析实验室用水规格和实验方法
GB 19489实验室生物安 全通用要求
GB/T 27403实验室质量控制规范 食 品分子生物学检测
3术语和定义
下列术语和定义适用于本文件。
3.1产志贺毒素大肠埃希氏菌Shiga toxin-producing Escherichia coli ;STEC
含有志贺毒素编码基因stx的大肠埃希氏菌。
3.2肠出血性大肠埃希氏菌Shiga toxin-producing Escherichia coli causing the attaching and effacing lesion
同时含有志贺毒素编码基因stx和紧密素编码基因eae的大肠埃希氏菌。
注:这种毒力基因组合常与STEC所引起的严重疾病相关。
3.3实时荧光PCR real time PCR
在PCR反应体系中加入荧光集团,利用荧光信号的积累实时监控整个PCR扩增过程。
3.4Ct值cycle threshold
每个反应管内荧光信号达到设定阈值时所经历的循环数。
1范围
SN/T 4781规定了出口食品和饲料中产志贺毒素大肠埃希氏菌的实时荧光PCR快速检测方法。
SN/T 4781适用于出口食品和饲料中产志贺毒素大肠埃希氏菌(O157、0104、0111、O26、O145和0103)的检测。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 6682分 析实验室用水规格和实验方法
GB 19489实验室生物安 全通用要求
GB/T 27403实验室质量控制规范 食 品分子生物学检测
3术语和定义
下列术语和定义适用于本文件。
3.1产志贺毒素大肠埃希氏菌Shiga toxin-producing Escherichia coli ;STEC
含有志贺毒素编码基因stx的大肠埃希氏菌。
3.2肠出血性大肠埃希氏菌Shiga toxin-producing Escherichia coli causing the attaching and effacing lesion
同时含有志贺毒素编码基因stx和紧密素编码基因eae的大肠埃希氏菌。
注:这种毒力基因组合常与STEC所引起的严重疾病相关。
3.3实时荧光PCR real time PCR
在PCR反应体系中加入荧光集团,利用荧光信号的积累实时监控整个PCR扩增过程。
3.4Ct值cycle threshold
每个反应管内荧光信号达到设定阈值时所经历的循环数。
标准图片预览




标准内容
中华人民共和国出入境检验检疫行业标准SN/T4781-2017
出口食品和饲料中产志贺毒素大肠埃希氏菌检测方法实时荧光PCR法Detection of Shiga toxin-producing Escherichia coli in food andanimalfeedforexports--Real-timePCRmethod2017-05-12发布
中华人民共和国
国家质量监督检验检疫总局
2017-12-01实施
本标准按照GB/T1.1一2009给出的规则起草本标准由国家认证认可监督管理委员会提出并归口。SN/T4781—2017
本标准起草单位:中华人民共和国江苏出入境检验检疫局、中华人民共和国上海出入境检验检疫局。
本标准主要起草人:邵景东、申进玲、封振、王传现、薛峰、郭旸、吴福平、王毅谦、李晓红、祝长青、肖震、崔思宇。
1范围
出口食品和饲料中产志贺毒素大肠埃希氏菌检测方法实时荧光PCR法SN/T4781-2017
本标准规定了出口食品和饲料中产志贺毒素大肠埃希氏菌的实时荧光PCR快速检测方法。本标准适用于出口食品和饲料中产志贺毒素大肠埃希氏菌(0157、01040111、026、0145和0103)的检测。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件GB/T6682分析实验室用水规格和实验方法GB19489实验室生物安全通用要求GB/T27403实验室质量控制规范食品分子生物学检测3术语和定义
下列术语和定义适用于本文件。3.1
产志贺毒素大肠埃希氏菌Shigatoxin-producingEscherichiacoli;STEC含有志贺毒素编码基因st的大肠埃希氏菌。3.2
肠出血性大肠埃希氏菌
effacinglesion
Shiga toxin-producing Escherichia coli causing the attaching and同时含有志贺毒素编码基因stt和紧密素编码基因eae的大肠埃希氏菌。注:这种毒力基因组合常与STEC所引起的严重疾病相关。3.3
realtimePCR
实时费光PCR
在PCR反应体系中加人荧光集团,利用荧光信号的积累实时监控整个PCR扩增过程。3.4
cyclethreshold
每个反应管内荧光信号达到设定阈值时所经历的循环数。4方法提要
对样品中微生物进行增菌培养后提取核酸,采用实时荧光PCR方法对志贺毒素编码基因stT和紧密素编码基因eae进行检测。若样品中st阳性,继续进行菌株分离:若stz和eae阳性,继续进行O血1
SN/T4781—2017
清组编码基因rfbE(O157)、wzx(O104)、wbdl(O111)、wzz(O26)、p1(O145)和wzzx(O103)的检测。若检测到以上某种O血清组阳性,可先对特异的O血清组菌株富集再进行菌株分离。5培养基和试剂
除有特殊说明外,所有实验用试剂均为分析纯;实验用水符合GB/T6682中一级水的要求。所有试剂均用无DNA酶污染的容器分装。5.1改良胰蛋白陈大豆肉汤(mTSB):见附录A中A.1。5.2
缓冲蛋白陈水(BPW):见A.2。CHROMagarSTEC显色培养基:见A.3。CHROMagarO157显色培养基:见A.4。改良山梨醇麦康凯(CT-SMAC)琼脂:见A.5。三糖铁琼脂(TSD):见A.6。
TE溶液。
10%SDS。
蛋白酶K(20mg/mL)。
氯化钠(NaCI):5mol/L和0.7mol/L。10%CTAB。
三氯甲烷。
异戊醇。
异丙醇。
70%乙醇。
核酸提取试剂盒。
PCR预混液。
引物和探针:见附录B。
诊断分型血清:0157、0104、0111026.0145和0103混合多价或单因子血清。API20E生化鉴定试剂条或同类产品。GNI+卡或同类产品。
标记单抗磁珠:抗一0157/0104/0111/026/0145/0103免疫磁珠试剂或同类产品。仪器和设备
恒温水浴或加热套装置:100℃。6.1
恒温培养箱:36℃土1℃。
离心机:最大转速13000r/min以上。6.3
天平:量程2kg,感量0.1g。
低温冰箱:-20℃~4℃。
均质器。
涂布棒:直径3mm~4mm。
接种环:直径3mm。
灭菌样品处理器具:取样勺、剪刀、镊子。6.9
可调移液器:1μL~1000μL。
实时PCR反应管(O.2/0.5mL),多孔PCR微孔板。6.12
荧光PCR仪。
6.13全自动细菌鉴定系统(VITEK或同类仪器)。6.14
显微镜。
磁极和混匀器。
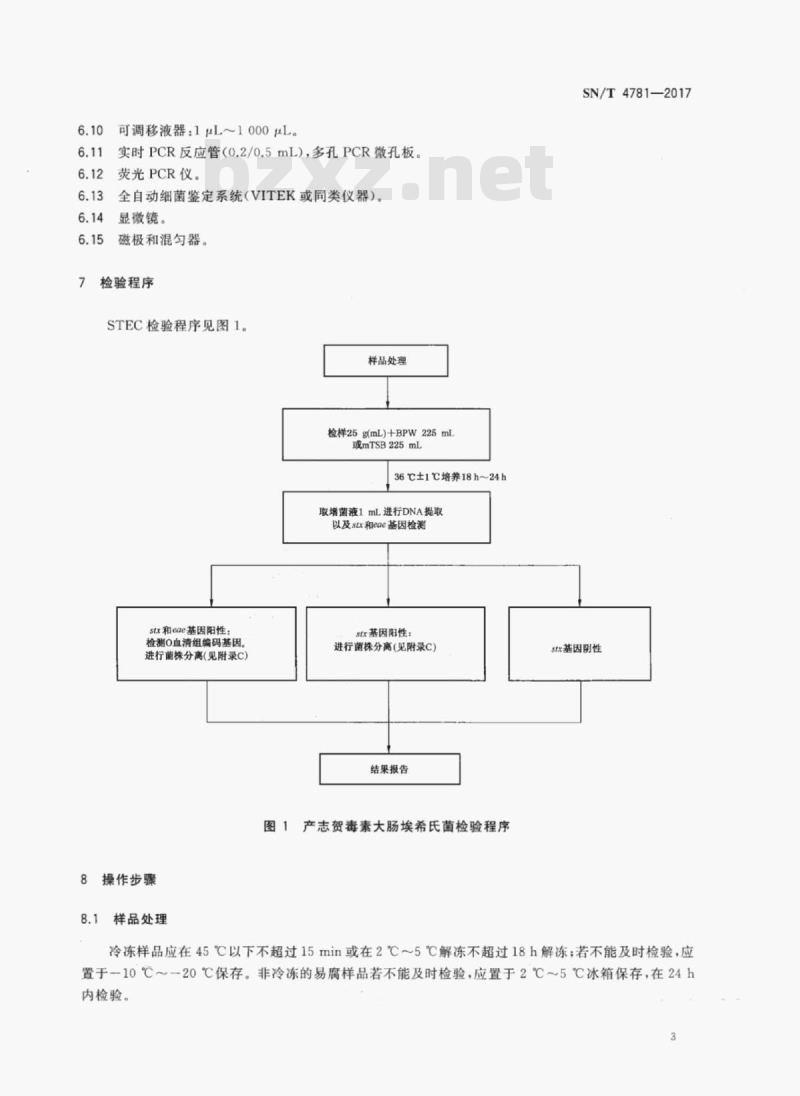
检验程序
STEC检验程序见图1。
样品处理
检样25g(mL)+BPW225mL
或mTSB225mL
36C±1C培养18h~24h
取增菌液1mL进行DNA提取
以及stx和eae基因检测
stx和eae基因阳性:
检测O血清组编码基因。
进行菌株分离(见附录C)
8操作步骤
8.1样品处理
sx基因阳性:
进行菌株分离(见附录C)
结果报告
图1产志贺毒素大肠埃希氏菌检验程序SN/T4781—2017
stx基因阴性
冷冻样品应在45℃以下不超过15min或在2℃~5℃解冻不超过18h解冻;若不能及时检验,应置于-10℃~-20℃保存。非冷冻的易腐样品若不能及时检验,应置于2℃~5℃冰箱保存,在24h内检验。
SN/T4781—2017
8.2样品制备
8.2.1固体和半固体样品
称取25g样品,放人盛有225mLmTSB的无菌均质杯内,8000r/min~10000r/min均质1min~2min,制成1:10样品匀液,或放入盛有225mLmTSB的无菌均质袋中,用拍击式均质器拍打1min~2min,制成1:10的样品匀液。8.2.2液体样品
用无菌吸管吸取25mL样品置于盛有225mLmTSB的无菌锥形瓶(瓶内预置适当数量无菌玻璃珠)中,充分混匀,制成1:10的样品匀液。8.2.3冷冻样品
称取25g或25mL样品,分别放人盛有225mLBPW的无菌均质杯(袋)或锥形瓶中,按照8.2.1或8.2.2步骤,充分混匀。
8.3增菌
将8.2制备的样品放于36℃士1℃培养箱中培养18h~24h。8.4核酸提取
取8.3增菌液1mL,加到1.5mL无菌离心管中。12000g离心1min;吸弃上清,取沉淀,加567μLTE溶液(pH8.0),悬浮,加30μL10%SDS和3μL蛋白酶K(20mg/mL),混匀,37℃温浴1h;加100μLNaCl(5mol/L),混匀,加80μLCTAB/NaCI溶液(10%CTAB和0.7mol/LNaCI),混勺,65℃温浴10min:加等体积三氯甲烷/异戊醇(体积比24:1),混匀,12000g离心10min:取上清液,加0.6倍体积异丙醇,轻轻混匀,12000g离心10min;取沉淀,用70%乙醇清洗2次。干燥,加100μLTE溶液溶解,立即用于荧光PCR反应或贮存一20℃备用。也可采用等效的商品化核酸提取试剂盒并按其说明提取核酸。8.5实时荧光PCR
8.5.1PCR反应体系
实时荧光PCR反应所用引物和探针见附录B。PCR反应体系见表1。每个DNA样品做2个平行管。加样时应使样品DNA溶液完全落入反应液中,不要粘附于壁上,加样后尽快盖紧管盖。表1PCR反应体系
TaqManUniversalMasterMix
引物(上游)
引物(下游)
DNA模板
去离子水
工作液浓度
20μmol/L
20μmol/L
10μmol/L
加样量/μL
补至20
终浓度
0.5μmol/L
0.5μmol/L
0.25μmol/L
对照设置
SN/T4781--2017
每次检验分别设置含有strl,st2和eae基因的大肠埃希氏菌为阳性对照,不含strl、stt2和eae的大肠埃希氏菌为阴性对照,以无菌水为试剂空白对照。可提前提取对照菌株的模板DNA并储存在一20℃冰箱中备用。
注:阳性对照株可使用大肠埃希氏菌CICC10670;阴性对照株可使用大肠埃希氏菌ATCC25922。8.5.3
PCR反应参数
实时荧光PCR反应参数为:50℃/2min;预变性95℃/10min,45个循环为95℃/15s,60℃/1min。
注:不同仪器可根据仪器要求将反应参数做适当调整。9结果分析
9.1值设定
实时荧光PCR反应结束后,设置荧光信号阅值,阅值设定原则根据仪器噪声情况进行调整,以阈值线刚好超过正常阴性样品扩增曲线的最高点为准。9.2
质控标准
阴性对照:各基因检测Ct值≥40。阳性对照:各基因检测Ct值<30。空白对照:各基因检测Ct值≥40。以上要求需在同一次实验中同时满足,否则,本次实验无效,需重新进行。3检测基因的选择
首先检测str(strl、sta2)基因和eae基因。对于str基因阳性[str1和(或)str2阳性]和eae基因阳性的样品继续进行rfbE(O157)、wzr(O104)、wbdl(O111)、wzr(O26)、ihp1(O145)和wzz(O103)O血清组编码基因的检测。
9.4结果判定及表述
9.4.1结果判定
在符合9.2的情况下,待检样品进行检测时,若:基因Ct值<35,则判定为该基因阳性基因Ct值≥40时,则判定为该基因阴性。Ct值在35~40之间,应重做实时荧光PCR扩增。再次扩增后的结果Ct值仍小于40,并有典型的扩增曲线,且对照结果均正常,则可判定该基因为阳性。
stx基因阳性的样本按照附录C的步骤进行确证。9.4.2结果表述
结果表述见表2。
SN/T4781-2017
检测结果
sta阴性
str阳性,但未分离到STEC菌株
stt阳性,
分离并确认
到STEC菌株
表2结果表述
结果表述
25g(mL)样品中未检出产志贺毒素大肠埃希氏菌eae和O血清组编码基因阴性
eae阳性O血清组编码基因阴性
eae 和 O血清组编码基因阳性
生物安全措施和防污染措施
生物安全措施
25gmL)样品中检出产志贺毒素大肠埃希氏菌25g(mL)样品中检出肠出血性大肠埃希氏菌25g(mL)样品中检出产志贺毒素大肠埃希氏菌相应O血清组为了保护实验室人员的安全,应由具备资格的工作人员进行操作,所有培养物和废弃物应参照GB19489中的有关规定执行。
防污染措施
防污染措施应符合GB/T27403的规定。6
A.1改良胰蛋白陈大豆肉汤(mTSB)A.1.1
基础培养基
A.1.1.1成分
胰酪蛋白陈
大豆蛋白陈
葡萄糖
氯化钠
磷酸氢二钾
三号胆盐
蒸馏水
A.1.1.2制法
附录A
(规范性附录)
培养基和试剂
SN/T4781—2017
将A.1.1.1中各成分溶于1000mL蒸馏水中,加热溶解,校正pH至7.4土0.2,121℃高压灭菌15min,备用。
抗生素溶液
新生霉素溶液
称取0.16g新生霉素于10mL灭菌蒸馏水中,振摇混匀,充分溶解后过滤除菌。A.1.2.2
吖啶黄素溶液
称取0.12g吖啶黄素于10mL灭菌蒸馏水中,振摇混匀,充分溶解后过滤除菌A.1.3完全培养基的配制
将1mL新生霉素溶液(A.1.2.1)加人1000mL冷却至50℃以下的mTSB(A.1.1)中,使新生霉素浓度达到16mg/L。
对于奶制品和乳制品的检测,将1mL吖啶黄素溶液(A.1.2.2)加人1000mL冷却至50℃以下的mTSB(A,1.1)中,使吖啶黄素浓度达到12mg/L。A.2
缓冲蛋白陈水(BPW)
蛋白陈
氯化钠
磷酸氢二钠
SN/T4781—2017
A.2.2制法
磷酸二氢钾
蒸馏水
将A.2.1中各成分溶于1000mL蒸馏水中,加热溶解,校正pH至7.4士0.2,121℃高压灭菌15min。
A.3CHROMagarSTEC显色培养基
A.3.1成分
蛋白陈和酵母粉
增补剂
蒸馏水
A.3.2制备
称取干粉30.8g溶于1000mL蒸馏水中,充分搅拌混匀,加热至100℃,不停搅拌,使其完全溶解。切勿加热超过100℃,切勿121℃高压灭菌。若使用微波炉加热,应将培养基加热沸腾,立即移出,轻轻摇匀,再放人微波炉加热,观察小气泡变为大气泡,直至完全溶解即可。切勿使培养基溢出。取增补剂两瓶[ST160(S)各加人5mL无菌水中搅拌混勺,或取增补剂一瓶[ST162(S)]加人10mL无菌水中搅拌混匀。把混匀后的增补剂加人到冷却至45℃~50℃的基础培养基中,轻轻摇动使其充分混匀,倾注平Ⅲ,使其凝固,晾干备用。也可根据需要按照30.8g/L的比例扩大或缩小制备培养基的量。该成品平板在室温可保存一天或在冰箱内贮存1个月(2℃~8℃,避光)。未使用完的STEC增补剂在2℃~8℃环境中可保持2个月。A.4CHROMagarO157显色培养基bzxZ.net
A.4.1成分
蛋白陈和酵母粉
蒸馏水
A.4.2制备
称取干粉29.2g溶于1000mL蒸馏水中,充分搅拌混匀。加热至100℃,不停搅拌,使其完全溶解。切勿加热超过100℃,切勿121℃高压灭菌。若使用微波炉加热,应将培养基加热沸腾,立即移出,轻轻摇勾,再放入微波炉加热,观察小气泡变为大气泡,直至完全溶解即可。切勿使培养基溢出。加热后的培养基冷却至45℃~50℃,轻轻地摇动均匀,倾注平Ⅲ,使其凝固,晾干备用。也可根据需要按照29.2g/L的比例扩大或缩小制备培养基的量该成品平板在室温可保存一天或在冰箱内贮存2周(2℃~8℃,避光)。8
A.5改良山梨醇麦康凯(CT-SMAC)琼脂A.5.1
基础培养基(山梨醇麦康凯琼脂)A.5.1.1成分
蛋白陈
山梨醇
三号胆盐
氯化钠
中性红
结晶紫
蒸馏水
A.5.1.2制法
SN/T4781—2017
将A.5.1.1各成分溶解于1000mL蒸馏水中,加热煮沸,校正pH至7.2士0.2,分装,121℃高压灭菌15min。
亚碲酸钾溶液
亚碲酸钾
蒸馏水
将亚碲酸钾溶于水,过滤法除菌。A.5.3
头孢克溶液
A.5.3.1成分
头孢克
96%乙醇
A.5.3.2制法
将头孢克溶于酒精中,静置1h待其充分溶解后过滤除菌。分装试管,储存于一20℃,有效期一年。解冻后的头孢克溶液不应冻存,且在2℃~8℃下有效期14d。A.5.4完全培养基的配制
将1mL亚碲酸钾溶液(A.5.2)和10mL头孢克肪溶液(A.5.3)加人1000mL冷却至45℃士1℃的山梨醇麦康凯琼脂(A,5.1),使亚碲酸钾浓度达到2.5mg/L,头孢克浓度达到0.05mg/L,混匀后倾注平板。
SN/T4781—2017
三糖铁琼脂(TSI)
蛋白陈
牛肉粉
酵母粉
氯化钠
月示陈
葡萄糖
硫酸亚铁
硫代硫酸钠
蒸馏水
称取本品64.5g,加热溶解于1000mL蒸馏水中,加热煮沸1min,校正pH至7.4士0.1,分装于16mm×150mm试管,121℃高压灭菌15min制成斜面长4cm~5cm,底部长2cm3cm。10
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
出口食品和饲料中产志贺毒素大肠埃希氏菌检测方法实时荧光PCR法Detection of Shiga toxin-producing Escherichia coli in food andanimalfeedforexports--Real-timePCRmethod2017-05-12发布
中华人民共和国
国家质量监督检验检疫总局
2017-12-01实施
本标准按照GB/T1.1一2009给出的规则起草本标准由国家认证认可监督管理委员会提出并归口。SN/T4781—2017
本标准起草单位:中华人民共和国江苏出入境检验检疫局、中华人民共和国上海出入境检验检疫局。
本标准主要起草人:邵景东、申进玲、封振、王传现、薛峰、郭旸、吴福平、王毅谦、李晓红、祝长青、肖震、崔思宇。
1范围
出口食品和饲料中产志贺毒素大肠埃希氏菌检测方法实时荧光PCR法SN/T4781-2017
本标准规定了出口食品和饲料中产志贺毒素大肠埃希氏菌的实时荧光PCR快速检测方法。本标准适用于出口食品和饲料中产志贺毒素大肠埃希氏菌(0157、01040111、026、0145和0103)的检测。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件GB/T6682分析实验室用水规格和实验方法GB19489实验室生物安全通用要求GB/T27403实验室质量控制规范食品分子生物学检测3术语和定义
下列术语和定义适用于本文件。3.1
产志贺毒素大肠埃希氏菌Shigatoxin-producingEscherichiacoli;STEC含有志贺毒素编码基因st的大肠埃希氏菌。3.2
肠出血性大肠埃希氏菌
effacinglesion
Shiga toxin-producing Escherichia coli causing the attaching and同时含有志贺毒素编码基因stt和紧密素编码基因eae的大肠埃希氏菌。注:这种毒力基因组合常与STEC所引起的严重疾病相关。3.3
realtimePCR
实时费光PCR
在PCR反应体系中加人荧光集团,利用荧光信号的积累实时监控整个PCR扩增过程。3.4
cyclethreshold
每个反应管内荧光信号达到设定阈值时所经历的循环数。4方法提要
对样品中微生物进行增菌培养后提取核酸,采用实时荧光PCR方法对志贺毒素编码基因stT和紧密素编码基因eae进行检测。若样品中st阳性,继续进行菌株分离:若stz和eae阳性,继续进行O血1
SN/T4781—2017
清组编码基因rfbE(O157)、wzx(O104)、wbdl(O111)、wzz(O26)、p1(O145)和wzzx(O103)的检测。若检测到以上某种O血清组阳性,可先对特异的O血清组菌株富集再进行菌株分离。5培养基和试剂
除有特殊说明外,所有实验用试剂均为分析纯;实验用水符合GB/T6682中一级水的要求。所有试剂均用无DNA酶污染的容器分装。5.1改良胰蛋白陈大豆肉汤(mTSB):见附录A中A.1。5.2
缓冲蛋白陈水(BPW):见A.2。CHROMagarSTEC显色培养基:见A.3。CHROMagarO157显色培养基:见A.4。改良山梨醇麦康凯(CT-SMAC)琼脂:见A.5。三糖铁琼脂(TSD):见A.6。
TE溶液。
10%SDS。
蛋白酶K(20mg/mL)。
氯化钠(NaCI):5mol/L和0.7mol/L。10%CTAB。
三氯甲烷。
异戊醇。
异丙醇。
70%乙醇。
核酸提取试剂盒。
PCR预混液。
引物和探针:见附录B。
诊断分型血清:0157、0104、0111026.0145和0103混合多价或单因子血清。API20E生化鉴定试剂条或同类产品。GNI+卡或同类产品。
标记单抗磁珠:抗一0157/0104/0111/026/0145/0103免疫磁珠试剂或同类产品。仪器和设备
恒温水浴或加热套装置:100℃。6.1
恒温培养箱:36℃土1℃。
离心机:最大转速13000r/min以上。6.3
天平:量程2kg,感量0.1g。
低温冰箱:-20℃~4℃。
均质器。
涂布棒:直径3mm~4mm。
接种环:直径3mm。
灭菌样品处理器具:取样勺、剪刀、镊子。6.9
可调移液器:1μL~1000μL。
实时PCR反应管(O.2/0.5mL),多孔PCR微孔板。6.12
荧光PCR仪。
6.13全自动细菌鉴定系统(VITEK或同类仪器)。6.14
显微镜。
磁极和混匀器。
检验程序
STEC检验程序见图1。
样品处理
检样25g(mL)+BPW225mL
或mTSB225mL
36C±1C培养18h~24h
取增菌液1mL进行DNA提取
以及stx和eae基因检测
stx和eae基因阳性:
检测O血清组编码基因。
进行菌株分离(见附录C)
8操作步骤
8.1样品处理
sx基因阳性:
进行菌株分离(见附录C)
结果报告
图1产志贺毒素大肠埃希氏菌检验程序SN/T4781—2017
stx基因阴性
冷冻样品应在45℃以下不超过15min或在2℃~5℃解冻不超过18h解冻;若不能及时检验,应置于-10℃~-20℃保存。非冷冻的易腐样品若不能及时检验,应置于2℃~5℃冰箱保存,在24h内检验。
SN/T4781—2017
8.2样品制备
8.2.1固体和半固体样品
称取25g样品,放人盛有225mLmTSB的无菌均质杯内,8000r/min~10000r/min均质1min~2min,制成1:10样品匀液,或放入盛有225mLmTSB的无菌均质袋中,用拍击式均质器拍打1min~2min,制成1:10的样品匀液。8.2.2液体样品
用无菌吸管吸取25mL样品置于盛有225mLmTSB的无菌锥形瓶(瓶内预置适当数量无菌玻璃珠)中,充分混匀,制成1:10的样品匀液。8.2.3冷冻样品
称取25g或25mL样品,分别放人盛有225mLBPW的无菌均质杯(袋)或锥形瓶中,按照8.2.1或8.2.2步骤,充分混匀。
8.3增菌
将8.2制备的样品放于36℃士1℃培养箱中培养18h~24h。8.4核酸提取
取8.3增菌液1mL,加到1.5mL无菌离心管中。12000g离心1min;吸弃上清,取沉淀,加567μLTE溶液(pH8.0),悬浮,加30μL10%SDS和3μL蛋白酶K(20mg/mL),混匀,37℃温浴1h;加100μLNaCl(5mol/L),混匀,加80μLCTAB/NaCI溶液(10%CTAB和0.7mol/LNaCI),混勺,65℃温浴10min:加等体积三氯甲烷/异戊醇(体积比24:1),混匀,12000g离心10min:取上清液,加0.6倍体积异丙醇,轻轻混匀,12000g离心10min;取沉淀,用70%乙醇清洗2次。干燥,加100μLTE溶液溶解,立即用于荧光PCR反应或贮存一20℃备用。也可采用等效的商品化核酸提取试剂盒并按其说明提取核酸。8.5实时荧光PCR
8.5.1PCR反应体系
实时荧光PCR反应所用引物和探针见附录B。PCR反应体系见表1。每个DNA样品做2个平行管。加样时应使样品DNA溶液完全落入反应液中,不要粘附于壁上,加样后尽快盖紧管盖。表1PCR反应体系
TaqManUniversalMasterMix
引物(上游)
引物(下游)
DNA模板
去离子水
工作液浓度
20μmol/L
20μmol/L
10μmol/L
加样量/μL
补至20
终浓度
0.5μmol/L
0.5μmol/L
0.25μmol/L
对照设置
SN/T4781--2017
每次检验分别设置含有strl,st2和eae基因的大肠埃希氏菌为阳性对照,不含strl、stt2和eae的大肠埃希氏菌为阴性对照,以无菌水为试剂空白对照。可提前提取对照菌株的模板DNA并储存在一20℃冰箱中备用。
注:阳性对照株可使用大肠埃希氏菌CICC10670;阴性对照株可使用大肠埃希氏菌ATCC25922。8.5.3
PCR反应参数
实时荧光PCR反应参数为:50℃/2min;预变性95℃/10min,45个循环为95℃/15s,60℃/1min。
注:不同仪器可根据仪器要求将反应参数做适当调整。9结果分析
9.1值设定
实时荧光PCR反应结束后,设置荧光信号阅值,阅值设定原则根据仪器噪声情况进行调整,以阈值线刚好超过正常阴性样品扩增曲线的最高点为准。9.2
质控标准
阴性对照:各基因检测Ct值≥40。阳性对照:各基因检测Ct值<30。空白对照:各基因检测Ct值≥40。以上要求需在同一次实验中同时满足,否则,本次实验无效,需重新进行。3检测基因的选择
首先检测str(strl、sta2)基因和eae基因。对于str基因阳性[str1和(或)str2阳性]和eae基因阳性的样品继续进行rfbE(O157)、wzr(O104)、wbdl(O111)、wzr(O26)、ihp1(O145)和wzz(O103)O血清组编码基因的检测。
9.4结果判定及表述
9.4.1结果判定
在符合9.2的情况下,待检样品进行检测时,若:基因Ct值<35,则判定为该基因阳性基因Ct值≥40时,则判定为该基因阴性。Ct值在35~40之间,应重做实时荧光PCR扩增。再次扩增后的结果Ct值仍小于40,并有典型的扩增曲线,且对照结果均正常,则可判定该基因为阳性。
stx基因阳性的样本按照附录C的步骤进行确证。9.4.2结果表述
结果表述见表2。
SN/T4781-2017
检测结果
sta阴性
str阳性,但未分离到STEC菌株
stt阳性,
分离并确认
到STEC菌株
表2结果表述
结果表述
25g(mL)样品中未检出产志贺毒素大肠埃希氏菌eae和O血清组编码基因阴性
eae阳性O血清组编码基因阴性
eae 和 O血清组编码基因阳性
生物安全措施和防污染措施
生物安全措施
25gmL)样品中检出产志贺毒素大肠埃希氏菌25g(mL)样品中检出肠出血性大肠埃希氏菌25g(mL)样品中检出产志贺毒素大肠埃希氏菌相应O血清组为了保护实验室人员的安全,应由具备资格的工作人员进行操作,所有培养物和废弃物应参照GB19489中的有关规定执行。
防污染措施
防污染措施应符合GB/T27403的规定。6
A.1改良胰蛋白陈大豆肉汤(mTSB)A.1.1
基础培养基
A.1.1.1成分
胰酪蛋白陈
大豆蛋白陈
葡萄糖
氯化钠
磷酸氢二钾
三号胆盐
蒸馏水
A.1.1.2制法
附录A
(规范性附录)
培养基和试剂
SN/T4781—2017
将A.1.1.1中各成分溶于1000mL蒸馏水中,加热溶解,校正pH至7.4土0.2,121℃高压灭菌15min,备用。
抗生素溶液
新生霉素溶液
称取0.16g新生霉素于10mL灭菌蒸馏水中,振摇混匀,充分溶解后过滤除菌。A.1.2.2
吖啶黄素溶液
称取0.12g吖啶黄素于10mL灭菌蒸馏水中,振摇混匀,充分溶解后过滤除菌A.1.3完全培养基的配制
将1mL新生霉素溶液(A.1.2.1)加人1000mL冷却至50℃以下的mTSB(A.1.1)中,使新生霉素浓度达到16mg/L。
对于奶制品和乳制品的检测,将1mL吖啶黄素溶液(A.1.2.2)加人1000mL冷却至50℃以下的mTSB(A,1.1)中,使吖啶黄素浓度达到12mg/L。A.2
缓冲蛋白陈水(BPW)
蛋白陈
氯化钠
磷酸氢二钠
SN/T4781—2017
A.2.2制法
磷酸二氢钾
蒸馏水
将A.2.1中各成分溶于1000mL蒸馏水中,加热溶解,校正pH至7.4士0.2,121℃高压灭菌15min。
A.3CHROMagarSTEC显色培养基
A.3.1成分
蛋白陈和酵母粉
增补剂
蒸馏水
A.3.2制备
称取干粉30.8g溶于1000mL蒸馏水中,充分搅拌混匀,加热至100℃,不停搅拌,使其完全溶解。切勿加热超过100℃,切勿121℃高压灭菌。若使用微波炉加热,应将培养基加热沸腾,立即移出,轻轻摇匀,再放人微波炉加热,观察小气泡变为大气泡,直至完全溶解即可。切勿使培养基溢出。取增补剂两瓶[ST160(S)各加人5mL无菌水中搅拌混勺,或取增补剂一瓶[ST162(S)]加人10mL无菌水中搅拌混匀。把混匀后的增补剂加人到冷却至45℃~50℃的基础培养基中,轻轻摇动使其充分混匀,倾注平Ⅲ,使其凝固,晾干备用。也可根据需要按照30.8g/L的比例扩大或缩小制备培养基的量。该成品平板在室温可保存一天或在冰箱内贮存1个月(2℃~8℃,避光)。未使用完的STEC增补剂在2℃~8℃环境中可保持2个月。A.4CHROMagarO157显色培养基bzxZ.net
A.4.1成分
蛋白陈和酵母粉
蒸馏水
A.4.2制备
称取干粉29.2g溶于1000mL蒸馏水中,充分搅拌混匀。加热至100℃,不停搅拌,使其完全溶解。切勿加热超过100℃,切勿121℃高压灭菌。若使用微波炉加热,应将培养基加热沸腾,立即移出,轻轻摇勾,再放入微波炉加热,观察小气泡变为大气泡,直至完全溶解即可。切勿使培养基溢出。加热后的培养基冷却至45℃~50℃,轻轻地摇动均匀,倾注平Ⅲ,使其凝固,晾干备用。也可根据需要按照29.2g/L的比例扩大或缩小制备培养基的量该成品平板在室温可保存一天或在冰箱内贮存2周(2℃~8℃,避光)。8
A.5改良山梨醇麦康凯(CT-SMAC)琼脂A.5.1
基础培养基(山梨醇麦康凯琼脂)A.5.1.1成分
蛋白陈
山梨醇
三号胆盐
氯化钠
中性红
结晶紫
蒸馏水
A.5.1.2制法
SN/T4781—2017
将A.5.1.1各成分溶解于1000mL蒸馏水中,加热煮沸,校正pH至7.2士0.2,分装,121℃高压灭菌15min。
亚碲酸钾溶液
亚碲酸钾
蒸馏水
将亚碲酸钾溶于水,过滤法除菌。A.5.3
头孢克溶液
A.5.3.1成分
头孢克
96%乙醇
A.5.3.2制法
将头孢克溶于酒精中,静置1h待其充分溶解后过滤除菌。分装试管,储存于一20℃,有效期一年。解冻后的头孢克溶液不应冻存,且在2℃~8℃下有效期14d。A.5.4完全培养基的配制
将1mL亚碲酸钾溶液(A.5.2)和10mL头孢克肪溶液(A.5.3)加人1000mL冷却至45℃士1℃的山梨醇麦康凯琼脂(A,5.1),使亚碲酸钾浓度达到2.5mg/L,头孢克浓度达到0.05mg/L,混匀后倾注平板。
SN/T4781—2017
三糖铁琼脂(TSI)
蛋白陈
牛肉粉
酵母粉
氯化钠
月示陈
葡萄糖
硫酸亚铁
硫代硫酸钠
蒸馏水
称取本品64.5g,加热溶解于1000mL蒸馏水中,加热煮沸1min,校正pH至7.4士0.1,分装于16mm×150mm试管,121℃高压灭菌15min制成斜面长4cm~5cm,底部长2cm3cm。10
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。