SN/T 4462-2016
基本信息
标准号: SN/T 4462-2016
中文名称:国境口岸01群和0139群霍乱弧菌和霍乱肠毒素三重实时PCR的检测方法
标准类别:商检行业标准(SN)
标准状态:现行
出版语种:简体中文
下载格式:.zip .pdf
下载大小:9445667
相关标签: 国境 口岸 霍乱弧菌 霍乱 肠毒素 三重 实时 PCR 检测 方法

标准分类号
关联标准
出版信息
相关单位信息
标准简介
SN/T 4462-2016.Detection method for 01 serotype,O139 serotype vibrio cholera and enterotoxin by triplex real-time fluorescence PCR at frontier port.
1范围
SN/T 4462规定了国境口岸01群和O139群霍乱弧菌以及霍乱肠毒素基因三重实时PCR检测方法检验的对象、标本采集、检验程序及结果判定报告。
SN/T 4462适用于国境口岸对01群和O139群霍乱弧菌以及霍乱肠毒素基因的实验室检测。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB 19489实验室生物安全通用要求
WS/T 230临床诊断中聚合酶链反应(PCR)技术的应用
3术语和定义
下列术语和定义适用于本文件。
3.1 01群霍乱弧菌01 serotypevibrio cholera
菌体抗原由3种抗原因子A.B、C组成,又可分为3个血清型:小川型、稻叶型和彦岛型。根据表型差异,01群霍乱弧菌的每一个血清型还可分为2个生物型,即古典生物型和EI Tor生物型。
3.2 0139群霍乱弧菌0139 serotype pibriocholera
其临床表现及传播方式上与01群霍乱弧菌完全相同,但不能被61群霍乱弧菌诊断血清所凝集,抗01群的抗血清对0139菌株无保护性免疫。在水中的存活时间较O1群霍乱弧菌长。
3.3霍乱肠毒素vibrio cholera enterotoxin
是目前已知的致泻毒素中最为强烈的毒素,是肠毒素的典型代表。作用于肠细胞膜表面上的受体,导致肠黏膜细胞分泌功能大为亢进,使大量体液和电解质进人肠腔而发生剧烈吐泻。
1范围
SN/T 4462规定了国境口岸01群和O139群霍乱弧菌以及霍乱肠毒素基因三重实时PCR检测方法检验的对象、标本采集、检验程序及结果判定报告。
SN/T 4462适用于国境口岸对01群和O139群霍乱弧菌以及霍乱肠毒素基因的实验室检测。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB 19489实验室生物安全通用要求
WS/T 230临床诊断中聚合酶链反应(PCR)技术的应用
3术语和定义
下列术语和定义适用于本文件。
3.1 01群霍乱弧菌01 serotypevibrio cholera
菌体抗原由3种抗原因子A.B、C组成,又可分为3个血清型:小川型、稻叶型和彦岛型。根据表型差异,01群霍乱弧菌的每一个血清型还可分为2个生物型,即古典生物型和EI Tor生物型。
3.2 0139群霍乱弧菌0139 serotype pibriocholera
其临床表现及传播方式上与01群霍乱弧菌完全相同,但不能被61群霍乱弧菌诊断血清所凝集,抗01群的抗血清对0139菌株无保护性免疫。在水中的存活时间较O1群霍乱弧菌长。
3.3霍乱肠毒素vibrio cholera enterotoxin
是目前已知的致泻毒素中最为强烈的毒素,是肠毒素的典型代表。作用于肠细胞膜表面上的受体,导致肠黏膜细胞分泌功能大为亢进,使大量体液和电解质进人肠腔而发生剧烈吐泻。
标准图片预览




标准内容
中华人民共和国出入境检验检疫行业标准SN/T4462—2016
国境口岸01群和0139群霍乱弧菌和霍乱肠毒素三重实时PCR的检测方法Detection method for O1 serotype,O139 serotype vibrio cholera and enterotoxinbytriplexreal-timefluorescencePCRatfrontierport2016-03-09发布
中华人民共和国
国家质量监督检验检疫总局
2016-10-01实施
本标准按照GB/T1.1一2009给出的规则起草。本标准由国家认证认可监督管理委员会提出并归口。SN/T4462—2016
本标准起草单位:中华人民共和国宁波出人境检验检疫局、中华人民共和国珠海出人境检验检疫局。
本标准主要起草人:周冬根、王燕、李红、孙大为、郑剑宁、裘炯良、倪敏君、张升、张绮、杨天赐、莫秋华。
1范围
国境口岸01群和0139群霍乱弧菌和霍乱肠毒素三重实时PCR的检测方法SN/T4462—2016
本标准规定了国境口岸O1群和O139群霍乱弧菌以及霍乱肠毒素基因三重实时PCR检测方法检验的对象、标本采集、检验程序及结果判定报告本标准适用于国境口岸对O1群和O139群霍乱弧菌以及霍乱肠毒素基因的实验室检测。2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB19489实验室生物安全通用要求WS/T230
临床诊断中聚合酶链反应(PCR)技术的应用3术语和定义
下列术语和定义适用于本文件
01serotype
01群霍乱弧菌
vibrio cholera
菌体抗原由3种抗原因子A、B.C组成,又可分为3个血清型:小川型、稻叶型和彦岛型。根据表型差异,O1群霍乱弧菌的每一个血清型还可分为2个生物型,即古典生物型和EITor生物型。3.2
0139群霍乱弧菌0139serotype
vibrio cholera
其临床表现及传播方式上与
01群霍乱弧菌完全
相同,但不能被01群霍乱弧菌诊断血清所凝集,抗01群的抗血清对O139菌株无保护性免疫。在水中的存活时间较O1群霍乱弧菌长。3.3
vibriocholeraenterotoxin
霍乱肠毒素
是目前已知的致泻毒素中最为强烈的毒素,是肠毒素的典型代表。作用于肠细胞膜表面上的受体,导致肠黏膜细胞分泌功能大为亢进,使大量体液和电解质进人肠腔而发生剧烈吐泻。4检测对象
4.1疑似病人的排泄物、呕吐物。4.2被霍乱弧菌污染或有霍乱弧菌污染嫌疑的交通工具、行李、货物、集装箱、邮包、饮用水、压舱水、污水、餐饮用具、生活用品。
5主要仪器设备
本方法使用的主要仪器如下:
SN/T4462—2016
超净工作台;
二级生物安全柜;
微型混合器、涡旋振荡器;
冰箱:4℃;-20℃;
恒温金属浴;
普通台式离心机;
高速冷冻离心机(离心力可达20000g);可调式微量加样器(10μL、100μL、1000μL)及配套带滤芯吸头;荧光PCR检测仪。
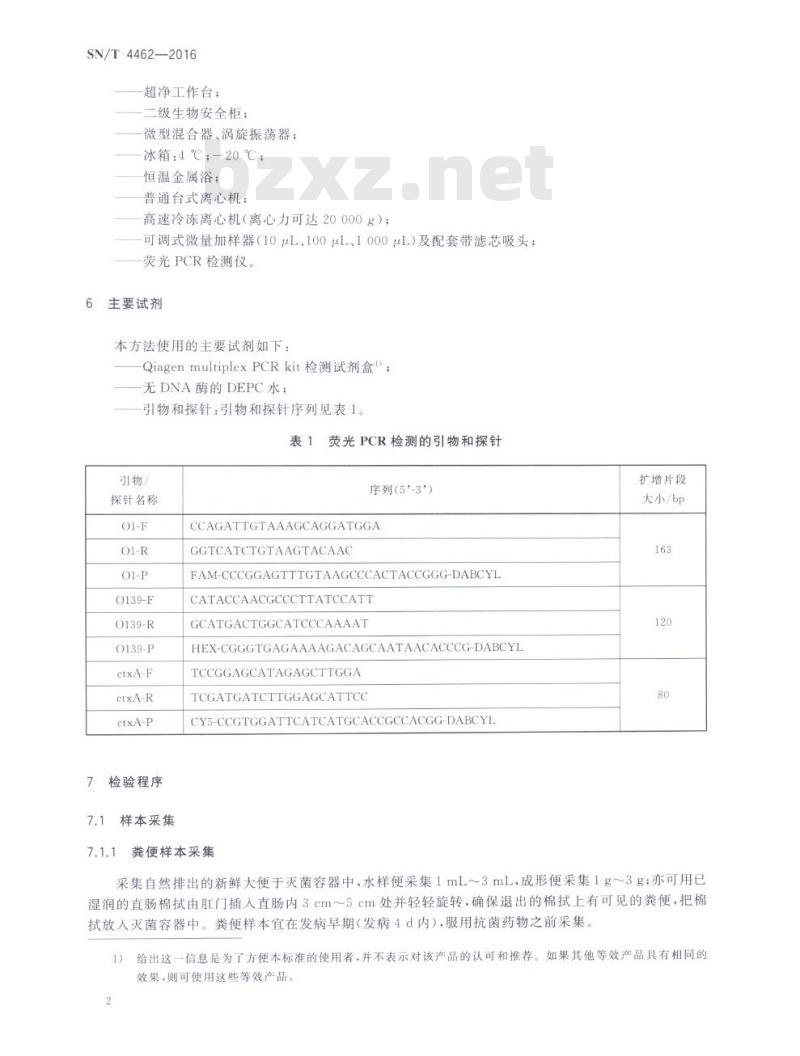
主要试剂
本方法使用的主要试剂如下:
QiagenmultiplexPCRkit检测试剂盒!无DNA酶的DEPC水;
引物和探针:引物和探针序列见表1。表1
荧光PCR检测的引物和探针
引物/
探针名称
O139-F
O139-R
O139-P
ctxA-F
ctxA-R
ctxA-P
检验程序
样本采集
序列(5'-3\)
CCAGATTGTAAAGCAGGATGGA
GGTCATCTGTAAGTACAAC
FAM-CCCGGAGTTTGTAAGCCCACTACCGGG-DABCYLCATACCAACGCCCTTATCCATT
GCATGACTGGCATCCCAAAAT
HEX-CGGGTGAGAAAAGACAGCAATAACACCCG-DABCYLTCCGGAGCATAGAGCTTGGA
TCGATGATCTTGGAGCATTCC
CY5-CCGTGGATTCATCATGCACCGCCACGG-DABCYL粪便样本采集
扩增片段
大小/bp
采集自然排出的新鲜大便于灭菌容器中,水样便采集1mL~3mL,成形便采集1g~3g亦可用已湿润的直肠棉拭由肛门插入直肠内3cm~5cm处并轻轻旋转,确保退出的棉拭上有可见的粪便,把棉拭放入灭菌容器中。粪便样本宜在发病早期(发病4d内),服用抗菌药物之前采集给出这一信息是为了方便本标准的使用者,并不表示对该产品的认可和推荐。如果其他等效产品具有相同的1)
效果,则可使用这些等效产品。2
7.1.2呕吐物样本采集
SN/T4462—2016
采集自然呕吐的呕吐物于灭菌容器中,水样呕吐物采集1mL~3mL,非水样呕吐物采集1g~3g。7.1.3水样采集
7.1.3.1直接采集法
用灭菌容器采集水样。饮用水、压舱水用灭菌容器采集500mL样本;江、湖、河、海、塘或井水则采集岸边20cm深度以内的表层水500mL,放于灭菌容器中。采集的水样宜尽快(3h内)送到实验室。不能在3h内送检的,宜在采水点即将50mL10倍浓缩碱性蛋白陈水(见附录A中A.1)加人450mL水样中,混匀。
7.1.3.2纱布块集菌法
用中心系有1m以上线绳的20cm×20cm灭菌脱脂纱布块放在采水点的水中,将线绳固定于岸边物体上,放置过夜(16h~24h),次日将吸着水(约18mL)的纱布块放人灭菌容器中送实验室。7.1.4物体表面样本的采集
用灭菌棉拭蘸以碱性蛋白陈水涂抹可疑部位,置于灭菌容器中。7.2样本保存与运送
7.2.1因霍乱弧菌对低温敏感,样本不需要冷藏保存运送,只须将用于霍乱弧菌检验的样本置于室温运送和保存。实验室收到的样本应按照GB19489要求,一般宜当天做到直接分离或/和增菌后分离。7.2.2不能于当天进行检验的样本,可选择4℃~8℃保存,24h内检验。7.2.3采集的粪便或呕吐物样本不能立即送检时(3h内),宜根据运送时间,选择样本传递保存方式。如运送时间小于8h,将样本放人碱性蛋白陈水中传递。如运送时间大于8h,将样本放人Cary-Blair二氏运送培养基(见附录A中A.2)中传递,带有样本的棉拭宜完全地插入Cary-Blair二氏运送培养基底部。
7.3样本处理
7.3.1水样的处理
取450mL用直接采集法采集的水样,以1mol/L氢氧化钠调pH至8.4~9.2。7.4增菌培养
7.4.1粪便样本的增菌培养
取水样便约1mL或成形便约1g或棉拭样本放入8mL~10mL碱性蛋白陈水中,成形便要磨碎,轻轻摇匀;35℃~37℃培养6h~8h。7.4.2水样的增菌培养
在经pH调节后的用直接采集法采集的450mL水样中,加人10倍浓缩碱性蛋白陈水50mL,为抑制杂菌可再加人1%亚碲酸钾0.25mL~0.5mL和1000U/mL青霉素1mL,35℃~37℃培养16h~24h;对用纱布块集菌法采集的水样,将50mL碱性蛋白陈水加入盛有纱布块样本的灭菌容器中,可再加1%亚碲酸钾0.05mL和1000U/mL青霉素0.15mL,35℃~37℃培养16h~24h。3
SN/T4462—2016
用棉拭涂抹法采集的样本的增菌培养将用棉拭涂抹法采集的样本棉拭,放人8mL~10mL碱性蛋白陈水中,35℃~37℃培养6h8h。7.5
细菌核酸的提取
煮沸裂解法
取1mL增菌液放入1.5mL离心管中,12000r/min离心10min;弃上清液,加人100μLDNA提取液(见附录A中A.3)充分悬浮沉淀,100℃沸水浴10min;冷却至室温,12000r/min离心5min,离心取上清液作为PCR扩增的模板。7.5.2
试剂盒提取纯化核酸法
按适用于细菌基因组提取的商品试剂盒说明书操作,如QIAampDNAminikit试剂盒。7.6阳性对照、阴性对照和空白对照设置检测过程中应按照WS/T230执行,分别设阳性对照、阴性对照和空白对照。阳性对照为分别根据O1群霍乱弧菌目标扩增基因序列、O139群霍乱弧菌目标扩增基因序列及霍乱肠毒素基因(ctxA)目标扩增基因序列经体外化学合成、载体构建的DNA片段,阴性对照为可选择其他种类弧菌的核酸样本,空白对照用无菌水作为荧光PCR反应的模板。多重荧光PCR反应体系组成
具体配制见表2。
样本三重荧光PCR检测反应体系
体积/μL
2XmultiplexPCRmastermix
O1-F(100μmol/L)
O1-R(100μmol/L)
O1-P(50 μmol/L)
O139-F(100μmol/L
O139-R(100μmol/L)
O139-P(50 μmol/L)
ctxA-F(100 μmol/L)
ctxA-R(100 μmol/L)
ctxA-P(50 μmol/L)
去离子水
DNA模板
三重荧光PCR反应
将加好样的PCR反应管分别转移到荧光PCR检测仪上进行扩增反应,程序设置为以ABIPrismSN/T4462—2016
75oofast型全自动荧光定量PCR检测仪为例说明,将荧光信号设置为:ReporterDye:O1群霍乱弧菌为FAM,O139群霍乱弧菌为HEX,霍乱肠毒素为CY5,QuencherDye:BHQ1,Passivereference选择None。荧光PCR扩增程序按照表3中的程序进行设置,反应总体积为25μL。对于其他型号的荧光定量PCR仪应按实际机型进行反应程序设置,没有ROX荧光通道的荧光定量PCR仪,不进行ROX的设置。
扩增及荧光收集
荧光域值的设定
反应温度
样本实时荧光PCR反应程序
PCR反应完成后应设定荧光阈值以分析样品的采集荧光信号
循环数
值。以PCR反应的前3个~15个循环的荧光信号作为基线信号(噪音),Ct值理论上定义为基线信号的标准偏差的1D倍。在实际应用中可以根据仪器基线信号进行人工调整,设定原则是以阅值线刚好超过正常阴性对照样品扩增曲线(无规则的噪音线)的最高点,且不出现Ct值为准。8
检验结果判断及报告
在荧光RT-PCR实验中,若阳性对照有明显的荧光增幅现象,且Ct值在预期的范围之内(≤32);阴性对照和空白对照无荧光增幅现象,则表明反应体系运行行正常,可以进行结果判定;否则,实验视为无效,需重新实验。
当同时进行的阳性、阴性和空白对照实验结果正常,本方法检验结果判定如下:时,判为阳性。
检测样品有明显的荧光增幅曲线,值≤35
检测样品荧光增幅曲线的
Ct值介于35和40
新进行实时荧光PCR检测。
期,判为阳性,否则判为阴性。若重新检测的
之间时,
,建议采用浓缩方式处理核酸样本,再重值有明显减少
此类样本建议用其他大
方法进
检测样品无荧光增幅现象,判为阴性结果报告模式见表4。
反应液
01群霍乱
O139群霍乱
霍乱肠毒素
结果报告
模式1
霍乱弧菌
核酸阴性
模式2
结果报告模式
模式3
01群霍乱弧菌
核酸阳性,且
含有毒素基因
O139群霍乱弧
菌核酸阳性,且
含有毒素基因
趋势,且曲线有明显的对数增长步验证。
模式4
O1群霍乱弧菌
核酸阳性
模式5
0139群霍乱弧菌
核酸阳性
SN/T4462—2016
碱性蛋白陈水
成分如下:
蛋白陈:10.0g;
氯化钠:10.0g;
蒸馏水:1000mL。
附录A
(规范性附录)
培养基和试剂
将上述各成分加热搅拌溶解,调至pH至8.4~8.8,分装,每支试管8mL~10mL或每瓶225mL,121℃高压灭菌20min(10倍碱性蛋白陈水的蛋白陈和氯化钠量增加10倍)。也可用市场上销售的碱性蛋白陈水A.2
Cary-Blair二氏运送培养基(C-B半固体保存培养基)A.2.1成分
成分如下:
硫乙醇酸钠:1.5g;免费标准bzxz.net
磷酸氢二钠:1.1g;
氯化钠:5.0g;
琼脂:5.0g;
蒸馏水:1000mL;
1%氯化钙溶液:9mL。
除1%氯化钙溶液外,其他按上述成分配制,加热溶解,待冷至50℃时,加人1%氯化钙溶液9mL,调pH至8.4,分装试管,每支8mL10mL。121℃高压灭菌15min。A.3
DNA提取液
A.3.1成分
成分如下:
Tris·HCl:20mmol/L;
KCI:10ommol/L;
EDTA:2.5mmol/L;
NP-40:1%;
PEG800:20%;
纯化水。
按上述成分的终浓度进行称量配制,加热溶解,并调pH至8.9,分装,SN/T4462—2016
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
国境口岸01群和0139群霍乱弧菌和霍乱肠毒素三重实时PCR的检测方法Detection method for O1 serotype,O139 serotype vibrio cholera and enterotoxinbytriplexreal-timefluorescencePCRatfrontierport2016-03-09发布
中华人民共和国
国家质量监督检验检疫总局
2016-10-01实施
本标准按照GB/T1.1一2009给出的规则起草。本标准由国家认证认可监督管理委员会提出并归口。SN/T4462—2016
本标准起草单位:中华人民共和国宁波出人境检验检疫局、中华人民共和国珠海出人境检验检疫局。
本标准主要起草人:周冬根、王燕、李红、孙大为、郑剑宁、裘炯良、倪敏君、张升、张绮、杨天赐、莫秋华。
1范围
国境口岸01群和0139群霍乱弧菌和霍乱肠毒素三重实时PCR的检测方法SN/T4462—2016
本标准规定了国境口岸O1群和O139群霍乱弧菌以及霍乱肠毒素基因三重实时PCR检测方法检验的对象、标本采集、检验程序及结果判定报告本标准适用于国境口岸对O1群和O139群霍乱弧菌以及霍乱肠毒素基因的实验室检测。2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB19489实验室生物安全通用要求WS/T230
临床诊断中聚合酶链反应(PCR)技术的应用3术语和定义
下列术语和定义适用于本文件
01serotype
01群霍乱弧菌
vibrio cholera
菌体抗原由3种抗原因子A、B.C组成,又可分为3个血清型:小川型、稻叶型和彦岛型。根据表型差异,O1群霍乱弧菌的每一个血清型还可分为2个生物型,即古典生物型和EITor生物型。3.2
0139群霍乱弧菌0139serotype
vibrio cholera
其临床表现及传播方式上与
01群霍乱弧菌完全
相同,但不能被01群霍乱弧菌诊断血清所凝集,抗01群的抗血清对O139菌株无保护性免疫。在水中的存活时间较O1群霍乱弧菌长。3.3
vibriocholeraenterotoxin
霍乱肠毒素
是目前已知的致泻毒素中最为强烈的毒素,是肠毒素的典型代表。作用于肠细胞膜表面上的受体,导致肠黏膜细胞分泌功能大为亢进,使大量体液和电解质进人肠腔而发生剧烈吐泻。4检测对象
4.1疑似病人的排泄物、呕吐物。4.2被霍乱弧菌污染或有霍乱弧菌污染嫌疑的交通工具、行李、货物、集装箱、邮包、饮用水、压舱水、污水、餐饮用具、生活用品。
5主要仪器设备
本方法使用的主要仪器如下:
SN/T4462—2016
超净工作台;
二级生物安全柜;
微型混合器、涡旋振荡器;
冰箱:4℃;-20℃;
恒温金属浴;
普通台式离心机;
高速冷冻离心机(离心力可达20000g);可调式微量加样器(10μL、100μL、1000μL)及配套带滤芯吸头;荧光PCR检测仪。
主要试剂
本方法使用的主要试剂如下:
QiagenmultiplexPCRkit检测试剂盒!无DNA酶的DEPC水;
引物和探针:引物和探针序列见表1。表1
荧光PCR检测的引物和探针
引物/
探针名称
O139-F
O139-R
O139-P
ctxA-F
ctxA-R
ctxA-P
检验程序
样本采集
序列(5'-3\)
CCAGATTGTAAAGCAGGATGGA
GGTCATCTGTAAGTACAAC
FAM-CCCGGAGTTTGTAAGCCCACTACCGGG-DABCYLCATACCAACGCCCTTATCCATT
GCATGACTGGCATCCCAAAAT
HEX-CGGGTGAGAAAAGACAGCAATAACACCCG-DABCYLTCCGGAGCATAGAGCTTGGA
TCGATGATCTTGGAGCATTCC
CY5-CCGTGGATTCATCATGCACCGCCACGG-DABCYL粪便样本采集
扩增片段
大小/bp
采集自然排出的新鲜大便于灭菌容器中,水样便采集1mL~3mL,成形便采集1g~3g亦可用已湿润的直肠棉拭由肛门插入直肠内3cm~5cm处并轻轻旋转,确保退出的棉拭上有可见的粪便,把棉拭放入灭菌容器中。粪便样本宜在发病早期(发病4d内),服用抗菌药物之前采集给出这一信息是为了方便本标准的使用者,并不表示对该产品的认可和推荐。如果其他等效产品具有相同的1)
效果,则可使用这些等效产品。2
7.1.2呕吐物样本采集
SN/T4462—2016
采集自然呕吐的呕吐物于灭菌容器中,水样呕吐物采集1mL~3mL,非水样呕吐物采集1g~3g。7.1.3水样采集
7.1.3.1直接采集法
用灭菌容器采集水样。饮用水、压舱水用灭菌容器采集500mL样本;江、湖、河、海、塘或井水则采集岸边20cm深度以内的表层水500mL,放于灭菌容器中。采集的水样宜尽快(3h内)送到实验室。不能在3h内送检的,宜在采水点即将50mL10倍浓缩碱性蛋白陈水(见附录A中A.1)加人450mL水样中,混匀。
7.1.3.2纱布块集菌法
用中心系有1m以上线绳的20cm×20cm灭菌脱脂纱布块放在采水点的水中,将线绳固定于岸边物体上,放置过夜(16h~24h),次日将吸着水(约18mL)的纱布块放人灭菌容器中送实验室。7.1.4物体表面样本的采集
用灭菌棉拭蘸以碱性蛋白陈水涂抹可疑部位,置于灭菌容器中。7.2样本保存与运送
7.2.1因霍乱弧菌对低温敏感,样本不需要冷藏保存运送,只须将用于霍乱弧菌检验的样本置于室温运送和保存。实验室收到的样本应按照GB19489要求,一般宜当天做到直接分离或/和增菌后分离。7.2.2不能于当天进行检验的样本,可选择4℃~8℃保存,24h内检验。7.2.3采集的粪便或呕吐物样本不能立即送检时(3h内),宜根据运送时间,选择样本传递保存方式。如运送时间小于8h,将样本放人碱性蛋白陈水中传递。如运送时间大于8h,将样本放人Cary-Blair二氏运送培养基(见附录A中A.2)中传递,带有样本的棉拭宜完全地插入Cary-Blair二氏运送培养基底部。
7.3样本处理
7.3.1水样的处理
取450mL用直接采集法采集的水样,以1mol/L氢氧化钠调pH至8.4~9.2。7.4增菌培养
7.4.1粪便样本的增菌培养
取水样便约1mL或成形便约1g或棉拭样本放入8mL~10mL碱性蛋白陈水中,成形便要磨碎,轻轻摇匀;35℃~37℃培养6h~8h。7.4.2水样的增菌培养
在经pH调节后的用直接采集法采集的450mL水样中,加人10倍浓缩碱性蛋白陈水50mL,为抑制杂菌可再加人1%亚碲酸钾0.25mL~0.5mL和1000U/mL青霉素1mL,35℃~37℃培养16h~24h;对用纱布块集菌法采集的水样,将50mL碱性蛋白陈水加入盛有纱布块样本的灭菌容器中,可再加1%亚碲酸钾0.05mL和1000U/mL青霉素0.15mL,35℃~37℃培养16h~24h。3
SN/T4462—2016
用棉拭涂抹法采集的样本的增菌培养将用棉拭涂抹法采集的样本棉拭,放人8mL~10mL碱性蛋白陈水中,35℃~37℃培养6h8h。7.5
细菌核酸的提取
煮沸裂解法
取1mL增菌液放入1.5mL离心管中,12000r/min离心10min;弃上清液,加人100μLDNA提取液(见附录A中A.3)充分悬浮沉淀,100℃沸水浴10min;冷却至室温,12000r/min离心5min,离心取上清液作为PCR扩增的模板。7.5.2
试剂盒提取纯化核酸法
按适用于细菌基因组提取的商品试剂盒说明书操作,如QIAampDNAminikit试剂盒。7.6阳性对照、阴性对照和空白对照设置检测过程中应按照WS/T230执行,分别设阳性对照、阴性对照和空白对照。阳性对照为分别根据O1群霍乱弧菌目标扩增基因序列、O139群霍乱弧菌目标扩增基因序列及霍乱肠毒素基因(ctxA)目标扩增基因序列经体外化学合成、载体构建的DNA片段,阴性对照为可选择其他种类弧菌的核酸样本,空白对照用无菌水作为荧光PCR反应的模板。多重荧光PCR反应体系组成
具体配制见表2。
样本三重荧光PCR检测反应体系
体积/μL
2XmultiplexPCRmastermix
O1-F(100μmol/L)
O1-R(100μmol/L)
O1-P(50 μmol/L)
O139-F(100μmol/L
O139-R(100μmol/L)
O139-P(50 μmol/L)
ctxA-F(100 μmol/L)
ctxA-R(100 μmol/L)
ctxA-P(50 μmol/L)
去离子水
DNA模板
三重荧光PCR反应
将加好样的PCR反应管分别转移到荧光PCR检测仪上进行扩增反应,程序设置为以ABIPrismSN/T4462—2016
75oofast型全自动荧光定量PCR检测仪为例说明,将荧光信号设置为:ReporterDye:O1群霍乱弧菌为FAM,O139群霍乱弧菌为HEX,霍乱肠毒素为CY5,QuencherDye:BHQ1,Passivereference选择None。荧光PCR扩增程序按照表3中的程序进行设置,反应总体积为25μL。对于其他型号的荧光定量PCR仪应按实际机型进行反应程序设置,没有ROX荧光通道的荧光定量PCR仪,不进行ROX的设置。
扩增及荧光收集
荧光域值的设定
反应温度
样本实时荧光PCR反应程序
PCR反应完成后应设定荧光阈值以分析样品的采集荧光信号
循环数
值。以PCR反应的前3个~15个循环的荧光信号作为基线信号(噪音),Ct值理论上定义为基线信号的标准偏差的1D倍。在实际应用中可以根据仪器基线信号进行人工调整,设定原则是以阅值线刚好超过正常阴性对照样品扩增曲线(无规则的噪音线)的最高点,且不出现Ct值为准。8
检验结果判断及报告
在荧光RT-PCR实验中,若阳性对照有明显的荧光增幅现象,且Ct值在预期的范围之内(≤32);阴性对照和空白对照无荧光增幅现象,则表明反应体系运行行正常,可以进行结果判定;否则,实验视为无效,需重新实验。
当同时进行的阳性、阴性和空白对照实验结果正常,本方法检验结果判定如下:时,判为阳性。
检测样品有明显的荧光增幅曲线,值≤35
检测样品荧光增幅曲线的
Ct值介于35和40
新进行实时荧光PCR检测。
期,判为阳性,否则判为阴性。若重新检测的
之间时,
,建议采用浓缩方式处理核酸样本,再重值有明显减少
此类样本建议用其他大
方法进
检测样品无荧光增幅现象,判为阴性结果报告模式见表4。
反应液
01群霍乱
O139群霍乱
霍乱肠毒素
结果报告
模式1
霍乱弧菌
核酸阴性
模式2
结果报告模式
模式3
01群霍乱弧菌
核酸阳性,且
含有毒素基因
O139群霍乱弧
菌核酸阳性,且
含有毒素基因
趋势,且曲线有明显的对数增长步验证。
模式4
O1群霍乱弧菌
核酸阳性
模式5
0139群霍乱弧菌
核酸阳性
SN/T4462—2016
碱性蛋白陈水
成分如下:
蛋白陈:10.0g;
氯化钠:10.0g;
蒸馏水:1000mL。
附录A
(规范性附录)
培养基和试剂
将上述各成分加热搅拌溶解,调至pH至8.4~8.8,分装,每支试管8mL~10mL或每瓶225mL,121℃高压灭菌20min(10倍碱性蛋白陈水的蛋白陈和氯化钠量增加10倍)。也可用市场上销售的碱性蛋白陈水A.2
Cary-Blair二氏运送培养基(C-B半固体保存培养基)A.2.1成分
成分如下:
硫乙醇酸钠:1.5g;免费标准bzxz.net
磷酸氢二钠:1.1g;
氯化钠:5.0g;
琼脂:5.0g;
蒸馏水:1000mL;
1%氯化钙溶液:9mL。
除1%氯化钙溶液外,其他按上述成分配制,加热溶解,待冷至50℃时,加人1%氯化钙溶液9mL,调pH至8.4,分装试管,每支8mL10mL。121℃高压灭菌15min。A.3
DNA提取液
A.3.1成分
成分如下:
Tris·HCl:20mmol/L;
KCI:10ommol/L;
EDTA:2.5mmol/L;
NP-40:1%;
PEG800:20%;
纯化水。
按上述成分的终浓度进行称量配制,加热溶解,并调pH至8.9,分装,SN/T4462—2016
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。