SN/T 4799-2017
基本信息
标准号: SN/T 4799-2017
中文名称:动物结核病病原菌检测方法变性高效液相色谱法
标准类别:商检行业标准(SN)
标准状态:现行
出版语种:简体中文
下载格式:.zip .pdf
下载大小:3723198
相关标签: 动物 结核病 病原菌 检测 方法 变性 高效 色谱法

标准分类号
关联标准
出版信息
相关单位信息
标准简介
SN/T 4799-2017.Detection of tuberculosis pathogenic organisms of animals-DHPLC method.
1范围
SN/T 4799规定了结核分枝杆菌复合群、结核分枝杆菌、牛分枝杆菌多重PCR联合变性高效液相色谱(mPCR-DHPLC)检测方法的技术要求和操作规范。
SN/T 4799适用于快速检测细菌培养物、动物组织、血样、痰液等临床样品中结核分枝杆菌复合群、结核分枝杆菌、牛分枝杆菌。
2规范性引用文件.
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB 19489实验室生物安 全通用要求
3缩略语
下列缩略语适用于本文件。
DHPLC:变性高效液相色谱(denaturing high-performance liquid chromatography)。
dNTP:脱氧核苷三磷酸( deoxyribonuclesosde triphosphate)。
PBS:磷酸盐缓冲液( phosphate buffer solution)。
mPCR:多重聚合酶链式反应( multiplex polymerase chain reaction)。
TEAA:三乙基铵醋酸盐。
1范围
SN/T 4799规定了结核分枝杆菌复合群、结核分枝杆菌、牛分枝杆菌多重PCR联合变性高效液相色谱(mPCR-DHPLC)检测方法的技术要求和操作规范。
SN/T 4799适用于快速检测细菌培养物、动物组织、血样、痰液等临床样品中结核分枝杆菌复合群、结核分枝杆菌、牛分枝杆菌。
2规范性引用文件.
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB 19489实验室生物安 全通用要求
3缩略语
下列缩略语适用于本文件。
DHPLC:变性高效液相色谱(denaturing high-performance liquid chromatography)。
dNTP:脱氧核苷三磷酸( deoxyribonuclesosde triphosphate)。
PBS:磷酸盐缓冲液( phosphate buffer solution)。
mPCR:多重聚合酶链式反应( multiplex polymerase chain reaction)。
TEAA:三乙基铵醋酸盐。
标准图片预览




标准内容
中华人民共和国出入境检验检疫行业标准SN/T4799—2017
动物结核病病原菌检测方法
变性高效液相色谱法
Detection of tuberculosis pathogenic organisms of animals-DHPLCmethod
2017-07-21发布
中华人民共和国
国家质量监督检验检疫总局
2018-03-01实施
中华人民共和国出入境检验检疫行业标准
动物结核病病原菌检测方法
变性高效液相色谱法
SN/T4799—2017
中国标准出版社出版
北京市朝阳区和平里西街甲2号(100029)北京市西城区三里河北街16号(100045)总编室:(010)68533533
网址spc.net.cn
中国标准出版社秦皇岛印刷厂印刷*
开本880×1230
2018年6月第
第一版
印张0.75
字数18千字
2018年6月第一次印刷
印数1-500
书号:155066·2-33414
定价16.00
本标准按照GB/T1.1一2009给出的规则起草。本标准由国家认证认可监督管理委员会提出并归口。本标准起草单位:中华人民共和国广东出人境检验检疫局。本标准主要起草人:刘志玲、陈茹、王莹、吴晓薇、朱道中、段燕喻、林志雄。SN/T4799—2017
1范围
动物结核病病原菌检测方法
变性高效液相色谱法
SN/T4799—2017
本标准规定了结核分枝杆菌复合群、结核分枝杆菌、牛分枝杆菌多重PCR联合变性高效液相色谱(mPCR-DHPLC)检测方法的技术要求和操作规范本标准适用于快速检测细菌培养物、动物组织、血样、痰液等临床样品中结核分枝杆菌复合群、结核分枝杆菌、牛分枝杆菌。
规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB19489实验室生物安全通用要求3缩略语
下列缩略语适用于本文件。
DHPLC:变性高效液相色谱(denaturinghigh-performanceliquidchromatography)。dNTP:脱氧核苷三磷酸(deoxyribonuclesosdetriphosphate)。PBS:磷酸盐缓冲液(phosphatebuffersolution)。mPCR:多重聚合酶链式反应(multiplex-polymerasechainreaction)。TEAA:三乙基铵醋酸盐。
4概述
人与动物结核病涉及多种病原菌或病原菌复合群。结核分枝杆菌复合群(Mycobacteriumtuberculosiscomplex,MTC)是感染人与哺乳动物的结核病原菌,包括结核分枝杆菌和牛分枝杆菌、非洲分枝杆菌和田鼠分枝杆菌。其中,主要感染人与家畜并致病的是结核分枝杆菌和牛分枝杆菌。与MTC相对应的是种类繁多的各种非结核分枝杆菌(NTM)。NTM感染患者的临床症状及病理变化与MTC引起的结核病极为相似,但多数NTM对抗结核药物有天然耐药性。此外,NTM感染可造成结核菌素皮内变态反应或血清学检测假阳性。采用多重PCR联合变性高效液相色谱检测的方法可同步区分结核分枝杆菌复合群与非结核分枝杆菌复核群,并鉴别结核分枝杆菌与牛分枝杆菌mPCR反应的原理、操作过程与普通PCR相同。在同一PCR反应体系里加入多对特异性引物,对多个DNA模板或同一模版不同区域扩增出多个目的DNA片段。DHPLC分析技术是利用液相色谱技术,在高压闭合液相流路中,将DNA样品自动注人并在缓冲液携带下流过DNA分离柱,DNA片段分子中带负电荷的磷酸根基团与TEAA分子中带正电荷的氨基发生静电作用相互吸引,同时TEAA分子中的三个乙基与固定相C18表面的烷基发生疏水作用力而相互吸引,通过流动相中的乙腈的梯度洗脱将不同大小的DNA片段分离。由紫外或荧光检测被分离的DNA样品。根据DNA扩增片段长1
SN/T4799—2017
度大小,不同分子量的特异扩增产物在特定位置呈现吸收峰,从而对结核分枝杆菌复合群、结核分枝杆菌和牛分枝杆菌进行快速检测。5材料与试剂
仪器与耗材
变性高效液相色谱分析仪。
核酸扩增仪。
ⅡI级生物安全柜。
接种棒。
恒温水浴锅(室温至100℃bZxz.net
离心机。
微量可调移液器和灭菌吸头:10μL、100μL、200μL、1000μL。天平。
PCR光学反应管。
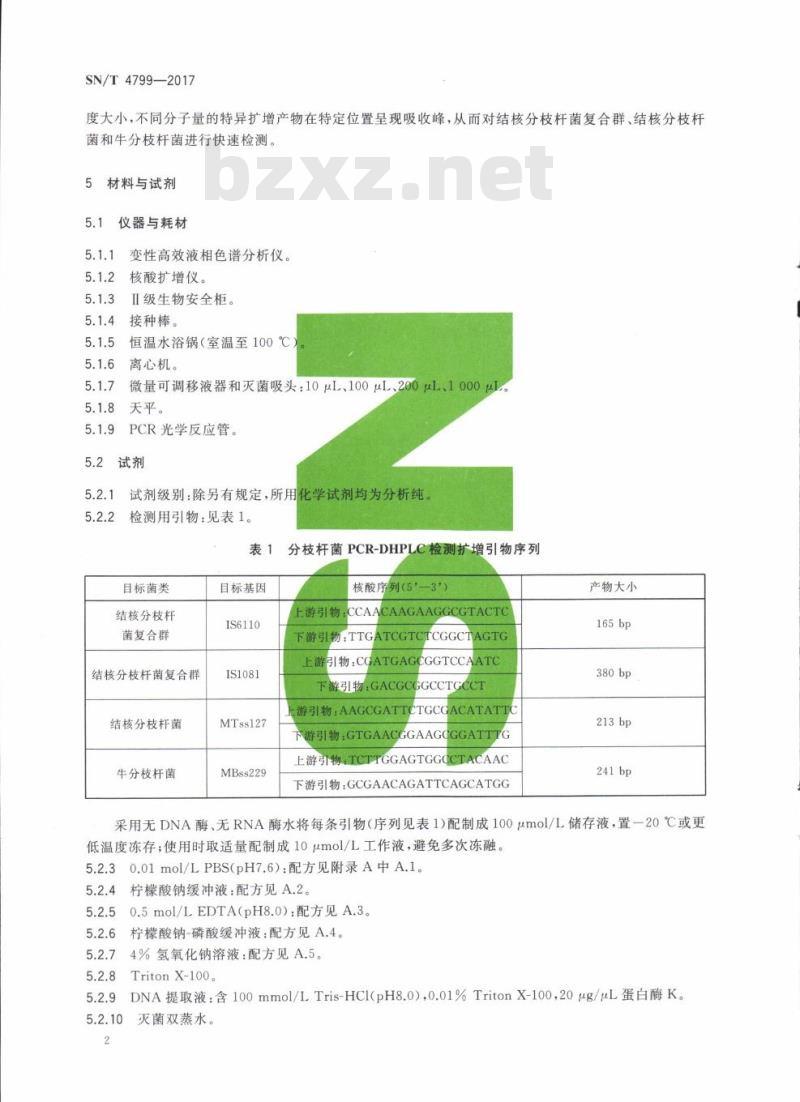
试剂级别:除另有规定,所用化学试剂均为分析纯。检测用引物:见表1。
表1分枝杆菌PCR-DHPLC检测扩增引物序列目标菌类
结核分枝杆
菌复合群
结核分枝杆菌复合群
结核分枝杆菌
牛分枝杆菌
目标基因
IS6110
IS1081
MTss127
MBss229
核酸序列(5—3')
上游引物:CCAACAAGAAGGCGTACTC下游引物:TTGATCGTCTCGGCTAGTG引物:CGATGAGCGGTCCAATC
游引物:GACGCGGCCTG
游引物:AAGCGATTCTGCGACATATTC下游引物:GTGAACGGAAGCGGATTTG上游引物:TCTTGGAGTGGCCTACAAC下游引物:GCGAACAGATTCAGCATGG产物大小
采用无DNA酶、无RNA酶水将每条引物(序列见表1)配制成100μmol/L储存液,置一20℃或更低温度冻存;使用时取适量配制成10μmol/L工作液,避免多次冻融。5.2.30.01mol/LPBS(pH7.6):配方见附录A中A.1。5.2.4
柠檬酸钠缓冲液:配方见A.2。
0.5mol/LEDTA(pH8.0):配方见A.3。柠檬酸钠-磷酸缓冲液:配方见A.4。4%氢氧化钠溶液:配方见A.5。
TritonX-100。
DNA提取液:含100mmol/LTris-HCl(pH8.0),0.01%TritonX-100,20μg/μL蛋白酶K。5.2.10
灭菌双蒸水。
三氯甲烷。
5.2.12dNTPs:dATPdTTP、dCTP和dGTP。5.2.13
TagDNA聚合酶。
DHPLC缓冲液:配方见A.6。
6生物安全要求
采样、样品处理及检测过程所涉及的实验操作,应遵守GB19489的有关规定。7样品采集与前处理
7.1培养物
SN/T4799—2017
直接取液体培养基培养的菌液;对于在固体培养基上生长的菌落,用接种棒挑取适量(取用量达到肉眼可见,菌团大小不超过接种环)菌样,放到1mL0.01mol/LpH7.6PBS中,振荡混匀形成悬浮菌液。
取1mL菌液样品,15000×g离心10min,弃上清,加1mL0.01mol/LpH7.6PBS,充分振荡混匀,15000×g离心10min;弃上清,收集沉淀物,按8.1进行核酸提取,或置一20℃贮存备用。7.2全血、血清
用无菌注射器或真空采血管,无菌自动物静脉采血。将血液直接滴入抗凝剂中,并立即连续摇动,充分混合。抗凝剂采用柠檬酸钠缓冲液,或0.5mol/LEDTA。每6mL血液加1mL抗凝剂。条件允许时,建议优先采集全血,以更有利于富集菌体。5000xg
取1mL~2mL全血样品,15
10min,弃上清;加等体积灭菌双蒸水充分振荡,离心
15000×g离心10min;弃上清,若红血球裂解不完全,需采用灭菌双蒸水重复洗涤;收集沉淀物,按8.1进行核酸提取,或置一20℃贮存备用。血清样品处理方法同7.1。
7.3痰液
动物痰液采集:动物咯痰极少,宜在清晨采集,用橡胶管自口腔伸人至气管内,外接注射器吸取痰液。亦可取咳出的痰块。
在痰液样品中加人2~4倍体积4%氢氧化钠溶液,振荡混匀,室温放置30min,间或振荡混匀,使其充分液化(无明显固状物并且吸出时无拖丝现象即为液化完全;若液化不完全,可适当再加人少量4%氢氧化钠溶液直至液化完全);15000X×g离心10min;弃上清,加1mL0.01mol/LpH7.6PBS,充分振荡混匀,15000×g离心10min,弃上清,重复本步骤1次;收集沉淀物,按8.1进行核酸提取,或置一20℃贮存备用。
7.4组织器官
采集动物下颌、咽后、支气管、肺(特别是肺门及肺门淋巴结)、纵隔和肠系膜淋巴结,以及病变组织器官如肝、脾、肺等。
取适量组织样品(剔除脂肪、被膜),剪碎,按1:5的比例加人柠檬酸钠-磷酸缓冲液(例,1g组织样品,加入5mL缓冲液),充分研磨;加等量4%氢氧化钠溶液,继续研磨5min~10min,使组织液化;移人离心管,充分振荡,75℃水浴0.5h~1h;取上清(避免吸取粗渣),15000×g离心10min;弃上清,加等量0.01mol/LpH7.6PBS,振荡混匀,使沉淀充分悬浮,15000×g离心10min,弃上清,重复本步3
SN/T4799—2017
骤1次;收集沉淀物,按8.1进行核酸提取,或置一20℃贮存备用。注:可采用其他经验证有效的样品处理方法。8操作方法
核酸提取
在上述已完成前处理的样品(沉淀物)中加人50μL~100μLDNA提取液,充分振荡混匀,56℃水浴30min,98℃~100℃加热10min,瞬时离心使液滴聚集管底,加等体积三氯甲烷,振荡混匀,12000×g离心5min,取上清,直接用于PCR或贮存于-80℃备用。注:可采用经验证的商品化核酸提取试剂盒或其他经验证有效的核酸提取纯化方法。8.2mPCR扩增
采用50μL反应体系,反应液中含dNTPs0.2mmol/L,IS6110、IS1081、MTss127、MBss229上下游引物每条各0.2μmmol/L,Mg2+1.0mmol/L,1unitTaq酶,模版DNA5μL。扩增循环条件为:94℃预变性2min;94℃变性15s,62℃退火15s,68℃延伸15s,进行40个循环;72℃延伸1min。8.3DHPLC分析
将装有PCR产物的反应管放置在DHPLC金属板的微孔中。登录DHPLC分析系统,在非变性分析条件下,采用双链DNA多片段(double-strandedmultiplefragment)分析模式,设定方法分析10obp~430bp片段;清洗模式采用active;清洗持续时间0.5min,平衡持续时间0.9min;流速0.9mL/min。温度设定50℃;样品进样量设为5μL~10μL,同一组分析采用同样的进样量。分析速度为每100bp需2.5min,每个样品约13.4min。分析过程流动相梯度参数由Navigatorsoftware分析软件控制设定,具体参数见表2。
质控对照设置
检测过程中应分别设阳性对照和阴性对照。阳性对照为结核分枝杆菌、牛分枝杆菌菌株DNA或扩增片段的阳性克隆质粒DNA,阴性对照为非目标致病菌DNA或双蒸水。表2
梯度名称
清洗开始
清洗结束
平衡开始
平衡结束
时间/min
DHPLC流动相参数
A液百分率
B液百分率
9结果及判定
质控标准(参考附录B)
9.1.1阴性对照:无特异吸收峰出现。SN/T4799—2017
9.1.2阳性对照:结核分枝杆菌菌株DNA可扩增出结核分枝杆菌复合群IS6110目标基因165bp片段、IS1081目标基因380bp片段及结核分枝杆菌MTss127目标基因213bp片段的产物;牛分枝杆菌菌株DNA可扩增出结核分枝杆菌复合群IS6110目标基因165bp片段、IS1081目标基因380bp片段及牛分枝杆菌MBss229目标基因241bp片段的产物。DHPLC分析出现相应片段大小的PCR产物吸收峰,且峰吸收值大于2mV。
9.1.3不符合上述对照质控标准的视为无效。9.2检测结果判定
9.2.1阴性:检测样品无典型PCR产物阳性吸收峰出现,可判定为结核分枝杆菌复合群、结核分枝杆菌、牛分枝杆菌阴性
9.2.2结核分枝杆菌复合群阳性:检测样品出现165bp和/或380bp典型的PCR产物阳性吸收峰,且吸收峰值大于2mV时,可判定该样品结果为结核分枝杆菌复合群阳性。9.2.3结核分枝杆菌阳性:检测样品出现213bp典型的PCR产物阳性吸收峰,且吸收峰值大于2mV时,可判定该样品结果为结核分枝杆菌阳性。结核分枝杆菌阳性同时还应出现165bp和/或380bp产物吸收峰,但也可能由于样品模板浓度或具体反应效果等原因不出现,这些情况不影响判定。9.2.4牛分枝杆菌阳性:检测样品出现241bp典型的PCR产物阳性吸收峰,且吸收峰值大于2mV时,可判定该样品结果为牛分枝杆菌阳性。牛分枝杆菌阳性同时还应出现165bp和/或380bp产物吸收峰,但也可能由于样品模板浓度或具体反应效果等原因不出现,这些情况不影响判定。5可疑结果:检测样品出现典型的PCR产物阳性吸收峰,但吸收峰值小于2mV时,建议对样品重9.2.5
做。重做结果峰吸收值仍小于2mV则判为阴性,否则判为可疑,应重新采集样品进行检测。5
SN/T4799—2017
A.10.01mol/LPBS(pH7.6)
先配制A液、B液
附录A
(规范性附录)
试剂的配制
A液(0.2mol/LNaHPO.溶液):称取一水合磷酸二氢钠(NaH,PO,·H,O)27.6g,或二水合磷酸二氢钠(NaH,PO。·2H2O)31.2g,溶于蒸馏水中,定容至1L。溶液):称取十二水合磷酸氢二钠(Na2HPO·12H,O)71.6g,或二水B液(0.2mol/LNa,HPO4
合磷酸氢二钠(NazHPO4·2H2O)35.6g,溶于蒸馏水中,定容至1L称取17g氯化钠,用适量蒸馏水溶解,量取13mLA液和87mLB液,混合,用蒸馏水定容至2L。A.2柠檬酸钠缓冲液
柠檬酸(CH.O,·H,O)
柠檬酸钠(Na:CgHO,·HzO)15g16.2g
葡萄糖(C,Hi2O·H,O)
称取上述试剂,溶解于蒸馏水,定容至1L,混匀。采用(121±2)℃/0.1MPa,15min高压灭菌后贮存于4℃。
A.30.5mol/LEDTA(pH8.0)
称取186.1gEDTA,加人800mL蒸馏水中,磁力搅拌器上剧烈搅拌,用氢氧化钠(NaOH)调pH至8.0,定容至1L,分装,采用(121±2)℃/0.1MPa,15min高压灭菌后贮存于4℃。A.4柠檬酸钠-磷酸缓冲液
先配制pH6.8磷酸缓冲液。
A液(0.2mol/L磷酸二氢钠溶液):称取磷酸二氢钠(NaH,PO4·2H,O)15.61g,加双蒸水溶解,定容至500mL。
B液(0.2mol/L磷酸氢二钠溶液):称取磷酸氢二钠(Na2HPO,·12H2O)35.82g,加双蒸水溶解,定容至500mL。
分别量取51mLA液、49mLB液,混合即成100mLpH6.8磷酸缓冲液。称取2.84g柠檬酸钠(NasCH,O,·2HO),加人100mLpH6.8磷酸缓冲液中,充分溶解。采用(121士2)℃/0.1MPa,15min高压灭菌后贮存于4℃。A.54%氢氧化钠溶液
称取8g氢氧化钠,加人200mL双蒸水,充分溶解。室温贮存。6
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
动物结核病病原菌检测方法
变性高效液相色谱法
Detection of tuberculosis pathogenic organisms of animals-DHPLCmethod
2017-07-21发布
中华人民共和国
国家质量监督检验检疫总局
2018-03-01实施
中华人民共和国出入境检验检疫行业标准
动物结核病病原菌检测方法
变性高效液相色谱法
SN/T4799—2017
中国标准出版社出版
北京市朝阳区和平里西街甲2号(100029)北京市西城区三里河北街16号(100045)总编室:(010)68533533
网址spc.net.cn
中国标准出版社秦皇岛印刷厂印刷*
开本880×1230
2018年6月第
第一版
印张0.75
字数18千字
2018年6月第一次印刷
印数1-500
书号:155066·2-33414
定价16.00
本标准按照GB/T1.1一2009给出的规则起草。本标准由国家认证认可监督管理委员会提出并归口。本标准起草单位:中华人民共和国广东出人境检验检疫局。本标准主要起草人:刘志玲、陈茹、王莹、吴晓薇、朱道中、段燕喻、林志雄。SN/T4799—2017
1范围
动物结核病病原菌检测方法
变性高效液相色谱法
SN/T4799—2017
本标准规定了结核分枝杆菌复合群、结核分枝杆菌、牛分枝杆菌多重PCR联合变性高效液相色谱(mPCR-DHPLC)检测方法的技术要求和操作规范本标准适用于快速检测细菌培养物、动物组织、血样、痰液等临床样品中结核分枝杆菌复合群、结核分枝杆菌、牛分枝杆菌。
规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB19489实验室生物安全通用要求3缩略语
下列缩略语适用于本文件。
DHPLC:变性高效液相色谱(denaturinghigh-performanceliquidchromatography)。dNTP:脱氧核苷三磷酸(deoxyribonuclesosdetriphosphate)。PBS:磷酸盐缓冲液(phosphatebuffersolution)。mPCR:多重聚合酶链式反应(multiplex-polymerasechainreaction)。TEAA:三乙基铵醋酸盐。
4概述
人与动物结核病涉及多种病原菌或病原菌复合群。结核分枝杆菌复合群(Mycobacteriumtuberculosiscomplex,MTC)是感染人与哺乳动物的结核病原菌,包括结核分枝杆菌和牛分枝杆菌、非洲分枝杆菌和田鼠分枝杆菌。其中,主要感染人与家畜并致病的是结核分枝杆菌和牛分枝杆菌。与MTC相对应的是种类繁多的各种非结核分枝杆菌(NTM)。NTM感染患者的临床症状及病理变化与MTC引起的结核病极为相似,但多数NTM对抗结核药物有天然耐药性。此外,NTM感染可造成结核菌素皮内变态反应或血清学检测假阳性。采用多重PCR联合变性高效液相色谱检测的方法可同步区分结核分枝杆菌复合群与非结核分枝杆菌复核群,并鉴别结核分枝杆菌与牛分枝杆菌mPCR反应的原理、操作过程与普通PCR相同。在同一PCR反应体系里加入多对特异性引物,对多个DNA模板或同一模版不同区域扩增出多个目的DNA片段。DHPLC分析技术是利用液相色谱技术,在高压闭合液相流路中,将DNA样品自动注人并在缓冲液携带下流过DNA分离柱,DNA片段分子中带负电荷的磷酸根基团与TEAA分子中带正电荷的氨基发生静电作用相互吸引,同时TEAA分子中的三个乙基与固定相C18表面的烷基发生疏水作用力而相互吸引,通过流动相中的乙腈的梯度洗脱将不同大小的DNA片段分离。由紫外或荧光检测被分离的DNA样品。根据DNA扩增片段长1
SN/T4799—2017
度大小,不同分子量的特异扩增产物在特定位置呈现吸收峰,从而对结核分枝杆菌复合群、结核分枝杆菌和牛分枝杆菌进行快速检测。5材料与试剂
仪器与耗材
变性高效液相色谱分析仪。
核酸扩增仪。
ⅡI级生物安全柜。
接种棒。
恒温水浴锅(室温至100℃bZxz.net
离心机。
微量可调移液器和灭菌吸头:10μL、100μL、200μL、1000μL。天平。
PCR光学反应管。
试剂级别:除另有规定,所用化学试剂均为分析纯。检测用引物:见表1。
表1分枝杆菌PCR-DHPLC检测扩增引物序列目标菌类
结核分枝杆
菌复合群
结核分枝杆菌复合群
结核分枝杆菌
牛分枝杆菌
目标基因
IS6110
IS1081
MTss127
MBss229
核酸序列(5—3')
上游引物:CCAACAAGAAGGCGTACTC下游引物:TTGATCGTCTCGGCTAGTG引物:CGATGAGCGGTCCAATC
游引物:GACGCGGCCTG
游引物:AAGCGATTCTGCGACATATTC下游引物:GTGAACGGAAGCGGATTTG上游引物:TCTTGGAGTGGCCTACAAC下游引物:GCGAACAGATTCAGCATGG产物大小
采用无DNA酶、无RNA酶水将每条引物(序列见表1)配制成100μmol/L储存液,置一20℃或更低温度冻存;使用时取适量配制成10μmol/L工作液,避免多次冻融。5.2.30.01mol/LPBS(pH7.6):配方见附录A中A.1。5.2.4
柠檬酸钠缓冲液:配方见A.2。
0.5mol/LEDTA(pH8.0):配方见A.3。柠檬酸钠-磷酸缓冲液:配方见A.4。4%氢氧化钠溶液:配方见A.5。
TritonX-100。
DNA提取液:含100mmol/LTris-HCl(pH8.0),0.01%TritonX-100,20μg/μL蛋白酶K。5.2.10
灭菌双蒸水。
三氯甲烷。
5.2.12dNTPs:dATPdTTP、dCTP和dGTP。5.2.13
TagDNA聚合酶。
DHPLC缓冲液:配方见A.6。
6生物安全要求
采样、样品处理及检测过程所涉及的实验操作,应遵守GB19489的有关规定。7样品采集与前处理
7.1培养物
SN/T4799—2017
直接取液体培养基培养的菌液;对于在固体培养基上生长的菌落,用接种棒挑取适量(取用量达到肉眼可见,菌团大小不超过接种环)菌样,放到1mL0.01mol/LpH7.6PBS中,振荡混匀形成悬浮菌液。
取1mL菌液样品,15000×g离心10min,弃上清,加1mL0.01mol/LpH7.6PBS,充分振荡混匀,15000×g离心10min;弃上清,收集沉淀物,按8.1进行核酸提取,或置一20℃贮存备用。7.2全血、血清
用无菌注射器或真空采血管,无菌自动物静脉采血。将血液直接滴入抗凝剂中,并立即连续摇动,充分混合。抗凝剂采用柠檬酸钠缓冲液,或0.5mol/LEDTA。每6mL血液加1mL抗凝剂。条件允许时,建议优先采集全血,以更有利于富集菌体。5000xg
取1mL~2mL全血样品,15
10min,弃上清;加等体积灭菌双蒸水充分振荡,离心
15000×g离心10min;弃上清,若红血球裂解不完全,需采用灭菌双蒸水重复洗涤;收集沉淀物,按8.1进行核酸提取,或置一20℃贮存备用。血清样品处理方法同7.1。
7.3痰液
动物痰液采集:动物咯痰极少,宜在清晨采集,用橡胶管自口腔伸人至气管内,外接注射器吸取痰液。亦可取咳出的痰块。
在痰液样品中加人2~4倍体积4%氢氧化钠溶液,振荡混匀,室温放置30min,间或振荡混匀,使其充分液化(无明显固状物并且吸出时无拖丝现象即为液化完全;若液化不完全,可适当再加人少量4%氢氧化钠溶液直至液化完全);15000X×g离心10min;弃上清,加1mL0.01mol/LpH7.6PBS,充分振荡混匀,15000×g离心10min,弃上清,重复本步骤1次;收集沉淀物,按8.1进行核酸提取,或置一20℃贮存备用。
7.4组织器官
采集动物下颌、咽后、支气管、肺(特别是肺门及肺门淋巴结)、纵隔和肠系膜淋巴结,以及病变组织器官如肝、脾、肺等。
取适量组织样品(剔除脂肪、被膜),剪碎,按1:5的比例加人柠檬酸钠-磷酸缓冲液(例,1g组织样品,加入5mL缓冲液),充分研磨;加等量4%氢氧化钠溶液,继续研磨5min~10min,使组织液化;移人离心管,充分振荡,75℃水浴0.5h~1h;取上清(避免吸取粗渣),15000×g离心10min;弃上清,加等量0.01mol/LpH7.6PBS,振荡混匀,使沉淀充分悬浮,15000×g离心10min,弃上清,重复本步3
SN/T4799—2017
骤1次;收集沉淀物,按8.1进行核酸提取,或置一20℃贮存备用。注:可采用其他经验证有效的样品处理方法。8操作方法
核酸提取
在上述已完成前处理的样品(沉淀物)中加人50μL~100μLDNA提取液,充分振荡混匀,56℃水浴30min,98℃~100℃加热10min,瞬时离心使液滴聚集管底,加等体积三氯甲烷,振荡混匀,12000×g离心5min,取上清,直接用于PCR或贮存于-80℃备用。注:可采用经验证的商品化核酸提取试剂盒或其他经验证有效的核酸提取纯化方法。8.2mPCR扩增
采用50μL反应体系,反应液中含dNTPs0.2mmol/L,IS6110、IS1081、MTss127、MBss229上下游引物每条各0.2μmmol/L,Mg2+1.0mmol/L,1unitTaq酶,模版DNA5μL。扩增循环条件为:94℃预变性2min;94℃变性15s,62℃退火15s,68℃延伸15s,进行40个循环;72℃延伸1min。8.3DHPLC分析
将装有PCR产物的反应管放置在DHPLC金属板的微孔中。登录DHPLC分析系统,在非变性分析条件下,采用双链DNA多片段(double-strandedmultiplefragment)分析模式,设定方法分析10obp~430bp片段;清洗模式采用active;清洗持续时间0.5min,平衡持续时间0.9min;流速0.9mL/min。温度设定50℃;样品进样量设为5μL~10μL,同一组分析采用同样的进样量。分析速度为每100bp需2.5min,每个样品约13.4min。分析过程流动相梯度参数由Navigatorsoftware分析软件控制设定,具体参数见表2。
质控对照设置
检测过程中应分别设阳性对照和阴性对照。阳性对照为结核分枝杆菌、牛分枝杆菌菌株DNA或扩增片段的阳性克隆质粒DNA,阴性对照为非目标致病菌DNA或双蒸水。表2
梯度名称
清洗开始
清洗结束
平衡开始
平衡结束
时间/min
DHPLC流动相参数
A液百分率
B液百分率
9结果及判定
质控标准(参考附录B)
9.1.1阴性对照:无特异吸收峰出现。SN/T4799—2017
9.1.2阳性对照:结核分枝杆菌菌株DNA可扩增出结核分枝杆菌复合群IS6110目标基因165bp片段、IS1081目标基因380bp片段及结核分枝杆菌MTss127目标基因213bp片段的产物;牛分枝杆菌菌株DNA可扩增出结核分枝杆菌复合群IS6110目标基因165bp片段、IS1081目标基因380bp片段及牛分枝杆菌MBss229目标基因241bp片段的产物。DHPLC分析出现相应片段大小的PCR产物吸收峰,且峰吸收值大于2mV。
9.1.3不符合上述对照质控标准的视为无效。9.2检测结果判定
9.2.1阴性:检测样品无典型PCR产物阳性吸收峰出现,可判定为结核分枝杆菌复合群、结核分枝杆菌、牛分枝杆菌阴性
9.2.2结核分枝杆菌复合群阳性:检测样品出现165bp和/或380bp典型的PCR产物阳性吸收峰,且吸收峰值大于2mV时,可判定该样品结果为结核分枝杆菌复合群阳性。9.2.3结核分枝杆菌阳性:检测样品出现213bp典型的PCR产物阳性吸收峰,且吸收峰值大于2mV时,可判定该样品结果为结核分枝杆菌阳性。结核分枝杆菌阳性同时还应出现165bp和/或380bp产物吸收峰,但也可能由于样品模板浓度或具体反应效果等原因不出现,这些情况不影响判定。9.2.4牛分枝杆菌阳性:检测样品出现241bp典型的PCR产物阳性吸收峰,且吸收峰值大于2mV时,可判定该样品结果为牛分枝杆菌阳性。牛分枝杆菌阳性同时还应出现165bp和/或380bp产物吸收峰,但也可能由于样品模板浓度或具体反应效果等原因不出现,这些情况不影响判定。5可疑结果:检测样品出现典型的PCR产物阳性吸收峰,但吸收峰值小于2mV时,建议对样品重9.2.5
做。重做结果峰吸收值仍小于2mV则判为阴性,否则判为可疑,应重新采集样品进行检测。5
SN/T4799—2017
A.10.01mol/LPBS(pH7.6)
先配制A液、B液
附录A
(规范性附录)
试剂的配制
A液(0.2mol/LNaHPO.溶液):称取一水合磷酸二氢钠(NaH,PO,·H,O)27.6g,或二水合磷酸二氢钠(NaH,PO。·2H2O)31.2g,溶于蒸馏水中,定容至1L。溶液):称取十二水合磷酸氢二钠(Na2HPO·12H,O)71.6g,或二水B液(0.2mol/LNa,HPO4
合磷酸氢二钠(NazHPO4·2H2O)35.6g,溶于蒸馏水中,定容至1L称取17g氯化钠,用适量蒸馏水溶解,量取13mLA液和87mLB液,混合,用蒸馏水定容至2L。A.2柠檬酸钠缓冲液
柠檬酸(CH.O,·H,O)
柠檬酸钠(Na:CgHO,·HzO)15g16.2g
葡萄糖(C,Hi2O·H,O)
称取上述试剂,溶解于蒸馏水,定容至1L,混匀。采用(121±2)℃/0.1MPa,15min高压灭菌后贮存于4℃。
A.30.5mol/LEDTA(pH8.0)
称取186.1gEDTA,加人800mL蒸馏水中,磁力搅拌器上剧烈搅拌,用氢氧化钠(NaOH)调pH至8.0,定容至1L,分装,采用(121±2)℃/0.1MPa,15min高压灭菌后贮存于4℃。A.4柠檬酸钠-磷酸缓冲液
先配制pH6.8磷酸缓冲液。
A液(0.2mol/L磷酸二氢钠溶液):称取磷酸二氢钠(NaH,PO4·2H,O)15.61g,加双蒸水溶解,定容至500mL。
B液(0.2mol/L磷酸氢二钠溶液):称取磷酸氢二钠(Na2HPO,·12H2O)35.82g,加双蒸水溶解,定容至500mL。
分别量取51mLA液、49mLB液,混合即成100mLpH6.8磷酸缓冲液。称取2.84g柠檬酸钠(NasCH,O,·2HO),加人100mLpH6.8磷酸缓冲液中,充分溶解。采用(121士2)℃/0.1MPa,15min高压灭菌后贮存于4℃。A.54%氢氧化钠溶液
称取8g氢氧化钠,加人200mL双蒸水,充分溶解。室温贮存。6
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。