SN/T 4848.6-2017
基本信息
标准号: SN/T 4848.6-2017
中文名称:出口蜂蜜中常见蜜源植物成分的检测方法实时荧光PCR法第6部分:龙眼
标准类别:商检行业标准(SN)
标准状态:现行
出版语种:简体中文
下载格式:.zip .pdf
下载大小:2725568
相关标签: 出口 蜂蜜 常见 蜜源 植物 成分 检测 方法 实时 荧光 PCR 龙眼

标准分类号
关联标准
出版信息
相关单位信息
标准简介
SN/T 4848.6-2017.Identification of common honey plant species in export honey-Real-time PCR method-Part 6: Longan.
1范围
SN/T 4848.6规定了出口蜂蜜中龙眼成分的实时荧光PCR检测方法。
SN/T 4848.6适用于出口蜂蜜中龙眼成分的定性检测。本部分所规定方法的最低检出限(LOD)为0.5%(质量百分比)。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T6682分析实验室用水规格和试验方法
GB 14963-2011食品安全国家标准 蜂蜜
GB/T 27403-2008实验室质量控制规范食 品分子生物学检测
3术语和定义
下列术语和定义适用于本文件。
3.1蜂蜜honey
蜜蜂采集植物的花蜜、分泌物或蜜露,与自身分必物混合后,经充分酿造而成的天然甜物质。
3.2龙眼longan
龙眼(Dimocarpus longan Lour.)又名圆酿、桂圆、羊眼果树,无患子科、龙眼属植物。
3.3实时荧光PCR real time PCR
在PCR反应体系中加入荧光基团,利用荧光信号的积累实时监控整个PCR扩增过程,实现对起始模板的定量及定性分析。
3.4Ct值cycle threshold
每个反应管内的荧光信号到达设定的域值时所经历的循环数。
1范围
SN/T 4848.6规定了出口蜂蜜中龙眼成分的实时荧光PCR检测方法。
SN/T 4848.6适用于出口蜂蜜中龙眼成分的定性检测。本部分所规定方法的最低检出限(LOD)为0.5%(质量百分比)。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T6682分析实验室用水规格和试验方法
GB 14963-2011食品安全国家标准 蜂蜜
GB/T 27403-2008实验室质量控制规范食 品分子生物学检测
3术语和定义
下列术语和定义适用于本文件。
3.1蜂蜜honey
蜜蜂采集植物的花蜜、分泌物或蜜露,与自身分必物混合后,经充分酿造而成的天然甜物质。
3.2龙眼longan
龙眼(Dimocarpus longan Lour.)又名圆酿、桂圆、羊眼果树,无患子科、龙眼属植物。
3.3实时荧光PCR real time PCR
在PCR反应体系中加入荧光基团,利用荧光信号的积累实时监控整个PCR扩增过程,实现对起始模板的定量及定性分析。
3.4Ct值cycle threshold
每个反应管内的荧光信号到达设定的域值时所经历的循环数。
标准图片预览




标准内容
中华人民共和国出入境检验检疫行业标准SN/T4848.6—2017
出口蜂蜜中常见蜜源植物成分的检测方法实时荧光PCR法
第6部分:龙眼
Identification of common honey plant species in export honey-Real-timePCRmethod-
Part 6:Longan
2017-07-21发布
中华人民共和国
国家质量监督检验检疫总局
2018-03-01实施
SN/T4848.6—2017
SN/T4848《出口蜂蜜中常见蜜源植物成分的检测方法实时荧光PCR法》共分为8部分:第1部分:荆条;
第2部分:油菜;
第3部分:洋槐;
第4部分:桉树;
第5部分:機树;
第6部分:龙眼;
第7部分:荔枝和龙眼;
第8部分:紫云英。
本部分为SN/T4848的第6部分。
本部分按照GB/T1.1一2009给出的规则起草。请注意本文件的某些内容可能涉及专利、本文件的发布机构不承担识别这些专利的责任本部分由国家认证认可监督管理委员会提出并归口。本部分起草单位:中国检验检疫科学研究院、中华人民共和国安徽出入境检验检疫局。本部分主要起草人:吴亚君、陈颖、杨艳歌、王斌、韩建勋、黄文胜、刘鸣畅、邓婷婷、宗凯。1
1范围
出口蜂蜜中常见蜜源植物成分的检测方法实时荧光PCR法
第6部分:龙眼
SN/T4848的本部分规定了出口蜂蜜中龙眼成分的实时荧光PCR检测方法。SN/T4848.6—2017
本部分适用于出口蜂蜜中龙眼成分的定性检测。本部分所规定方法的最低检出限(LOD)为0.5%(质量百分比)。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB/T6682分析实验室用水规格和试验方法GB14963—2011食品安全国家标准蜂蜜GB/T27403—2008实验室质量控制规范食品分子生物学检测
3术语和定义
下列术语和定义适用于本文件。3.1
蜂蜜honey
蜜蜂采集植物的花蜜、分泌物或密露3.2
龙眼longan
与自身分泌物混合后,经充分酿造而成的天然甜物质。龙眼(DimocarpuslonganLour.)又名圆眼、桂圆、羊眼果树,无患子科、龙眼属植物。3.3
realtimePCR
实时荧光PCR
在PCR反应体系中加人荧光基团,利用荧光信号的积累实时监控整个PCR扩增过程,实现对起始模板的定量及定性分析。
直cyclethreshold
每个反应管内的荧光信号到达设定的域值时所经历的循环数,4缩略语
下列缩略语适用于本文件。
DNA:脱氧核糖核酸(deoxyribonuleicacid)1
SN/T4848.6—2017
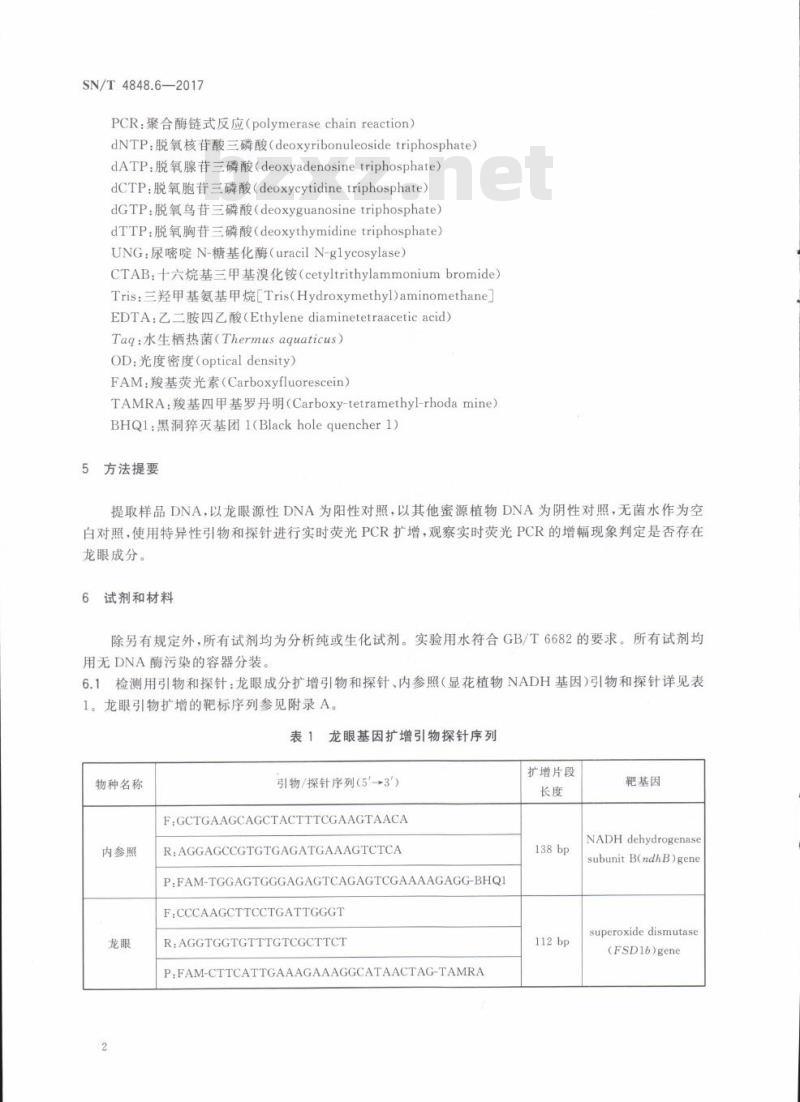
PCR:聚合酶链式反应(polymerasechainreaction)dNTP:脱氧核苷酸三磷酸(deoxyribonuleosidetriphosphate)dATP:脱氧腺苷三磷酸(deoxyadenosinetriphosphate)dCTP:脱氧胞苷三磷酸(deoxycytidinetriphosphate)dGTP:脱氧鸟苷三磷酸(deoxyguanosinetriphosphate)dTTP:脱氧胸苷三磷酸(deoxythymidinetriphosphate)UNG:尿嘧啶N-糖基化酶(uracilN-glycosylase)CTAB:十六烷基三甲基溴化铵(cetyltrithylammoniumbromide)Tris:三羟甲基氨基甲烷[Tris(Hydroxymethyl)aminomethaneEDTA:乙二胺四乙酸(Ethylenediaminetetraaceticacid)Taq:水生栖热菌(Thermusaquaticus)OD:光度密度(opticaldensity)FAM:羧基荧光素(Carboxyfluorescein)TAMRA:羧基四甲基罗丹明(Carboxy-tetramethyl-rhodamine)BHQ1:黑洞猝灭基团1(Blackholequencher1)方法提要此内容来自标准下载网
提取样品DNA,以龙眼源性DNA为阳性对照,以其他蜜源植物DNA为阴性对照,无菌水作为空白对照,使用特异性引物和探针进行实时荧光PCR扩增,观察实时荧光PCR的增幅现象判定是否存在龙眼成分。
6试剂和材料
除另有规定外,所有试剂均为分析纯或生化试剂。实验用水符合GB/T6682的要求。所有试剂均用无DNA酶污染的容器分装。
6.1检测用引物和探针:龙眼成分扩增引物和探针、内参照(显花植物NADH基因)引物和探针详见表1。龙眼引物扩增的靶标序列参见附录A。龙眼基因扩增引物探针序列
物种名称
内参照
引物/探针序列(5'-→3')
F:GCTGAAGCAGCTACTTTCGAAGTAACAR;AGGAGCCGTGTGAGATGAAAGTCTCAP:FAM-TGGAGTGGGAGAGTCAGAGTCGAAAAGAGG-BHQ1F:CCCAAGCTTCCTGATTGGGT
R:AGGTGGTGTTTGTCGCTTCT
P:FAM-CTTCATTGAAAGAAAGGCATAACTAG-TAMRA扩增片段
靶基因
NADH dehydrogenase
subunit B(ndhB)gene
superoxide dismutase
(FSD16)gene
2三氯甲烷(氯仿)。
6.3异丙醇。
体积分数为70%的乙醇。
NaCI溶液(1.2mol/L)。
蛋白酶K(20mg/mL)。
SN/T4848.6—2017
CTAB提取缓冲液:20g/LCTAB1.4mol/LNaCl,0.1mol/LTris-HCl,0.02mol/LNazEDTA,6.7
6.8CTAB沉淀液:5g/LCTAB40mmol/LNaCl。6.910XPCR缓冲液:200mmol/LTris-HClpH8.4),200mmol/LKCl,15mmol/LMgCl2实时荧光PCR反应混合液:12.5μL反应体系包括:1U~2U(Unit,酶学单位)的Taq酶、1×6.10
PCRbuffer、2.5mmol/L~4.0mmol/L的Mg2+、0.2U~1U的UNG酶、0.2mmol/L的d(A,C,G)TPs、0.2mmol/L~0.4mmol/LdUTP、400nmol/LROX染料(某些荧光PCR仪无需ROX校正)。7
仪器设备
实时荧光PCR仪
核酸蛋白分析仪或紫外分光光度计。7.3
恒温水浴锅。
离心机:离心力≥12000g。
微量移液器:0.5μ~10μ,10μ~100μ,20μ200μ,200μ~1000μ。恒温混匀仪。
涡旋震荡器。
pH计。
量筒:容量50mL。
烘箱。
检测步骤
DNA提取
蜂蜜沉淀DNA提取
蜂蜜样品50℃水浴20min至充分融化,上下颠倒混匀。取20mL蜂蜜样品,分成2管,每管10mL于50mL离心管中,加人无菌双蒸水至30mL,涡旋混匀,4000r/min离心10min,吸出上清(4℃贮存备用)。8.1.1.3
沉淀部分用1mL无菌水洗脱,分装于2mL离心管中,12000r/min离心5min,去除上清。加人600μLCTAB提取缓冲液,置于65℃恒温混匀仪中温育1h~2h,转速为650r/min;12000r/min离心10min。
转移上层清液至2mL离心管中;加0.7倍体积的三氯甲烷,剧烈震荡混匀,室温下12000r/min离心10min。
加人等体积CTAB沉淀液混匀,13000r/min离心10min弃上清,加人350μL1.2mol/LNaCl溶液,充分溶解沉淀。加人0.8倍体积的异丙醇混匀,一20℃放置0.5h~1h,12000r/min转速4℃离心10min~8.1.1.8
15min。
SN/T4848.6—2017
8.1.1.9弃上清,用70%乙醇洗涤沉淀一次,12000r/min转速下4℃离心10min。弃上清,室温下晾干。加人50μL100μL双蒸水,溶解沉淀,一20℃保存。8.1.1.10
8.1.2蜂蜜上清DNA提取
将上清分装到2个50mL离心管中,每管20mL,参照附录B步骤进行核酸DNA提取,DNA存放于一20℃保存。
8.2DNA浓度和纯度的测定
使用核酸蛋白分析仪或紫外分光光度计分别检测260nm和280nm处的吸光值A26和A280。DNA的浓度按照式(1)计算:
C=A×NX50/1000
式中:
DNA浓度,单位为微克每微升(ug/uL)A——260nm处的吸光值;
N核酸稀释倍数。
当A260/A280比值在1.7~2.0之间时,适宜于PCR扩增8.3
实时荧光PCR扩增
实时荧光PCR反应体系
实时荧光PCR反应体系的反应条件见表2。实时荧光PCR反应体系
实时荧光PCR反应混合液
正向引物(10μmol/L)
反向引物(10μmol/L)
探针(10μmol/L)
DNA模板(10ng/μL200ng/μL)无菌ddH20
8.3.2实时荧光PCR反应程序
内参照
内参照基因:50℃2min;95℃预变性10min;95℃15s,60℃1min,40个循环。龙眼FSDlb基因:50℃2min;95℃预变性10min;95℃15s,60℃1min,50个循环。9质量控制
以下条件有一条不满足时,实验视为无效a)空白对照:无荧光对数增长,相应的Ct值>50.0。b)
阴性对照:无荧光对数增长,相应的Ct值>50.0。(1)
SN/T4848.6—2017
阳性对照:有荧光对数增长,且荧光通道出现典型的扩增曲线,相应的Ct值≤30.0。c
结果判断与表述
结果判定
在符合第9章的情况下,结果判定如下:a)Ct值≤45,则判定为阳性。
Ct值≤50,则判定为阴性。
45结果表述
10.2.1内参照阴性,目标成分阴性,表述为“未提取到植物DNA组分”10.2.2
内参照阳性,目标成分阳性,表述为“检出龙眼成分”10.2.3
内参照阳性,目标成分阴性,表述为“未检出龙眼成分检测过程中防止交叉污染的措施检测过程中防止交叉污染的措施按照GB/T27403一2008中附录D的规定执行。S
SN/T4848.6-2017
附录A
(资料性附录)
龙眼成分的基因扩增靶标参考序列(GenBank:HM773382.1)龙眼成分的基因扩增靶标参考序列(GenBank:HM773382.1)为:CCCAAGCTTCCTGATTGGGTAAGTTAGCTTCATTGAAAGAAAGGCATAACTAGCTTGTTTATCCATTACCCTTTAATCTTTTTTAATTTTTCAGAAGCGACAAACACCACCT6
试剂盒组成
(资料性附录)
试剂盒组成及使用说明
WizardMagnetic食品DNA纯化试剂盒组成表B.1
试剂名称
裂解液A/LysisBufferA,Food
裂解液B/LysisBufferB,Food
沉淀溶液/recipitationSolution,Food体积
SN/T4848.6—2017
产品分类编号
注:以Promega公司WizardMagnetic食品DNA纯化试剂盒(GenomicDNAfromFood)为例。也可采用其他等效试剂盒。
操作步骤
上清分装到2个50mL离心管中,每管20mL,分别加人4mL裂解液A、2mL裂解液B,充分混匀,静置10min。加人5mL沉淀溶液,震荡混匀。加人150μL磁珠和0.9倍体积的异丙醇,室温静置1h,期间不时颠倒,置磁力架上5min,小心去除水相,其余步骤参照试剂盒说明书。
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
出口蜂蜜中常见蜜源植物成分的检测方法实时荧光PCR法
第6部分:龙眼
Identification of common honey plant species in export honey-Real-timePCRmethod-
Part 6:Longan
2017-07-21发布
中华人民共和国
国家质量监督检验检疫总局
2018-03-01实施
SN/T4848.6—2017
SN/T4848《出口蜂蜜中常见蜜源植物成分的检测方法实时荧光PCR法》共分为8部分:第1部分:荆条;
第2部分:油菜;
第3部分:洋槐;
第4部分:桉树;
第5部分:機树;
第6部分:龙眼;
第7部分:荔枝和龙眼;
第8部分:紫云英。
本部分为SN/T4848的第6部分。
本部分按照GB/T1.1一2009给出的规则起草。请注意本文件的某些内容可能涉及专利、本文件的发布机构不承担识别这些专利的责任本部分由国家认证认可监督管理委员会提出并归口。本部分起草单位:中国检验检疫科学研究院、中华人民共和国安徽出入境检验检疫局。本部分主要起草人:吴亚君、陈颖、杨艳歌、王斌、韩建勋、黄文胜、刘鸣畅、邓婷婷、宗凯。1
1范围
出口蜂蜜中常见蜜源植物成分的检测方法实时荧光PCR法
第6部分:龙眼
SN/T4848的本部分规定了出口蜂蜜中龙眼成分的实时荧光PCR检测方法。SN/T4848.6—2017
本部分适用于出口蜂蜜中龙眼成分的定性检测。本部分所规定方法的最低检出限(LOD)为0.5%(质量百分比)。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB/T6682分析实验室用水规格和试验方法GB14963—2011食品安全国家标准蜂蜜GB/T27403—2008实验室质量控制规范食品分子生物学检测
3术语和定义
下列术语和定义适用于本文件。3.1
蜂蜜honey
蜜蜂采集植物的花蜜、分泌物或密露3.2
龙眼longan
与自身分泌物混合后,经充分酿造而成的天然甜物质。龙眼(DimocarpuslonganLour.)又名圆眼、桂圆、羊眼果树,无患子科、龙眼属植物。3.3
realtimePCR
实时荧光PCR
在PCR反应体系中加人荧光基团,利用荧光信号的积累实时监控整个PCR扩增过程,实现对起始模板的定量及定性分析。
直cyclethreshold
每个反应管内的荧光信号到达设定的域值时所经历的循环数,4缩略语
下列缩略语适用于本文件。
DNA:脱氧核糖核酸(deoxyribonuleicacid)1
SN/T4848.6—2017
PCR:聚合酶链式反应(polymerasechainreaction)dNTP:脱氧核苷酸三磷酸(deoxyribonuleosidetriphosphate)dATP:脱氧腺苷三磷酸(deoxyadenosinetriphosphate)dCTP:脱氧胞苷三磷酸(deoxycytidinetriphosphate)dGTP:脱氧鸟苷三磷酸(deoxyguanosinetriphosphate)dTTP:脱氧胸苷三磷酸(deoxythymidinetriphosphate)UNG:尿嘧啶N-糖基化酶(uracilN-glycosylase)CTAB:十六烷基三甲基溴化铵(cetyltrithylammoniumbromide)Tris:三羟甲基氨基甲烷[Tris(Hydroxymethyl)aminomethaneEDTA:乙二胺四乙酸(Ethylenediaminetetraaceticacid)Taq:水生栖热菌(Thermusaquaticus)OD:光度密度(opticaldensity)FAM:羧基荧光素(Carboxyfluorescein)TAMRA:羧基四甲基罗丹明(Carboxy-tetramethyl-rhodamine)BHQ1:黑洞猝灭基团1(Blackholequencher1)方法提要此内容来自标准下载网
提取样品DNA,以龙眼源性DNA为阳性对照,以其他蜜源植物DNA为阴性对照,无菌水作为空白对照,使用特异性引物和探针进行实时荧光PCR扩增,观察实时荧光PCR的增幅现象判定是否存在龙眼成分。
6试剂和材料
除另有规定外,所有试剂均为分析纯或生化试剂。实验用水符合GB/T6682的要求。所有试剂均用无DNA酶污染的容器分装。
6.1检测用引物和探针:龙眼成分扩增引物和探针、内参照(显花植物NADH基因)引物和探针详见表1。龙眼引物扩增的靶标序列参见附录A。龙眼基因扩增引物探针序列
物种名称
内参照
引物/探针序列(5'-→3')
F:GCTGAAGCAGCTACTTTCGAAGTAACAR;AGGAGCCGTGTGAGATGAAAGTCTCAP:FAM-TGGAGTGGGAGAGTCAGAGTCGAAAAGAGG-BHQ1F:CCCAAGCTTCCTGATTGGGT
R:AGGTGGTGTTTGTCGCTTCT
P:FAM-CTTCATTGAAAGAAAGGCATAACTAG-TAMRA扩增片段
靶基因
NADH dehydrogenase
subunit B(ndhB)gene
superoxide dismutase
(FSD16)gene
2三氯甲烷(氯仿)。
6.3异丙醇。
体积分数为70%的乙醇。
NaCI溶液(1.2mol/L)。
蛋白酶K(20mg/mL)。
SN/T4848.6—2017
CTAB提取缓冲液:20g/LCTAB1.4mol/LNaCl,0.1mol/LTris-HCl,0.02mol/LNazEDTA,6.7
6.8CTAB沉淀液:5g/LCTAB40mmol/LNaCl。6.910XPCR缓冲液:200mmol/LTris-HClpH8.4),200mmol/LKCl,15mmol/LMgCl2实时荧光PCR反应混合液:12.5μL反应体系包括:1U~2U(Unit,酶学单位)的Taq酶、1×6.10
PCRbuffer、2.5mmol/L~4.0mmol/L的Mg2+、0.2U~1U的UNG酶、0.2mmol/L的d(A,C,G)TPs、0.2mmol/L~0.4mmol/LdUTP、400nmol/LROX染料(某些荧光PCR仪无需ROX校正)。7
仪器设备
实时荧光PCR仪
核酸蛋白分析仪或紫外分光光度计。7.3
恒温水浴锅。
离心机:离心力≥12000g。
微量移液器:0.5μ~10μ,10μ~100μ,20μ200μ,200μ~1000μ。恒温混匀仪。
涡旋震荡器。
pH计。
量筒:容量50mL。
烘箱。
检测步骤
DNA提取
蜂蜜沉淀DNA提取
蜂蜜样品50℃水浴20min至充分融化,上下颠倒混匀。取20mL蜂蜜样品,分成2管,每管10mL于50mL离心管中,加人无菌双蒸水至30mL,涡旋混匀,4000r/min离心10min,吸出上清(4℃贮存备用)。8.1.1.3
沉淀部分用1mL无菌水洗脱,分装于2mL离心管中,12000r/min离心5min,去除上清。加人600μLCTAB提取缓冲液,置于65℃恒温混匀仪中温育1h~2h,转速为650r/min;12000r/min离心10min。
转移上层清液至2mL离心管中;加0.7倍体积的三氯甲烷,剧烈震荡混匀,室温下12000r/min离心10min。
加人等体积CTAB沉淀液混匀,13000r/min离心10min弃上清,加人350μL1.2mol/LNaCl溶液,充分溶解沉淀。加人0.8倍体积的异丙醇混匀,一20℃放置0.5h~1h,12000r/min转速4℃离心10min~8.1.1.8
15min。
SN/T4848.6—2017
8.1.1.9弃上清,用70%乙醇洗涤沉淀一次,12000r/min转速下4℃离心10min。弃上清,室温下晾干。加人50μL100μL双蒸水,溶解沉淀,一20℃保存。8.1.1.10
8.1.2蜂蜜上清DNA提取
将上清分装到2个50mL离心管中,每管20mL,参照附录B步骤进行核酸DNA提取,DNA存放于一20℃保存。
8.2DNA浓度和纯度的测定
使用核酸蛋白分析仪或紫外分光光度计分别检测260nm和280nm处的吸光值A26和A280。DNA的浓度按照式(1)计算:
C=A×NX50/1000
式中:
DNA浓度,单位为微克每微升(ug/uL)A——260nm处的吸光值;
N核酸稀释倍数。
当A260/A280比值在1.7~2.0之间时,适宜于PCR扩增8.3
实时荧光PCR扩增
实时荧光PCR反应体系
实时荧光PCR反应体系的反应条件见表2。实时荧光PCR反应体系
实时荧光PCR反应混合液
正向引物(10μmol/L)
反向引物(10μmol/L)
探针(10μmol/L)
DNA模板(10ng/μL200ng/μL)无菌ddH20
8.3.2实时荧光PCR反应程序
内参照
内参照基因:50℃2min;95℃预变性10min;95℃15s,60℃1min,40个循环。龙眼FSDlb基因:50℃2min;95℃预变性10min;95℃15s,60℃1min,50个循环。9质量控制
以下条件有一条不满足时,实验视为无效a)空白对照:无荧光对数增长,相应的Ct值>50.0。b)
阴性对照:无荧光对数增长,相应的Ct值>50.0。(1)
SN/T4848.6—2017
阳性对照:有荧光对数增长,且荧光通道出现典型的扩增曲线,相应的Ct值≤30.0。c
结果判断与表述
结果判定
在符合第9章的情况下,结果判定如下:a)Ct值≤45,则判定为阳性。
Ct值≤50,则判定为阴性。
45
10.2.1内参照阴性,目标成分阴性,表述为“未提取到植物DNA组分”10.2.2
内参照阳性,目标成分阳性,表述为“检出龙眼成分”10.2.3
内参照阳性,目标成分阴性,表述为“未检出龙眼成分检测过程中防止交叉污染的措施检测过程中防止交叉污染的措施按照GB/T27403一2008中附录D的规定执行。S
SN/T4848.6-2017
附录A
(资料性附录)
龙眼成分的基因扩增靶标参考序列(GenBank:HM773382.1)龙眼成分的基因扩增靶标参考序列(GenBank:HM773382.1)为:CCCAAGCTTCCTGATTGGGTAAGTTAGCTTCATTGAAAGAAAGGCATAACTAGCTTGTTTATCCATTACCCTTTAATCTTTTTTAATTTTTCAGAAGCGACAAACACCACCT6
试剂盒组成
(资料性附录)
试剂盒组成及使用说明
WizardMagnetic食品DNA纯化试剂盒组成表B.1
试剂名称
裂解液A/LysisBufferA,Food
裂解液B/LysisBufferB,Food
沉淀溶液/recipitationSolution,Food体积
SN/T4848.6—2017
产品分类编号
注:以Promega公司WizardMagnetic食品DNA纯化试剂盒(GenomicDNAfromFood)为例。也可采用其他等效试剂盒。
操作步骤
上清分装到2个50mL离心管中,每管20mL,分别加人4mL裂解液A、2mL裂解液B,充分混匀,静置10min。加人5mL沉淀溶液,震荡混匀。加人150μL磁珠和0.9倍体积的异丙醇,室温静置1h,期间不时颠倒,置磁力架上5min,小心去除水相,其余步骤参照试剂盒说明书。
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。