SN/T 4001-2015
基本信息
标准号: SN/T 4001-2015
中文名称:动物检疫方法标准验证程序
标准类别:商检行业标准(SN)
标准状态:现行
出版语种:简体中文
下载格式:.zip .pdf
下载大小:8682559

标准分类号
关联标准
出版信息
相关单位信息
标准简介
SN/T 4001-2015.Protocol of verification for animal quarantine method standards.
1范围
SN/T 4001规定了动物检疫方法标准制修订过程中的验证要求及程序。
SN/T 4001适用于出人境动物检疫方法标准制修订过程中的验证活动。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
OIE《陆生动物诊断试验和疫苗手册》(2012版)第1.1.5章“动物传染病诊断试验确认原则和方法”(OIE Terrestrial Manual 2012,CHAPTER1.1.5 PRINCIPLES AND METHODS OF VALIDATION OF DIAGNOSTIC ASSAYS FOR INFECTIOUS DISEASES).
3术语和定义
下列术语和定义适用于本文件。
3.1方法标准method standard
为实现特定检测目的,对所采取的途径、步骤和手段的规定要求所做的统一认定。它以科学、技术和实践经验的综合成果为基础经有关方面协商一致,由主管机构批准,以特定形式发布,作为共同遵守的准则和依据。
3.2验证verification
通过提供客观证据对规定要求已得到满足的认定。
3.3确认validation
通过提供客观证据对特定的预期用途或应用要求已得到满足的认定。
3.4样品sample
取自某一整体的一个或多个部分,旨在提供该整体的相关信息,通常作为判断该整体的基础。
3.5临界值cut- off value
区分阴性和阳性结果的试验数值,是连续的检测结果中间的一个值。
1范围
SN/T 4001规定了动物检疫方法标准制修订过程中的验证要求及程序。
SN/T 4001适用于出人境动物检疫方法标准制修订过程中的验证活动。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
OIE《陆生动物诊断试验和疫苗手册》(2012版)第1.1.5章“动物传染病诊断试验确认原则和方法”(OIE Terrestrial Manual 2012,CHAPTER1.1.5 PRINCIPLES AND METHODS OF VALIDATION OF DIAGNOSTIC ASSAYS FOR INFECTIOUS DISEASES).
3术语和定义
下列术语和定义适用于本文件。
3.1方法标准method standard
为实现特定检测目的,对所采取的途径、步骤和手段的规定要求所做的统一认定。它以科学、技术和实践经验的综合成果为基础经有关方面协商一致,由主管机构批准,以特定形式发布,作为共同遵守的准则和依据。
3.2验证verification
通过提供客观证据对规定要求已得到满足的认定。
3.3确认validation
通过提供客观证据对特定的预期用途或应用要求已得到满足的认定。
3.4样品sample
取自某一整体的一个或多个部分,旨在提供该整体的相关信息,通常作为判断该整体的基础。
3.5临界值cut- off value
区分阴性和阳性结果的试验数值,是连续的检测结果中间的一个值。
标准图片预览




标准内容
中华人民共和国出入境检验检疫行业标准SN/T4001—2015
动物检疫方法标准验证程序
Protocol of verification for animal quarantine method standards2015-02-09发布
中华人民共和国
国家质量监督检验检疫总局
2015-09-01实施
本标准按照GB/T1.1—2009给出的规则起草。本标准由国家认证认可监督管理委员会提出并归口。SN/T4001—2015
本标准起草单位:中华人民共和国北京出入境检验检疫局、北京市兽药监察所、中华人民共和国辽宁出入境检验检疫局、中华人民共和国江苏出入境检验检疫局、中国合格评定国家认可委员会本标准主要起草人:马贵平、史喜菊、李冰玲、郭志红、李叶、姜焱、李炎鑫、苏志明,范围
动物检疫方法标准验证程序
本标准规定了动物检疫方法标准制修订过程中的验证要求及程序。本标准适用于出人境动物检疫方法标准制修订过程中的验证活动。规范性引用文件
下列文件对于本文件的应用是必不SN/T4001—2015
是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单适用于本文件。OIE《陆生动物诊断试验和疫苗手册》(2012版)第1.1.章“动物传染病诊断试验确认原则和方法”(OIETerrestrialManual2012,CHAPTERI.1.5PRINCIPLES ANDMETHODS OFVALIDATIONOFDIAGNOSTICASSAYSFORINFECTIOU3术语和定义
下列术语和定义适用于本文件
method standard
方法标准
的规定要求所做的统一认定。它以科学、技术为实现特定检测目的,对所采取的途径、步骤和手和实践经验的综合成果为基础
经有关方面协商致由主管机构批准,以特定形式发布,作为共同遵守的准则和依据。
verification
通过提供客观证据对规定要求已得到满足的认定。3.3
确认validation
通过提供客观证据对特定的预期用途或应用要求已得到满足的认定3.4
sample
取自某一整体的一个或多个部分,旨在提供该整体的相关信息,通常作为判断该整体的基础。3.5
临界值
cut-off value
区分阴性和阳性结果的试验数值,是连续的检测结果中间的一个值。3.6
主repeatability
重复性
用同一方法对同一被分析物在相同条件下(设备、操作者、实验室和时间间隔)进行检测所得出的连续和独立的结果之间的致性
SN/T4001—2015
分析敏感性
analysissensitivity
在一个样品中能够被直接检测到被分析物的最小量,即最低检测限,3.8
诊断敏感性
diagnosis sensitivity
检出的阳性样本占被检阳性样品总数的百分比。3.9
Eanalytical specificity
分析特异性
在一大堆样品中能把所要检测的日标被分析物和其他组分区分开来的能力。3.10
speeificity
诊断特异性
检出的阴性样本占被检阴性样品总数的百分比,3.11
线性范围linearrange
检测结果或检测结果的转换值和日标检测物的浓度呈线性关系的数值范围。在线性范围内,检测结果准确度高,重复性好,结论可信度高3.12
reproducibility
再现性
由不同实验空的操作者用同一方法使用不同设备,对同一被分析物进行检测所得出的单次测试结果之间的一致性。
变异系数CV
各个重复的标准偏差与各个重复的平均值之比。4验证活动
验证基本要求
方法标准制修订人员应使用适当的检测方法和相关程序,对所有拟用于动物检疫的方法标准进行验证。验证时应考所有影响方法标准和检测结果的因素。这些因素包括:方法的适用性;样品的来源、数量及采集方式、储存条件、样品稀释浓度的选择;试剂的选择:标准品(包括参考动物的数量和感染状态的选择;试验对照的设立等。4.2采标验证的要求
当所制修订的方法标准等同采用知名技术组织或刊物认可或发布的方法,或者是国际标准方法时,应进行验证,验证活动至少应针对分析敏感性、分析特异性做出评价:如果条件许可,可对诊断敏感性诊断特异性的可信度做出说明。4.3其他方法的确认要求
当所制修订的方法标准采用的是非标准方法、实验室设计(制定)方法、超出其预定范围使用的标准方法,扩充和修改过的标准方法,在被证实适用于预期的检测/诊断自的之前,应进行确认。确认应尽可能全面,以满足预定用途或应用领域的需要。确认活动至少应针对分析敏感性、分析特异性做出评价;如果条件许可,可对诊断敏感性、诊断特异性的可信度做出说明。方法标准的确认活动可参照有关专门的技术标准进行。
TTKAONKAca
4.4其他要求
SN/T4001—2015
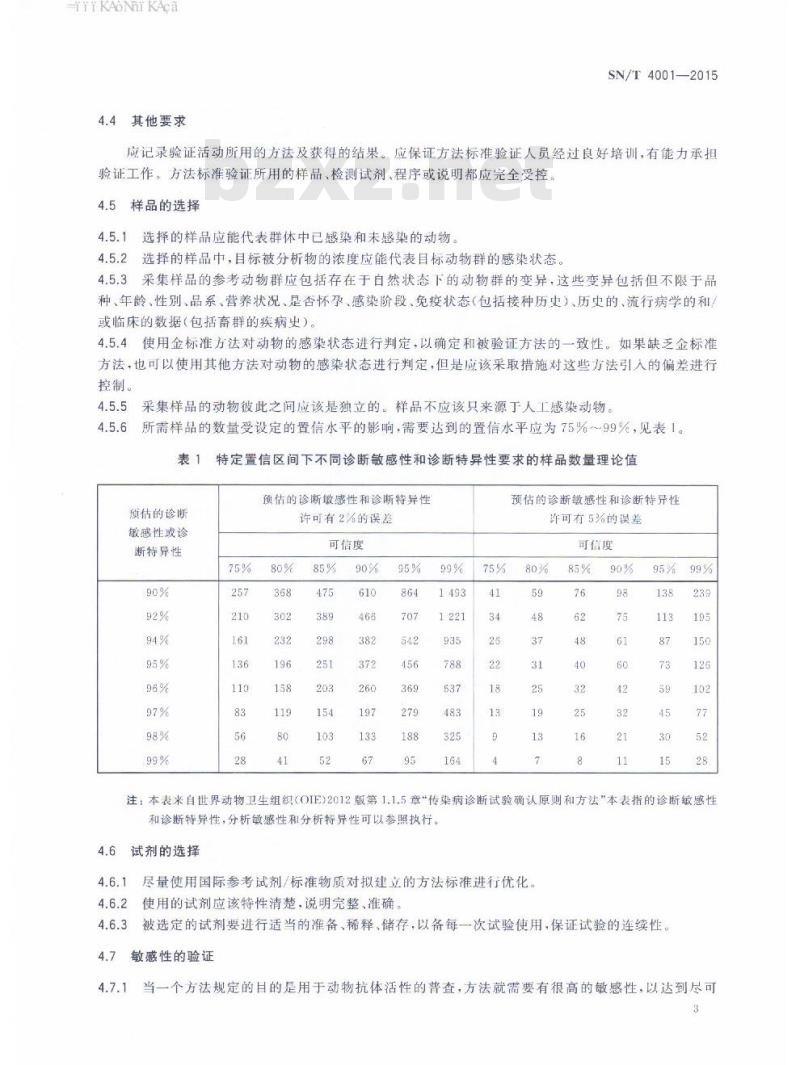
应记录验证活动所用的方法及获得的结果。应保证方法标准验证人员经过良好培训,有能力承担验证工作。方法标准验证所用的样品、检测试剂、程序或说明都应完全受控,4.5样品的选择
4.5.1选择的样品应能代表群体中已感染和未感染的动物。4.5.2选择的样品中,目标被分析物的浓度应能代表目标动物群的感染状态。4.5.3采集样品的参考动物群应包括存在于白然状态下的动物群的变异,这些变异包括但不限于品种、年龄、性别、品系、营养状况、是否怀孕、感染阶段、免疫状态(包括接种历史)、历史的、流行病学的和或临床的数据(包括畜群的疾病史)。4.5.4使用金标准方法对动物的感染状态进行判定,以确定和被验证方法的一致性。如果缺乏金标准方法,也可以使用其他方法对动物的感染状态进行判定,但是应该采取措施对这些方法引入的偏差进行控制。
4.5.5采集样品的动物彼此之间应该是独立的。样品不应该只来源丁人工感染动物。4.5.6
所需样品的数量受设定的置信水平的影响,需要达到的置信水平应为75%~99%,见表1。表1
特定置信区间下不同诊断敏感性和诊断特异性要求的样品数量理论值预估的诊断敏感性和诊断特异性预估的诊断
敏感性或诊
断特异性
许可有2%的误差
可信度
预估的诊断敏感性和诊断特异性许可有5%的误差
可信度
注:本表来自世界动物卫生组织(OIE)2012版第1.1.5章“传染病诊断试验确认原则和方法”本表指的诊断敏感性和诊断特异性,分析敏感性和分析特异性可以参照执行。4.6
试剂的选择
尽量使用国际参考试剂/标准物质对拟建立的方法标准进行优化。使用的试剂应该特性清楚,说明完整、准确,4.6.2
4.6.3被选定的试剂要进行适当的准备,稀释、储存,以备每一次试验使用,保证试验的连续性。4.7
敏感性的验证
当一个方法规定的目的是用于动物抗体活性的普查,方法就需要有很高的敏感性,以达到尽可3
-TKAONiKAca
SN/T4001—2015
能地检测出受感染动物,如果方法不具有这种很高的敏感性,就不适合作为一个筛选方法4.7.2评估敏感性所使用的样品可以通过对已知目标被分析物含量的标准样品进行有限稀释而得到。4.7.3当由于没有标准品或已知浓度的样品而不能获得客观的绝对度量时,可以通过对已知阳性的样品进行有限稀释而获得,
4.7.4当不能获得已知浓度的标准品或样品时,还可以使用加人已知量的日标被分析物的样品。但这种样品可能和从临床病例中获得的样品有本质的不同,在对结果进行分析时要考虑到这一点。4.7.5应该尽可能使用标准样品,以提高评估的置信度。4.8特异性的验证
4.8.1根据方法标准的要求确定诊断方法的合适的特异性具有足够的特异性。
4.8.2尽可能使用标准样品,以提高评估的置信度当定法标准用于确诊试验时,方法标准应4.8.3方法标准的特异性评估要使用一组样品样品应包括含有目标被分析物的样品和与目标被分析物相似的样品。
4.8.4可使用加人日标被分析物或与目标被分析物相似的样品,对特异性进行分析。但是这种样品可能和从临床病例中得到的样品有本质的不同·在对结果进行分析时要考虑到这一点4.9重复性的验证
4.9.1重复性所选择的样品应为在方法的线性范围内具有代表性的样品。重复性验证分为组内重复和组间重复。组内重复性的验证由同来完成,至少要用3个样品(最好是5个),每个样品至少必须做3个完全相同的重复:组间重复性的验证出不同的人在不同时间完成,要求至少由2个或2个以上的人分别在不同的时间(至少是520次试验米检测
进行至少
数(Cy.组内变异系数要
4.9.2重复性检测结果用于确定变异系小于或等于25%,组间变异系数要小于或等于30%。如果超过30%,就需要进行更多的初步研究,以证明该方法是足够稳定的;如果不能证明方法具有足够的重复性,应该考虑放弃对这一方法的验证4.10线性范围
应尽可能地对方法的线性范围进行确定,有效的检测结果应落在线性范围之内4.11临界值(Cut-off值)
4.11.1Cut-off值的选择应适应于方法要求的日的。在同个检测系统中,用于筛选的试验需要具有高敏感性,而用于确诊的试验则需要具有高特兄性,因而这两种目的的试验就应该有不同的Cut-off值,以适应不同的用途。
4.11.2Cutoff值的建立有3种方式:根据感染的和未感染的参考动物的检测结果的频率分布米确定;只根据未感染动物检测结果的频率分布来确定;基于从目标动物群中随机抽取的血清的检测结果。4.11.3如果已感染和未感染动物的检测结果的分布出现了一定的交叉,就可能需要两个Cut-off值,一个用于定义高敏感性,一个用丁定义高特异性。面那些落在这两个白分比之间的结果就被定义为可疑的或不确定的结果,需要用确诊方法进行检测或重新检测。4.12方法标准间的比较和协调
4.12.1方法标准间比较的目的是为了证明新方法和现有技术的一致程度。4.12.2方法标准间比较包括对方法的工作特性(如敏感性和特异性)或对方法的操作特性(如成本,所需环境、时间周期、检测量等)进行比较4
IKANiKAa
SN/T4001—2015
4.12.3当有OIE标准或其他国际标准时,应该使用这些标准进行方法的比较研究,将新方法追溯到国际标准方法和/或国际标准,实现与国际标准方法的协调。4.12.4当存在检测日标被分析物的标准方法时,应该使拟建立的方法标准与标准方法取得协调4.12.5应使用相同的血清对照和/或标准。如果有国际标准,应将其应用到方法标准的比较活动中。4.12.6与其他方法协同使用的新方法,需要对与检测数据和结果判断有关的问题进行解释说明。4.13再现性的验证
方法。
所建立的方法标准要向多个实验室推广使用时,要对其再现性进行评估。对再现性的评估至少需要在3个有资质的实验室进行,使用相同的样品组,使用相同的检测4.13.3再现性评估的样品数应不少于重复性试验所用样品数。这些样品是来自于日标动物群的独立样品,代表群体中的日标被分析物的活性范围。当缺乏这样的样品时,可以对已知阳性样品进行系列稀释以达到需要的活性范围。
4.13.4验证再现性所用的样品,应逐个进行分装、编码、分发、运输到参加实验室或分发给实验员,在相同的条件下储存。
4.13.5对参加实验空(或实验员)的检测数据进行收集评估。这些数据包括实验室(或实验员)间平均值、标准偏差、每个样品和对照的变化范围。4.13.6进行再现性评估时,建议每个实验室(或每个实验员)将每个样品做2个或3个重复,以进一步评估方法在实验室内部的重复性。4.13.7将两个实验空(或实验员)的平均值按式(1)进行比较如果2
y1,32—两个实验室的检测平均值一重复性标准偏差:
再现性标准偏差。
则认为两个实验室检测结果的平均值在统计学上没有显著差异4.14:方法的应用
只有那些表现出能够适应检测目的的方法,才可以被应用到实际检测工作中。在应用过程中得到行业、国家、地区或国际认可的方法才能够上升为标准。4.15方法有效性的控制
4.15.1内部质量控制
对拟验证的方法标准应制定内部质量控制计划以监控和维持方法的有效性。内部质量控制的方法包括空白试验、标准曲线核查、仪器设备的定期检定、平行样检测、加入标准样品、内部比对试验、言样检测、编制质量控制图等
4.15.2外部质量控制
对拟验证的方法标准应制定外部质量控制计划,以监控和维持方法的有效性。外部质量控制方式包括实验室间比对和能力验证,HiKAONiKAca
SN/T4001—2015Www.bzxZ.net
方法标准的文件化
4.16.1应对拟验证的方法标准制定文件化的程序,程序应包括但不限于以下内容:方法名称:应用范围,参考文献,原理,方法特性,所需设施,所需试剂,样品采集、处理和储存需要,安全需要,操作步骤,质量控制步骤
4.16.2应对方法标准中影响检测结果的关键控制点进行说明。4.16.3文件化的方法标准应受控。4.16.4在开始验证和正式实施之前对最低质量要求(可接受的标准)进行描述,或者在建立方法之前进行描述
验证试验结束后的其他要求
验证试验结束后,要整理好相应的试验记录、试验结果报告,与有关方法标准审定申请一起提交给相关标准审定机构待中定
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
动物检疫方法标准验证程序
Protocol of verification for animal quarantine method standards2015-02-09发布
中华人民共和国
国家质量监督检验检疫总局
2015-09-01实施
本标准按照GB/T1.1—2009给出的规则起草。本标准由国家认证认可监督管理委员会提出并归口。SN/T4001—2015
本标准起草单位:中华人民共和国北京出入境检验检疫局、北京市兽药监察所、中华人民共和国辽宁出入境检验检疫局、中华人民共和国江苏出入境检验检疫局、中国合格评定国家认可委员会本标准主要起草人:马贵平、史喜菊、李冰玲、郭志红、李叶、姜焱、李炎鑫、苏志明,范围
动物检疫方法标准验证程序
本标准规定了动物检疫方法标准制修订过程中的验证要求及程序。本标准适用于出人境动物检疫方法标准制修订过程中的验证活动。规范性引用文件
下列文件对于本文件的应用是必不SN/T4001—2015
是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单适用于本文件。OIE《陆生动物诊断试验和疫苗手册》(2012版)第1.1.章“动物传染病诊断试验确认原则和方法”(OIETerrestrialManual2012,CHAPTERI.1.5PRINCIPLES ANDMETHODS OFVALIDATIONOFDIAGNOSTICASSAYSFORINFECTIOU3术语和定义
下列术语和定义适用于本文件
method standard
方法标准
的规定要求所做的统一认定。它以科学、技术为实现特定检测目的,对所采取的途径、步骤和手和实践经验的综合成果为基础
经有关方面协商致由主管机构批准,以特定形式发布,作为共同遵守的准则和依据。
verification
通过提供客观证据对规定要求已得到满足的认定。3.3
确认validation
通过提供客观证据对特定的预期用途或应用要求已得到满足的认定3.4
sample
取自某一整体的一个或多个部分,旨在提供该整体的相关信息,通常作为判断该整体的基础。3.5
临界值
cut-off value
区分阴性和阳性结果的试验数值,是连续的检测结果中间的一个值。3.6
主repeatability
重复性
用同一方法对同一被分析物在相同条件下(设备、操作者、实验室和时间间隔)进行检测所得出的连续和独立的结果之间的致性
SN/T4001—2015
分析敏感性
analysissensitivity
在一个样品中能够被直接检测到被分析物的最小量,即最低检测限,3.8
诊断敏感性
diagnosis sensitivity
检出的阳性样本占被检阳性样品总数的百分比。3.9
Eanalytical specificity
分析特异性
在一大堆样品中能把所要检测的日标被分析物和其他组分区分开来的能力。3.10
speeificity
诊断特异性
检出的阴性样本占被检阴性样品总数的百分比,3.11
线性范围linearrange
检测结果或检测结果的转换值和日标检测物的浓度呈线性关系的数值范围。在线性范围内,检测结果准确度高,重复性好,结论可信度高3.12
reproducibility
再现性
由不同实验空的操作者用同一方法使用不同设备,对同一被分析物进行检测所得出的单次测试结果之间的一致性。
变异系数CV
各个重复的标准偏差与各个重复的平均值之比。4验证活动
验证基本要求
方法标准制修订人员应使用适当的检测方法和相关程序,对所有拟用于动物检疫的方法标准进行验证。验证时应考所有影响方法标准和检测结果的因素。这些因素包括:方法的适用性;样品的来源、数量及采集方式、储存条件、样品稀释浓度的选择;试剂的选择:标准品(包括参考动物的数量和感染状态的选择;试验对照的设立等。4.2采标验证的要求
当所制修订的方法标准等同采用知名技术组织或刊物认可或发布的方法,或者是国际标准方法时,应进行验证,验证活动至少应针对分析敏感性、分析特异性做出评价:如果条件许可,可对诊断敏感性诊断特异性的可信度做出说明。4.3其他方法的确认要求
当所制修订的方法标准采用的是非标准方法、实验室设计(制定)方法、超出其预定范围使用的标准方法,扩充和修改过的标准方法,在被证实适用于预期的检测/诊断自的之前,应进行确认。确认应尽可能全面,以满足预定用途或应用领域的需要。确认活动至少应针对分析敏感性、分析特异性做出评价;如果条件许可,可对诊断敏感性、诊断特异性的可信度做出说明。方法标准的确认活动可参照有关专门的技术标准进行。
TTKAONKAca
4.4其他要求
SN/T4001—2015
应记录验证活动所用的方法及获得的结果。应保证方法标准验证人员经过良好培训,有能力承担验证工作。方法标准验证所用的样品、检测试剂、程序或说明都应完全受控,4.5样品的选择
4.5.1选择的样品应能代表群体中已感染和未感染的动物。4.5.2选择的样品中,目标被分析物的浓度应能代表目标动物群的感染状态。4.5.3采集样品的参考动物群应包括存在于白然状态下的动物群的变异,这些变异包括但不限于品种、年龄、性别、品系、营养状况、是否怀孕、感染阶段、免疫状态(包括接种历史)、历史的、流行病学的和或临床的数据(包括畜群的疾病史)。4.5.4使用金标准方法对动物的感染状态进行判定,以确定和被验证方法的一致性。如果缺乏金标准方法,也可以使用其他方法对动物的感染状态进行判定,但是应该采取措施对这些方法引入的偏差进行控制。
4.5.5采集样品的动物彼此之间应该是独立的。样品不应该只来源丁人工感染动物。4.5.6
所需样品的数量受设定的置信水平的影响,需要达到的置信水平应为75%~99%,见表1。表1
特定置信区间下不同诊断敏感性和诊断特异性要求的样品数量理论值预估的诊断敏感性和诊断特异性预估的诊断
敏感性或诊
断特异性
许可有2%的误差
可信度
预估的诊断敏感性和诊断特异性许可有5%的误差
可信度
注:本表来自世界动物卫生组织(OIE)2012版第1.1.5章“传染病诊断试验确认原则和方法”本表指的诊断敏感性和诊断特异性,分析敏感性和分析特异性可以参照执行。4.6
试剂的选择
尽量使用国际参考试剂/标准物质对拟建立的方法标准进行优化。使用的试剂应该特性清楚,说明完整、准确,4.6.2
4.6.3被选定的试剂要进行适当的准备,稀释、储存,以备每一次试验使用,保证试验的连续性。4.7
敏感性的验证
当一个方法规定的目的是用于动物抗体活性的普查,方法就需要有很高的敏感性,以达到尽可3
-TKAONiKAca
SN/T4001—2015
能地检测出受感染动物,如果方法不具有这种很高的敏感性,就不适合作为一个筛选方法4.7.2评估敏感性所使用的样品可以通过对已知目标被分析物含量的标准样品进行有限稀释而得到。4.7.3当由于没有标准品或已知浓度的样品而不能获得客观的绝对度量时,可以通过对已知阳性的样品进行有限稀释而获得,
4.7.4当不能获得已知浓度的标准品或样品时,还可以使用加人已知量的日标被分析物的样品。但这种样品可能和从临床病例中获得的样品有本质的不同,在对结果进行分析时要考虑到这一点。4.7.5应该尽可能使用标准样品,以提高评估的置信度。4.8特异性的验证
4.8.1根据方法标准的要求确定诊断方法的合适的特异性具有足够的特异性。
4.8.2尽可能使用标准样品,以提高评估的置信度当定法标准用于确诊试验时,方法标准应4.8.3方法标准的特异性评估要使用一组样品样品应包括含有目标被分析物的样品和与目标被分析物相似的样品。
4.8.4可使用加人日标被分析物或与目标被分析物相似的样品,对特异性进行分析。但是这种样品可能和从临床病例中得到的样品有本质的不同·在对结果进行分析时要考虑到这一点4.9重复性的验证
4.9.1重复性所选择的样品应为在方法的线性范围内具有代表性的样品。重复性验证分为组内重复和组间重复。组内重复性的验证由同来完成,至少要用3个样品(最好是5个),每个样品至少必须做3个完全相同的重复:组间重复性的验证出不同的人在不同时间完成,要求至少由2个或2个以上的人分别在不同的时间(至少是520次试验米检测
进行至少
数(Cy.组内变异系数要
4.9.2重复性检测结果用于确定变异系小于或等于25%,组间变异系数要小于或等于30%。如果超过30%,就需要进行更多的初步研究,以证明该方法是足够稳定的;如果不能证明方法具有足够的重复性,应该考虑放弃对这一方法的验证4.10线性范围
应尽可能地对方法的线性范围进行确定,有效的检测结果应落在线性范围之内4.11临界值(Cut-off值)
4.11.1Cut-off值的选择应适应于方法要求的日的。在同个检测系统中,用于筛选的试验需要具有高敏感性,而用于确诊的试验则需要具有高特兄性,因而这两种目的的试验就应该有不同的Cut-off值,以适应不同的用途。
4.11.2Cutoff值的建立有3种方式:根据感染的和未感染的参考动物的检测结果的频率分布米确定;只根据未感染动物检测结果的频率分布来确定;基于从目标动物群中随机抽取的血清的检测结果。4.11.3如果已感染和未感染动物的检测结果的分布出现了一定的交叉,就可能需要两个Cut-off值,一个用于定义高敏感性,一个用丁定义高特异性。面那些落在这两个白分比之间的结果就被定义为可疑的或不确定的结果,需要用确诊方法进行检测或重新检测。4.12方法标准间的比较和协调
4.12.1方法标准间比较的目的是为了证明新方法和现有技术的一致程度。4.12.2方法标准间比较包括对方法的工作特性(如敏感性和特异性)或对方法的操作特性(如成本,所需环境、时间周期、检测量等)进行比较4
IKANiKAa
SN/T4001—2015
4.12.3当有OIE标准或其他国际标准时,应该使用这些标准进行方法的比较研究,将新方法追溯到国际标准方法和/或国际标准,实现与国际标准方法的协调。4.12.4当存在检测日标被分析物的标准方法时,应该使拟建立的方法标准与标准方法取得协调4.12.5应使用相同的血清对照和/或标准。如果有国际标准,应将其应用到方法标准的比较活动中。4.12.6与其他方法协同使用的新方法,需要对与检测数据和结果判断有关的问题进行解释说明。4.13再现性的验证
方法。
所建立的方法标准要向多个实验室推广使用时,要对其再现性进行评估。对再现性的评估至少需要在3个有资质的实验室进行,使用相同的样品组,使用相同的检测4.13.3再现性评估的样品数应不少于重复性试验所用样品数。这些样品是来自于日标动物群的独立样品,代表群体中的日标被分析物的活性范围。当缺乏这样的样品时,可以对已知阳性样品进行系列稀释以达到需要的活性范围。
4.13.4验证再现性所用的样品,应逐个进行分装、编码、分发、运输到参加实验室或分发给实验员,在相同的条件下储存。
4.13.5对参加实验空(或实验员)的检测数据进行收集评估。这些数据包括实验室(或实验员)间平均值、标准偏差、每个样品和对照的变化范围。4.13.6进行再现性评估时,建议每个实验室(或每个实验员)将每个样品做2个或3个重复,以进一步评估方法在实验室内部的重复性。4.13.7将两个实验空(或实验员)的平均值按式(1)进行比较如果2
y1,32—两个实验室的检测平均值一重复性标准偏差:
再现性标准偏差。
则认为两个实验室检测结果的平均值在统计学上没有显著差异4.14:方法的应用
只有那些表现出能够适应检测目的的方法,才可以被应用到实际检测工作中。在应用过程中得到行业、国家、地区或国际认可的方法才能够上升为标准。4.15方法有效性的控制
4.15.1内部质量控制
对拟验证的方法标准应制定内部质量控制计划以监控和维持方法的有效性。内部质量控制的方法包括空白试验、标准曲线核查、仪器设备的定期检定、平行样检测、加入标准样品、内部比对试验、言样检测、编制质量控制图等
4.15.2外部质量控制
对拟验证的方法标准应制定外部质量控制计划,以监控和维持方法的有效性。外部质量控制方式包括实验室间比对和能力验证,HiKAONiKAca
SN/T4001—2015Www.bzxZ.net
方法标准的文件化
4.16.1应对拟验证的方法标准制定文件化的程序,程序应包括但不限于以下内容:方法名称:应用范围,参考文献,原理,方法特性,所需设施,所需试剂,样品采集、处理和储存需要,安全需要,操作步骤,质量控制步骤
4.16.2应对方法标准中影响检测结果的关键控制点进行说明。4.16.3文件化的方法标准应受控。4.16.4在开始验证和正式实施之前对最低质量要求(可接受的标准)进行描述,或者在建立方法之前进行描述
验证试验结束后的其他要求
验证试验结束后,要整理好相应的试验记录、试验结果报告,与有关方法标准审定申请一起提交给相关标准审定机构待中定
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。